概要
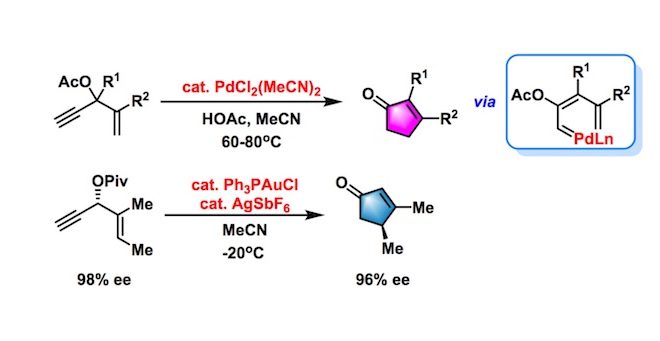
Rautenstrauch重排(Rautenstrauch rearrangement)是炔丙醇酯在过渡金属催化下进行环化重排,形成环戊烯酮的反应。1984年Rautenstrauch课题组首次报道了Pd(II)催化的炔丙醇乙酸酯的重排反应。2005年,Toste与Gagosz研究组采用亲碳性更高的Au(I)作为催化剂,使该反应的有效性大为提高。2016年,Lautens课题组研究发现加入质子源能够以较高的产率获得取代环戊烯酮。目前该反应已广泛应用于各类天然产物全合成的核心步骤。
基本文献
- [1] V. Rautenstrauch, J. Org. Chem., 1984, 49, 950. doi: 10.1021/jo00179a044.
- [2] X. Shi, D. J. Gorin, F. D. Toste, J. Am. Chem. Soc., 2005, 127, 5802. doi: 10.1021/ja051689g.
- [3]C. Burki, A. Whyte, S. Arndt, A. Stephen K. Hashmi, M. Lautens, Org. Lett. 2016, 18, 5058. doi:10.1021/acs.orglett.6b02505 .
反应机理
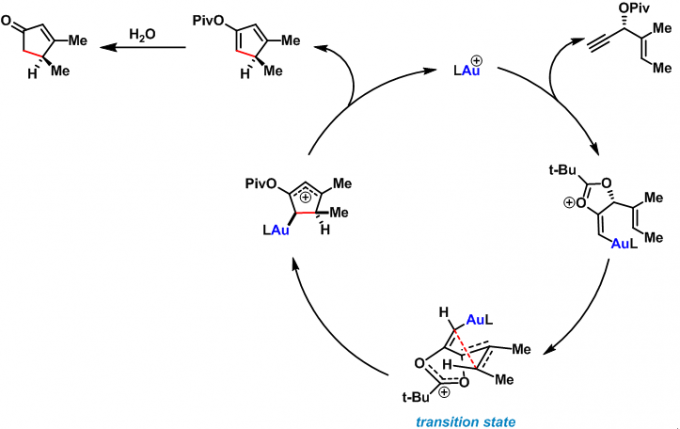
反应机理涉及金催化的炔丙醇酯的环合异构化与随后的特戊酸环状烯醇酯的水解过程。加入质子源可以极大地提高环戊烯酮的产率。与烯醇酯中间体水解的机理相一致。
反应实例
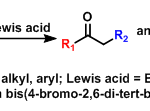
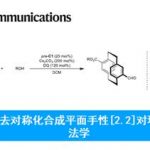
对映选择性去芳构化Rautenstrauch重排[1]
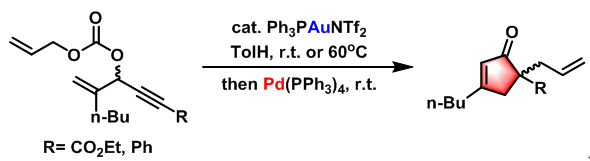
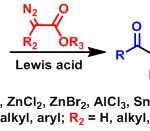
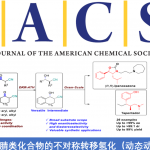
Rautenstrauch 烯丙基化方法[2]
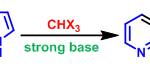
aza-Rautenstrauch环化[3]
实验步骤
在带有磁力搅拌子的反应瓶内加入1-乙炔基-2-丙烯基特戊酸酯 (100 mg, 1 eq)的乙腈溶液 (底物浓度为0.1 M),再向该溶液中加入新制的 0.05M PPh3AuSbF6 (2 mol%)的DCM溶液(由化学计量的 PPh3AuCl 与 AgSbF6在二氯甲烷中反应后,经短硅胶柱过滤除去AgCl沉淀后制得)。将上述反应混合物在室温下搅拌,并采用TLC监控直至反应完成。反应结束后,将反应混合物直接用硅胶柱色谱进行分离纯化(采用正己烷与EtOAc混合溶剂作为洗脱剂)。
实验技巧
参考文献
- [1] W. Zi, H. Wu, F. D. Toste, J. Am. Chem. Soc, 2015, 137, 3225. doi: 10.1021/jacs.5b00613.
- [2] C. Bürki, A. Whyte, S. Arndt, A. S. K. Hashmi, M. Lautens, Org. Lett., 2016, 18, 5058. doi:10.1021/acs.orglett.6b05205.
- [3] K. A. DeKorver, R. P. Hsung, A. G. Lohse, Y. Zhang, Org. Lett., 2010,12, 1840. doi: 10.1021/ol100446p.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
















No comments yet.