本文作者:杉杉
导读
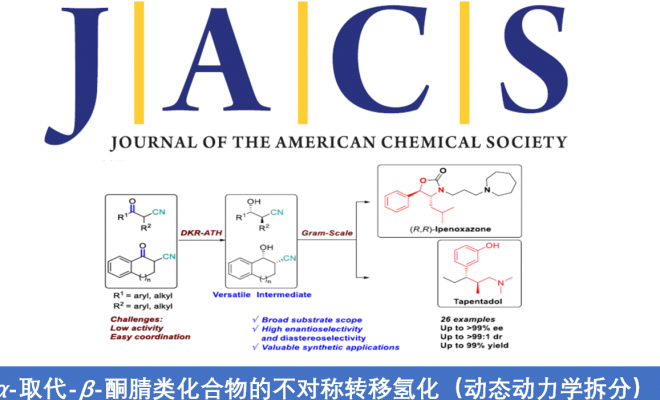
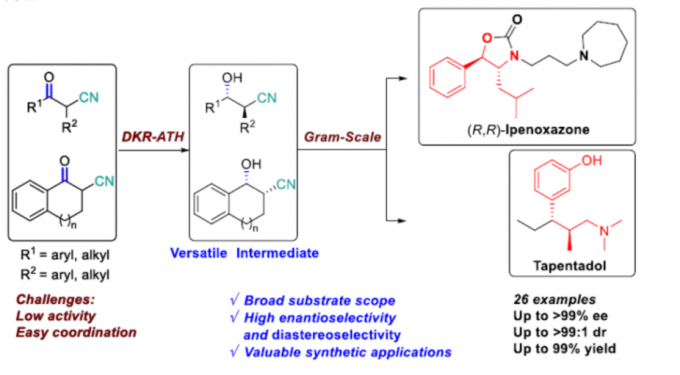
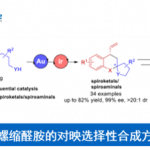
近日,南方科技大学张绪穆教授课题组在J. Am. Chem. Soc.上发表论文,报道了α-取代-β-酮腈的对映和非对映选择性还原催化反应。该反应涉及DKR-ATH方法,可同时构建具有两个连续的立体异构中心的β-羟基腈衍生物,具有高收率(94-98%)、优异的对映选择性(高达> 99%)和非对映选择性(高达>99:1)。此外,该方法可快速合成伊培沙宗(Ipenoxazone)和他喷他多(Tapentadol)药物中间体。南方科技大学张绪穆和陈根强为本论文共同通讯作者。
Asymmetric Transfer Hydrogenation of α‑Substituted-β-Keto Carbonitriles via Dynamic Kinetic Resolution
Fangyuan Wang, Tilong Yang, Ting Wu, Long-Sheng Zheng, Congcong Yin, Yongjie Shi, Xiang-Yu Ye, Gen-Qiang Chen,* and Xumu Zhang*
JAm. Chem. Soc.ASAP DOI:10.1021/jacs.0c13273
正文
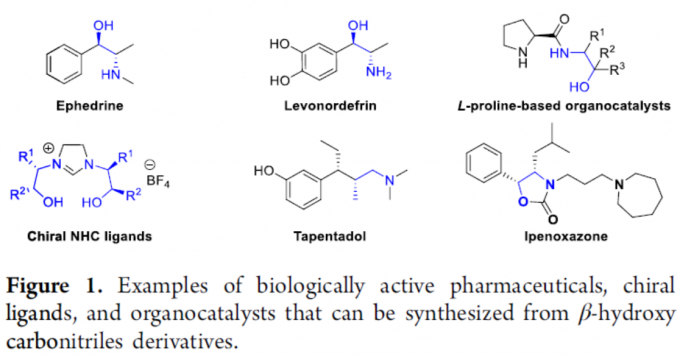
手性β-羟基腈化合物的氰基可作为氨基、羰基和酰胺基的前体,因此在有机合成中具有重要的价值。同时,光学纯的α-取代-β-羟基腈衍生物(如1,2-氨基醇和1,3-氨基醇)广泛存在于各种生物活性化合物、药物、手性助剂和手性配体中(Figure 1)。因此,开发有效的合成方法具有重要的意义。
迄今为止,动态动力学拆分(DKR)已经成为有机合成中的重要领域而通过DKR过程的不对称转化极具吸引力,它可实现外消旋底物有效的转化为目标的非对映体和对映体纯产物。尤其是酮底物不对称转移氢化(ATH)中的DKR,可将其转化为具有两个连续的立体中心的手性醇产物。1989年,Noyori等[1]首次报道了使用Ru-BINAP催化β-酮酯的不对称氢化反应。从那时起,利用含有手性N-磺酰基-1,2-二胺骨架的双功能Ru,Rh和Ir催化剂也成功进行了不对称转移氢化(ATH),进一步增强了还原DKR工艺的实用性。
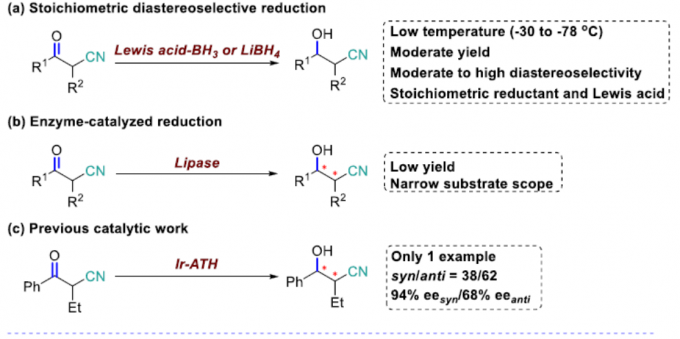
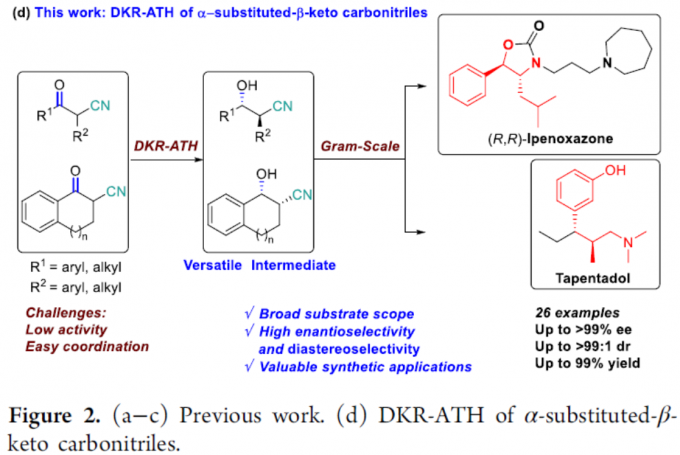
在过去的几十年中,已报道多种α-取代-β-羟基腈的非对映选择性合成方法。其中,锂化腈与醛之间的反式选择性羟醛缩合反应是直接构建α-取代-β-羟基腈的一种策略。但是,醛醇缩合中的立体化学选择性几乎不可控制。2001年,Dalpozzo等[2]报道了通过使用TiCl4/BH3或LiBH4/CeCl3从而实现非对映选择性还原α-烷基-β-酮腈的方法,其中低温是实现高非对映选择性的必要条件(Figure 2a)。α-取代-β-酮腈的直接动态动力学不对称还原策略是合成手性α-取代-β-酮腈最为直接的代表性方法之一。与α-取代-β-羰基化合物不同,很少有人报道α-取代-β-酮腈的催化不对称还原。2016年,Romano等[3]报道了酶催化α-取代-β-酮腈的还原反应,但存在收率低且底物范围窄的弊端(Figure 2b)。2014年,Rimoldi等[4]报道了过渡金属催化不对称转移氢化的唯一例子,但对映体和非对映体选择性均较差(Figure 2c)。因此,仍需开发一种有效的合成手性α-取代-β-羟基腈的方法。然而,由于氰基的存在,过渡金属催化的加氢中易导致配位并使催化剂失活。在此,南方科技大学张绪穆教授课题组报道了一种通过DKR策略实现α-取代-β-酮腈的不对称转移氢化反应,具有高收率、高对映和非对映选择性。此外,通过对伊培沙宗和他喷他多药物中间体的合成,进一步证明了反应的实用性(Figure 2d)。
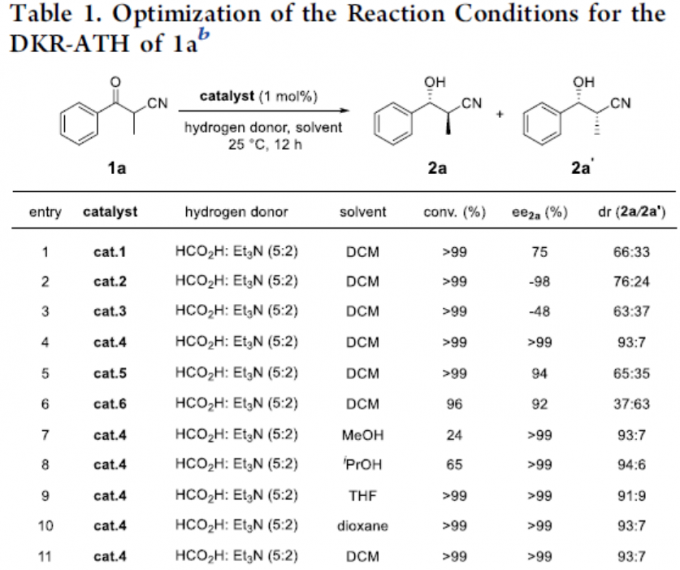
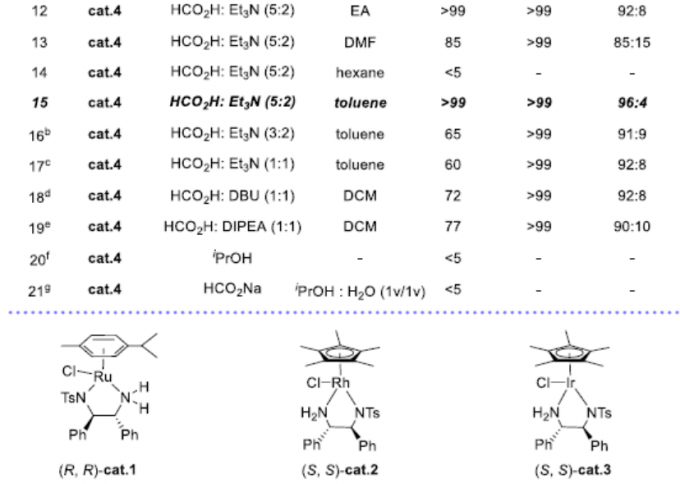
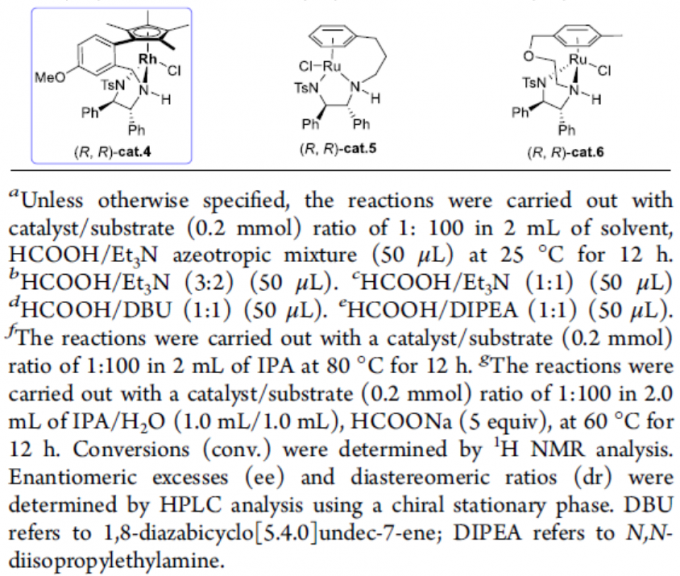
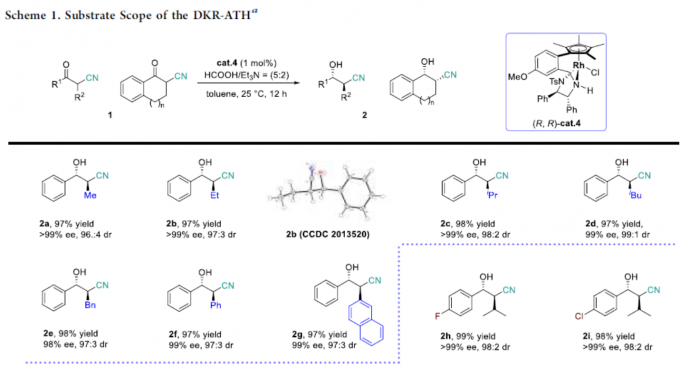
首先,作者以α-甲基-β-酮腈1a作为模型底物,进行了相关还原反应条件的筛选(Table 1)。反应的最佳条件为,以(R,R)-cat.4作为催化剂,HCOOH/Et3N的混合溶剂作为氢供体,可在甲苯溶剂反应,获得产物2a,其中转化率>99%,ee > 99%,dr为96:4。
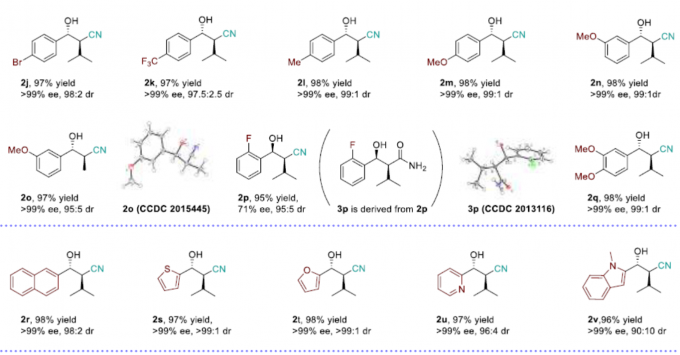
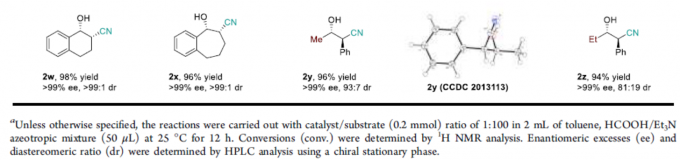
在获得上述最佳反应条件后,作者开始对底物1的范围进行了扩展(Scheme 1)。当R1为苯基,R2取代为不同烷基或芳基的底物(如甲基、乙基、萘基、苯基等)时,反应平稳进行,获得相应的产物2a–2g。其次,当R1的苯基具有不同取代基时,反应不受电子效应和定位效应的影响,均可获得相应的产物2h–2q。其中,具有邻位氟取代的底物,获得相反的顺式选择性产物2p。同时,当R1的取代基为萘基、噻吩基、呋喃基、吡啶基和2-吲哚基时,可获得相应的产物2r–2u。此外,环状化合物(2w和2x)以及R1取代基为甲基和乙基的化合物(2y和2z)也是合适的底物。
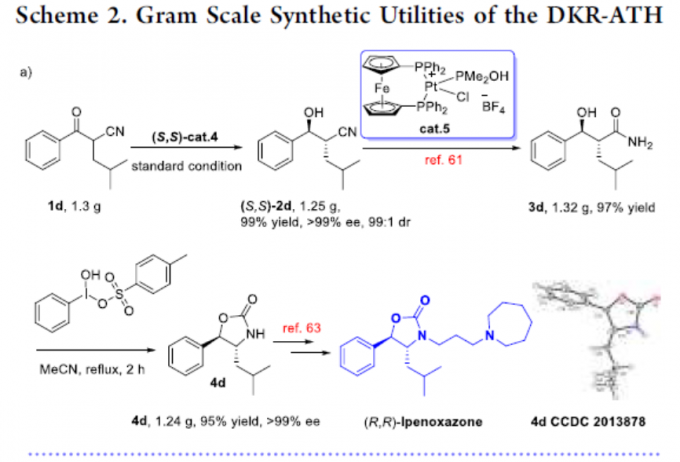
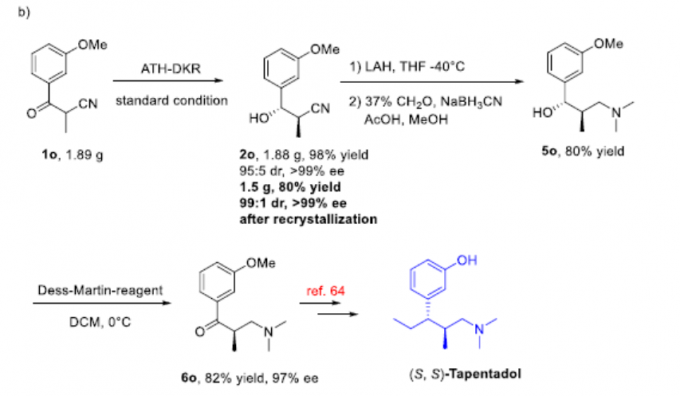
最后,作者对反应的实用性进行了研究(Scheme 2)。首先,1d的克级实验同样取得了预期的结果,获得99%收率、> 99%ee和dr为99:1的产物(S,S)-2d。随后,通过还原反应和环化反应,从而获得产物4d,再根据文献的方法[5]通过一步操作即可获得药物中间体伊培沙宗(Scheme 2a)。此外,1o的克级实验,同样获得高收率的产物2o。随后,使用LiAlH4还原氰基,用甲醛溶液进行N-甲基化以及用Dess-Martin试剂进行氧化,从而以高收率中间体6o。再根据相关文献的报道[6],即可合成他喷他多(Scheme 2b)。
总结
南方科技大学张绪穆教授课题组报道了一种高效的动态动力学拆分策略,可用于β-酮腈的不对称转移氢化反应,从而获得高收率、高对映和非对映选择性的的β-羟基腈衍生物。此外,克级实验以及对药物分子伊培沙宗和他喷他多的合成,进一步证明了反应的实用性。















No comments yet.