本文作者:杉杉
导读
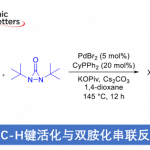
近日,Tokyo工业大学的Nakamura (中村 浩之, Nakamura Hiroyuki)课题组在Angew. Chem. Int. Ed.中发表论文,报道一种钯催化的1,2-dihydro-benzazaborine分子的N-H/B-H键双重活化反应方法学,进而以中等至优良的反应收率,获得一系列多环噁唑硼烷衍生物。这一双重活化策略中的关键步骤涉及通过硼酸负离子进行的氢分子释放。同时,作者进一步发现,采用SPINOL衍生的亚磷酰胺作为手性配体,能够以良好至优良的反应收率与极为优良的对映选择性,完成一系列手性噁唑硼烷分子的构建。
Enantioselective Synthesis of Oxazaborolidines by Palladium-Catalyzed N-H/B-H Double Activation of 1,2-Azaborines
T. Morita, H. Murakami, Y. Asawa, H. Nakamura, Angew. Chem. Int. Ed. 2021, ASAP doi:10.1002/anie.202113558.
正文
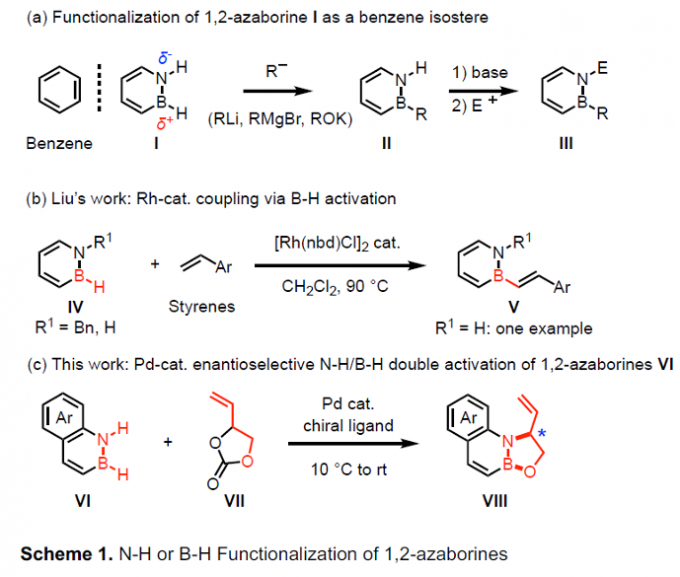
作为重要的BN杂环分子,azaborine分子与苯分子表现出相同的等电子特性,因此,在有机合成化学的研究中备受关注。目前,有机合成化学家已经设计出多种不同类型的合成转化策略,进而成功应用于一系列BN掺杂芳香分子(BN-doped aromatic compound)的构建[1]。
近年来,BN杂环分子,尤其1,2-azaborine的直接官能团化反应方法学的相关研究,同样备受广泛关注(Scheme 1a)[2]。这里,受到2014年,Liu课题采用铑催化剂促进的1,2-azaborine分子中B-H键官能团化方法学[3]相关研究报道的启发 (Scheme 1b),Nakamura课题组成功设计出一种全新的钯催化1,2-dihydro-benzazaborine与乙烯基碳酸亚乙酯之间的N-H/B-H键的双重活化反应方法学,进而成功完成一系列噁唑硼烷与手性噁唑硼烷分子的构建 (Scheme 1c)。
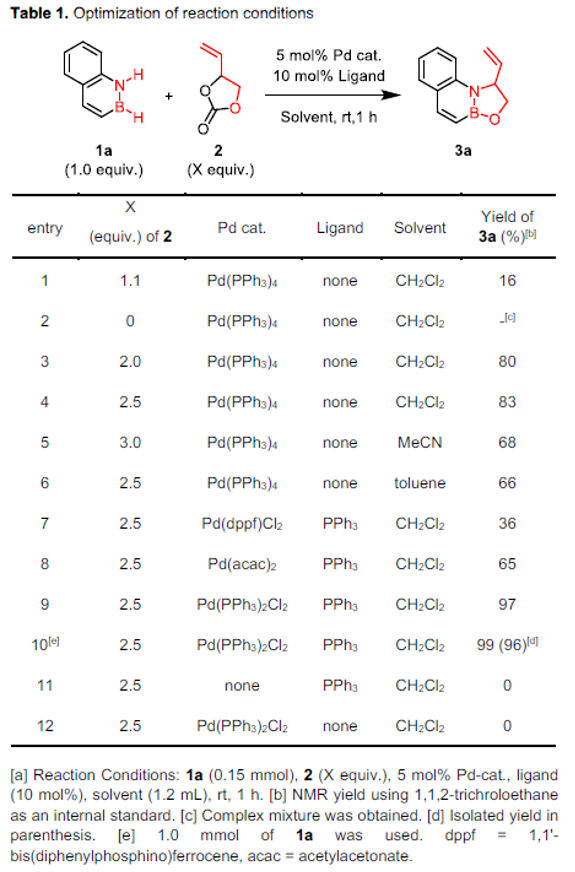
首先,作者采用1,2-azaborine 1a与乙烯基碳酸亚乙酯2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Pd(PPh3)2Cl2作为催化剂,PPh3作为配体,二氯甲烷作为反应溶剂,反应温度为室温,最终获得接近定量收率的多环噁唑硼烷产物3a。
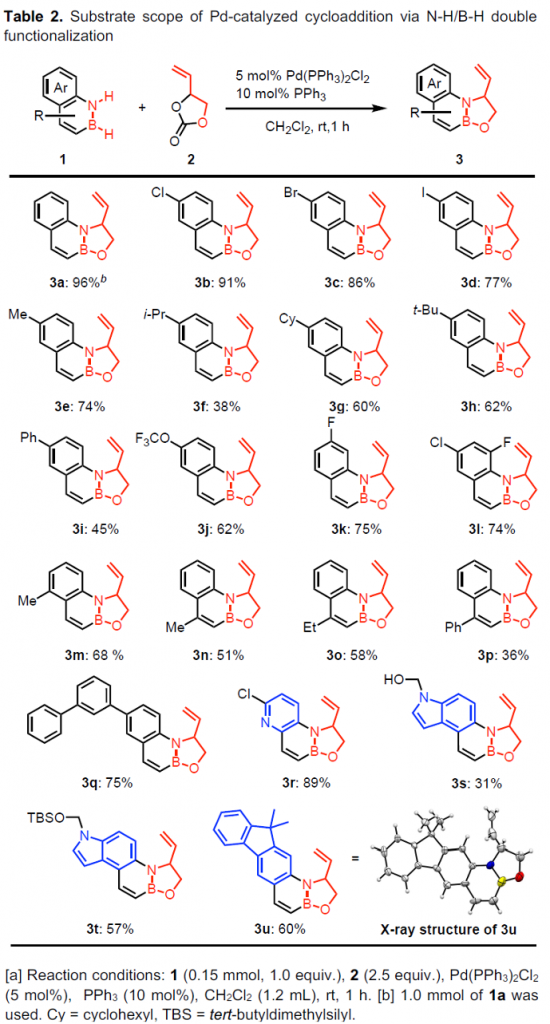
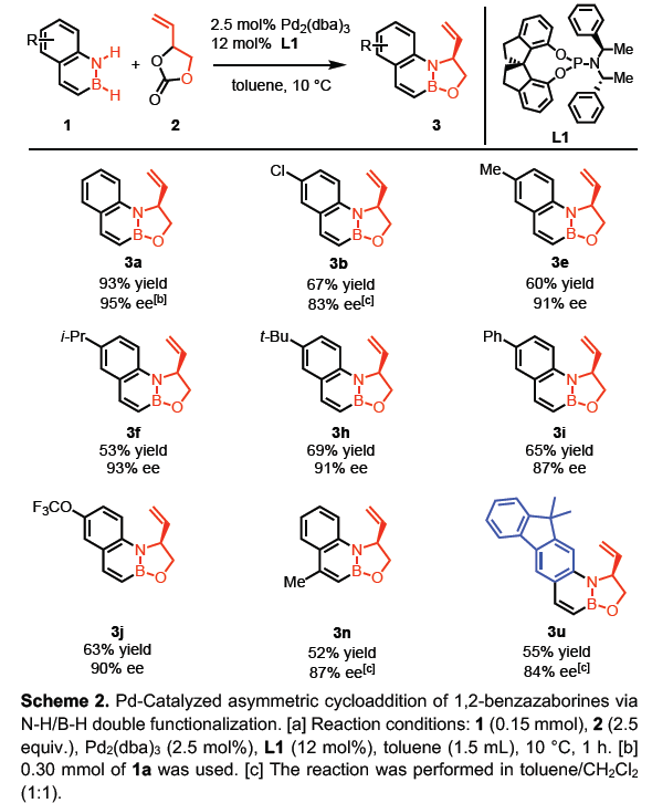
在上述的最佳反应条件下,作者首先对各类1,2-azaborine底物的应用范围进行考察 (Table 2)。研究表明,稠合芳环中具有一系列供电子与吸电子基团、苯基以及联苯基取代的1,2-azaborine底物,均能够较好地与上述的标准反应条件兼容,并获得中等至优良反应收率的环加成产物3a–3q。同时,这一全新的环加成策略表现出良好的官能团兼容性。之后,作者进一步发现,具有其它杂环骨架 (吡啶、吲哚与芴)稠合的1,2-azaborine底物,同样能够顺利地参与上述的环加成过程,并获得中等至优良反应收率的环加成产物3r–3u。
接下来,作者开始进行对映选择性N-H/B-H键的双重活化反应方法学的相关研究 (Scheme 2)。通过对上述反应条件的进一步优化之后,该小组发现,采用SPINOL衍生的亚磷酰胺 (SPINOL-derived phosphoramidite)L1作为手性配体,甲苯作为反应溶剂,反应温度为10 oC,最终获得相应的手性产物3a (93% 反应收率,95% ee)。之后,作者对进一步对各类1,2-azaborine底物的应用范围进行考察。研究表明,稠合苯环中带有氯基团 (3b)、烷基(3e、3f、3h以及3n)、苯基 (3i)以及三氟甲氧基 (3j)取代的1,2-azaborine底物,均能够获得良好至优良的对映选择性 (87-93% ee)。同时,上述的最佳反应条件对于芴稠合的多环1,2-azaborine底物,同样能够有效地兼容,并获得相应的手性产物3u (84% ee)。
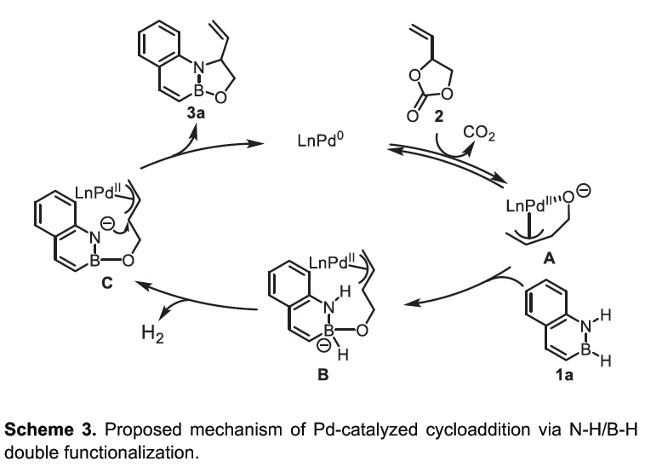
基于前期的文献报道[2], [4],作者提出如下合理的反应机理路径 (Scheme 3)。
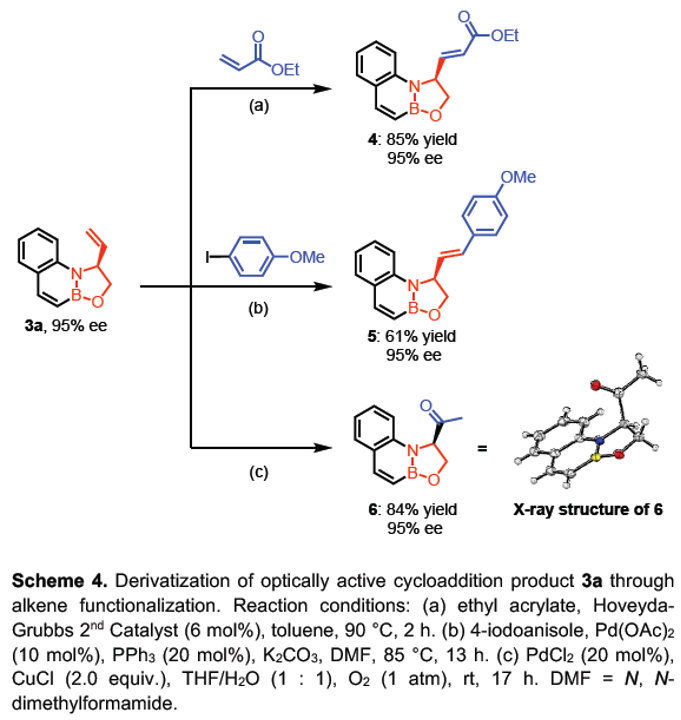
同时,作者进一步发现相应的手性产物3a同样能够通过后续的合成转化过程,获得其他不同类型的手性砌块4-6 (Scheme 4)
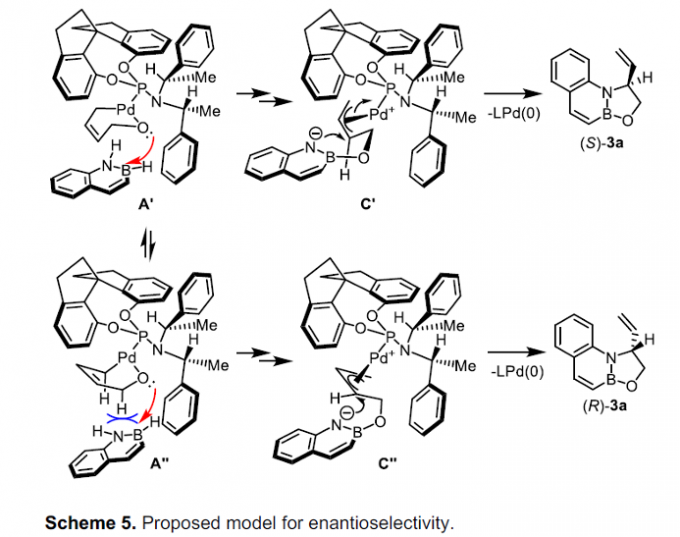
同时,作者进一步提出如下的对映选择性控制模型 (Scheme 5)。
总结
Tokyo工业大学的Nakamura课题组成功设计出一种全新的钯催化的1,2-dihydro-benzazaborine分子的N-H/B-H键双重活化反应方法学,进而以中等至优良的反应收率,获得一系列多环噁唑硼烷衍生物。同时,该小组进一步发现,采用SPINOL衍生的亚磷酰胺作为手性配体,能够以良好至优良的反应收率以及优良的对映选择性,顺利完成一系列手性噁唑硼烷分子的构建。
参考文献
[1] (a) M. J. S. Dewar, P. A. Marr, J. Am. Chem. Soc. 1962, 84, 3782. doi: 10.1021/ja00878a045.(b) J. S. Dewar, V. P. Kubba, J. Chem. Soc. 1958, 3073. doi: 10.1039/JR9580003073.
(c) M. Chen, K. S. Unikela, R. Ramalakshmi, B. Li, C. Darrigan, A. Chrostowska, S. Liu, Angew. Chem. Int. Ed. 2021, 60, 1556. doi: 10.1002/anie.202010556.
(e) Y. Chen, W. Chen, Y. Qiao, X. Lu, G. Zhou, Angew. Chem. Int. Ed. 2020, 59,
- doi: 10.1002/anie.202000556.
(f) A. Abengozar, I. Valencia, G. G. Otarola, D. Sucunza, P. Garcia-Garcia, A. Perez-
Redondo, F. Mendicuti, J. J. Vaquero, Chem. Commun. 2020, 56, 3669. doi: 10.1039/C9CC09998K.
(g) T. Kaehler, M. Bolte, H.-W. Lerner, M. Wagner, Angew. Chem. Int. Ed. 2019, 58, 11379. doi: 10.1002/anie.201905823.
(h) F. Zhuang, Z. Sun, Z. Yao, Q. Chen, Z. Huang, J. Yang, J. Wang, J. Pei, Angew. Chem. Int. Ed. 2019, 58, 10708. doi: 10.1002/anie.201905601.
(i) K. Boknevitz, J. S. Italia, B. Li, A. Chatterjee, S.-Y. Liu, Chem. Sci. 2019, 10, 4994. doi: 10.1039/C8SC05167D.
(j) A. Abengozar, P. Garcia-Garcia, D. Sucunza, D. Sampedro, A. Perez-Redondo, J. J. Vaquero, Org. Lett. 2019, 21, 2550. doi: 10.1021/acs.orglett.9b00448.
[2] (a) A. N. Lamm, E. B. Garner III, D. A. Dixon, S. Liu, Angew. Chem. Int. Ed. 2011, 50, 8157. doi:10.1002/anie.201103192.(b) P. G. Campbell, A. J. V. Marwitz, S. Liu, Angew. Chem. Int. Ed. 2012, 51, 6074. doi: 10.1002/anie.201200063.
(c) Z. X. Giustra, S. Liu, J. Am. Chem. Soc. 2018, 140, 1184. doi: 10.1021/jacs.7b09446.
(d) A. Bhattacharjee, G. H. M. Davies, B. Saeednia, S. R. Wisniewski, G. A. Molander, Adv. Synth. Catal. 2021, 363, 2256. doi: 10.1002/adsc.202001384.
(e) C. R. McConnell, S. Liu, Chem. Soc. Rev. 2019, 48, 3436. doi: 10.1039/C9CS00218A.
(f) G. Belanger-Chabot, H. Braunschweig, D. K. Roy, Eur. J. Inorg. Chem. 2017, 4353. doi: 10.1002/ejic.201700562.
[3] A. N. Brown, L. N. Zakharov, T. Mikulas, D. A. Dixon, S. Liu, Org. Lett. 2014, 16, 3340. doi: 10.1021/ol501362w. [4] (a) Y. Wang, J. Chai, C. You, J. Zhang, X. Mi, L. Zhang, S. Luo, J. Am. Chem. Soc. 2020, 142, 3184. doi:10.1021/jacs.9b13026.(b) J. Wang, L. Zhao, Q. Rong, C. Lv, Y. Lu, X. Pan, L. Zhao, L. Hu, Org. Lett. 2020, 22, 5833. doi:10.1021/acs.orglett.0c01920.
[5] L. Hu, A. Cai, Z. Wu, A. W. Kleij, G. Huang, Angew. Chem. Int. Ed. 2019, 58, 14694. doi: 10.1002/anie.201907375.本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载















No comments yet.