导读
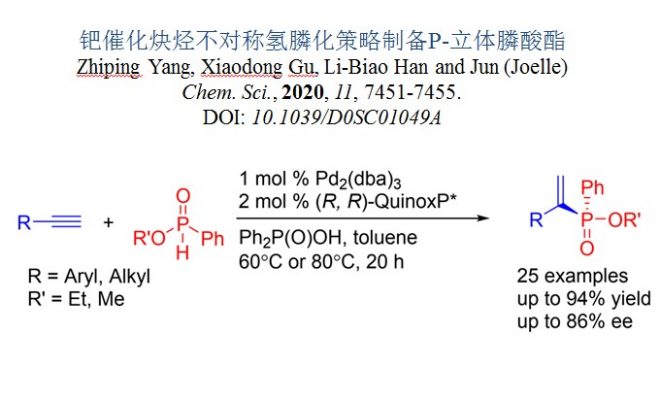
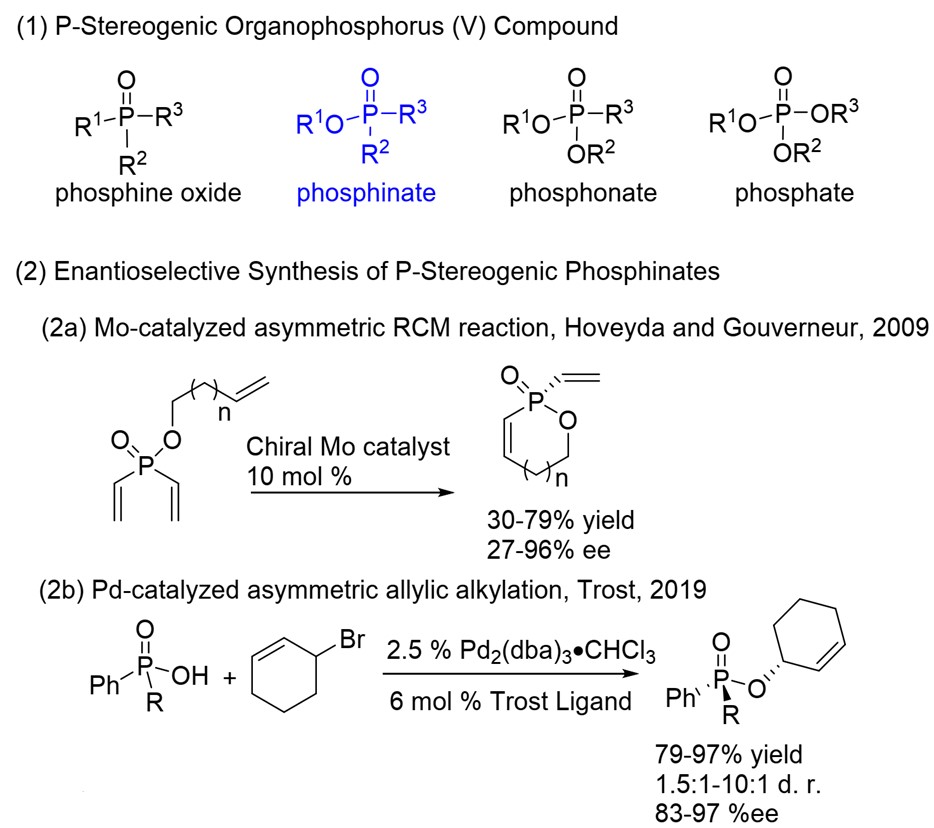
手性有机磷化合物是生物活性分子的合成要素,并且作为一类重要的手性配体,被广泛应用于金属催化和有机催化反应中。P-立体膦酸酯是一类重要的分子,在药物和合成化学有很多应用。手性磷配体的平面手性或中心手性杂碳骨架上,与之相比,P-手性有机磷化合物的合成更具挑战性。尽管P-立体磷酸酯很重要,但有效的制备方法却很罕见。传统上,通过使用手性试剂或辅助转化(如薄荷醇或手性氨基醇)来制备对映体富集的P-手性磷化合物。最近,有较多利用金属催化前手性磷化合物的不对称去对称化策略制备手性膦化合物的报道。利用二烷基膦氧化物构造P-立体氧化膦是非常典型的实例,如第一例用Rh(I)催化二烷基膦氧化物的去对称化环加成反应。二乙烯基氧化膦和膦烯氧化物也可构建P-立体中心。此外,还有许多课题组独立完成利用钯催化膦酰胺、膦酸酯和氧化膦的分子间或分子内的对映选择性C-H芳基化反应。Cramer报道了Rh催化膦酰胺与炔烃的不对称炔化反应和Ir催化氧化膦的胺化芳基化反应。[1]最近,张课题组发展了钯催化不对称P-C交叉反应,可高效合成P-立体膦氧化物。[2]2009年,Hoveyda和Gouverneur报道了一种钼催化的不对称闭环复分解反应制备P-立体膦酸酯(图1,2a)。[3]2019年,Trost发展了一例Pd催化立体选择性烯丙基烷基化反应构筑P-立体膦酸酯(方案1,2b)。[4]因此,有必要开发其他新的方法来解决多功能P-立体膦酸酯的合成问题。
钯催化的H-P(O)R1R2与炔烃的加成反应是构建碳-磷键的有效方法。Tanaka 和 Han首次报道了钯催化(RO)2P(O)H与炔烃的加成反应。2006年,Gaumont报道了钯催化炔烃与膦硼烷不对称氢膦化反应,只有70%的转化率和42% ee。在2018年,Dong报道了1,3-二烯烃氢膦酰化反应制备手性烯丙基膦氧化物,具有高对映选择性和区域选择性。基于以上研究背景,南方科技大学Jun (Joelle) Wang等发展了第一例Pd催化炔烃的对映选择性氢膦化反应,高效的制备具有P-手性的手性烯基膦酸酯。相关成果发表于:
“Palladium-Catalyzed Asymmetric Hydrophosphorylation ofAlkynes: Facile Access to P‑StereogenicPhosphinates”
Zhiping Yang, XiaodongGu, Li-Biao Han and Jun (Joelle)
Chem. Sci., 2020, 11, 7451-7455. DOI: 10.1039/D0SC01049A
图1不对称合成P-立体磷酸酯
论文概要
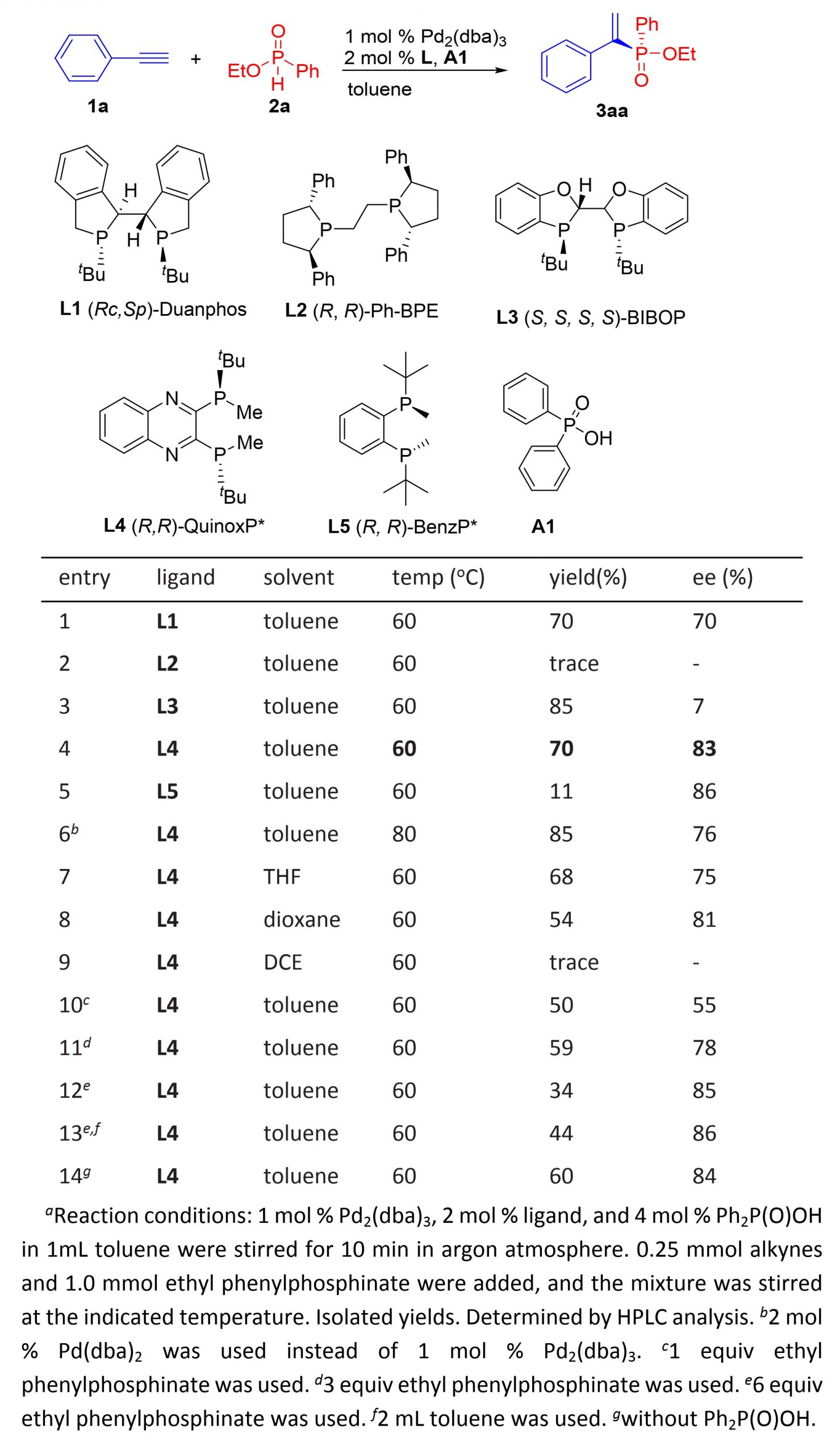
作者首先进行条件的筛选研究。苯乙炔1a和乙基苯基膦酸酯2a作为模型底物,对各种各样的配体进行初步评估,大多数具有P-手性的双膦配体反应效果较好。当L1作为配体时,反应以70%的收率和70% ee顺利得到烯基膦酸酯3aa(表1,entry 1)。(R, R)-Ph-BPE配体反应性和对映选择性差(表1,entry 2)。(S, S, S, S)-BIBOP配体L3显示反应活性较好,但产物没有对映选择性(表1,entry 3)。(R, R)-QuinoxP*L4能以70%的收率以及83%ee得到目标产物(表1,entry 4)。类似的配体(R, R)-benzP*L5虽然能得到86%的ee,但收率较差(表1,entry 5)。当使用Pd(dba)2作为催化剂时,需要更高的反应温度才能进行反应完成(表1,entry 6)。作者对溶剂也进行了简要考察,THF、1,4-二氧六环和DCE的收率和对映选择性均较差(表1,entry 7-9)。与膦酸和二级氧化膦不同,次磷酸酯2a不易被碱或过渡金属下不易消旋化,因此很难实现动态动力学拆分。作者认为动力学拆分过程是可行的。但是,当使用1当量的次磷酸酯在60℃进行反应时,以50%的收率和55%的ee得到3aa,和40%的收率、61%的ee回收(R)-2a(S系数仅为6)(表1,entry 10)。作者采用优化1a/2a的比例来提高3aa的对映选择性。当使用4当量2a时,得到了最佳收率和ee(表1,entry 4&10-13)。当乙基苯基次膦酸酯2a的量提高到6当量时,收率降低,可能是由于钯催化剂失活(表1,entry 12-13)。不添加Ph2P(O)OH导致收率降低,但产品对映选择性略有提高(表1,entry 14 vs 4)。因此,最佳反应条件为:在甲苯中,温度为60℃,1 mol%Pd2(dba)3,2 mol%(R, R)–QuinoxP*,4 mol%膦酸。
表1反应条件筛选
在获取最优的反应条件下,作者对底物适应范围进行了研究(图2)。作者发现各种炔烃能很好的适用于该反应体系。无论芳基炔烃上带有给电子基团(MeO、Me、Et、n-pent、tBu)(3ba-3ga、3la、3ma)或吸电子基团(Cl、F、Br、CF3)(3ha-3ka,3na),在间位或者对位均展现出良好的耐受性。但是,邻位甲基的炔烃对应的对映选择性降低(3da,91%,30%ee)。具有-CN或-NO2基团的芳环没有得到期望的产物。含噻吩或吡啶基团的底物在该反应条件下也能得到对应的产物3oa和3pa,收率适中且ee值好。二苯乙炔也有中等的收率和ee(3qa,69%,61%ee)。此外,作者也证明了脂肪族炔烃也是可行的,产率略有下降,但ee均较高(3ra-3ta)。
图2底物拓展研究
在得到炔烃的研究结果后,作者进一步尝试将该催化体系扩展到不同的次磷酸酯(图3)。含有甲酯或丙酯的底物也进行了氢膦化反应,并以中等收率和对映选择性得到相应的烯基膦酸酯(3ab,3ac)。含有异丙基的底物对应膦酸酯的收率(3ad)下降至32%,且对映选择性略微下降至73%ee。次磷酸酯的芳环上具有甲基取代时,可得产物3ae(47%,37%ee);含tBu基时,可得化合物3fb。当次磷酸酯换为甲基取代的次膦氧化物时,在相似的反应条件下以28%的收率和54%的ee得到产物3af。
图3次磷酸酯底物拓展研究
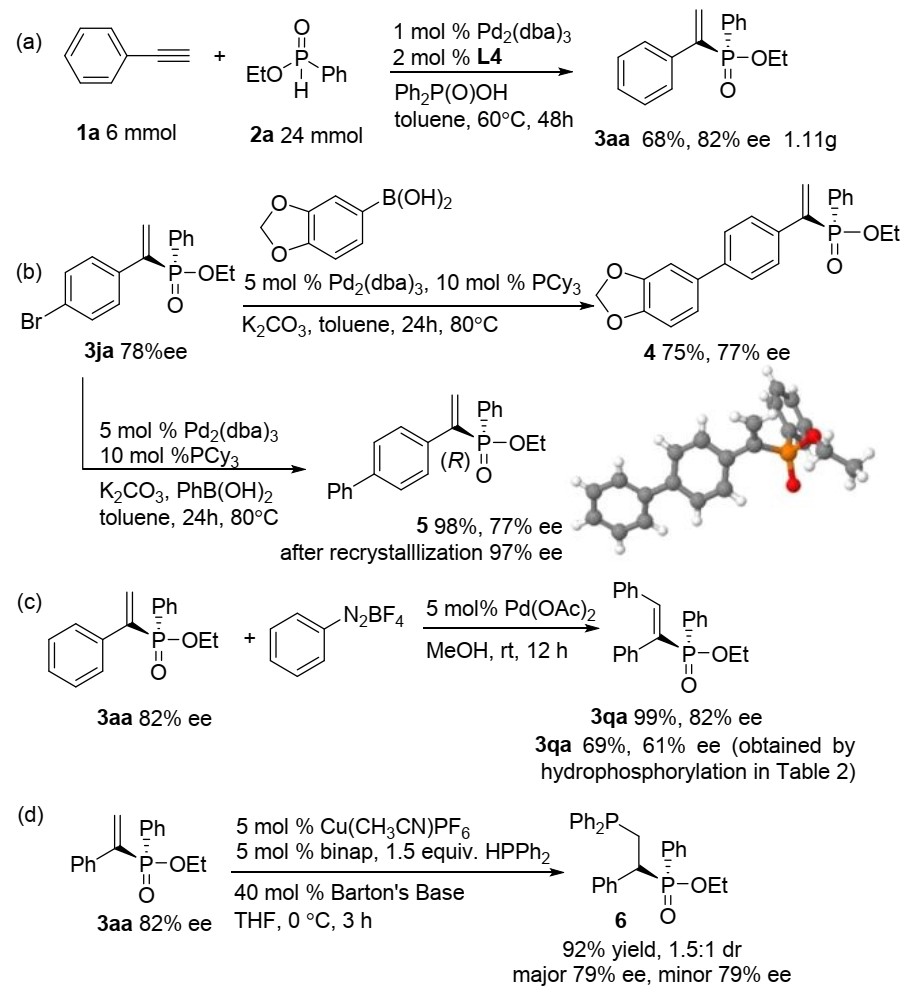
为了评估该催化体系的合成潜力,作者将苯乙炔与乙基苯次膦酸酯进行克级反应研究,以68%的收率和82%的ee得到产物3aa(图4a)。此外,作者还对目标产物进行了进一步合成转化。化合物4和5通过Suzuki-Miyaura偶联反应制备,且对映选择性保持(图4b)。通过衍生化产物5可确定产物3ja的绝对构型为R-构型。芳基重氮盐与烯基膦酸酯3aa反应,可以优异的立体选择性得到顺式二苯乙烯3qa(图4c,99%,82% ee)。此外,作者以铜(I)为催化剂,HPPh2与3aa发生氢膦化反应,得到1,2-二膦衍生物6(图4d,92%,1.5:1dr,79%ee)。
图4衍生化反应研究
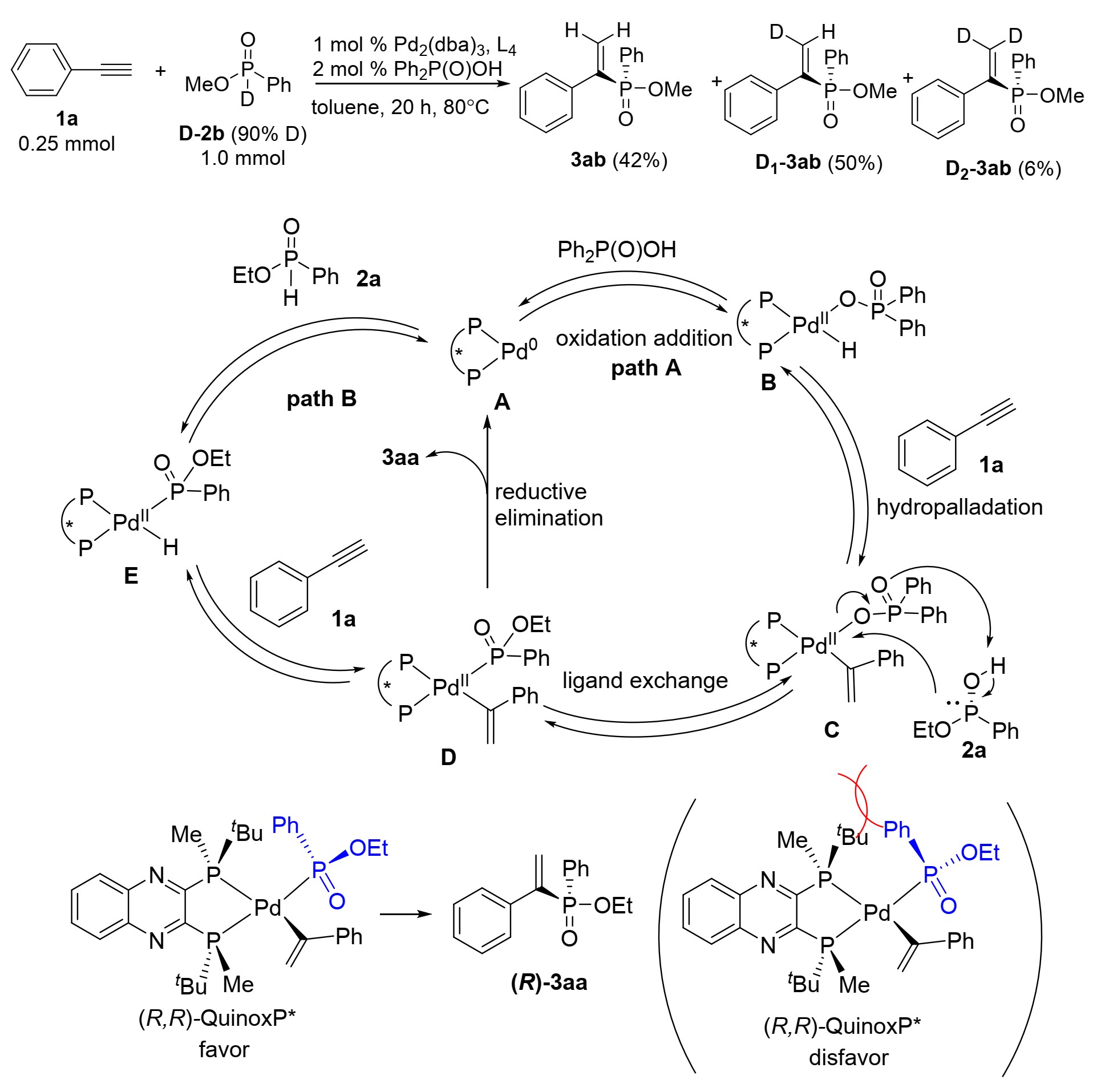
为了深入了解反应机理,作者以D-P(O)(OMe)Ph为起始原料进行氘标记实验,得到3ab(42%),D1–3ab(50%)和少量的D2–3ab(6%),其中两个氘在烯烃末端的碳原子上结合(图5),这一结果表明氧化加成、加氢和配体交换是可逆的。以氘标记实验为基础和先前的报道,作者提出了一个可能的催化循环。Pd2(dba)3和(R,R)-QuinoxP*形成手性钯配合物A。随后Ph2P(O)OH的O-H键与钯的氧化加成反应生成钯中间体B。然后通过Markovnikov加成,进行炔烃氢钯化反应,得到烯基钯中间体C。后续中间体与2a进行配体交换得到磷酰钯中间体D。此外,另一种可能途径,中间产物E可能由2a的P-H键直接氧化加成,然后生成相同的中间体D。最后,还原消除得到所需的烯基膦酸酯产物。
图5 可能的催化循环
论文总结评价
综上所述,作者发展了第一例钯催化炔烃的不对称氢膦化反应,高效的合成具有P-手性烯基膦酸酯衍生物。该反应表明氢膦化是制备P-立体有机磷化合物的有效策略,同时该反应具有条件温和、底物适应范围较广等优点。此外,通过克级实验以及后期的衍生化反应,进一步证明了反应的实用性。
参考文献
- [1] Y.-S. Jang, L. Wozniak,J. Pedroni, N. Cramer, Angew. Chem. Int. Ed. 2018, 57, 12901-12905. DOI:10.1002/anie.201807749
- [2] Q. Dai, W. Li, Z. Li, J. Zhang, J. Am. Chem. Soc. 2019, 141, 20556-20564.DOI: 10.1021/jacs.9b11938
- [3] J. S. Harvey, S. J. Malcolmson, K. S. Dunne, S. J. Meek, A. L.Thompson, R. R. Schrock, A. H. Hoveyda, V. Gouverneur, Angew. Chem. Int. Ed. 2009, 48, 762-766.DOI:1002/anie.200805066
- [4] B. M. Trost, S. M. Spohr, A. B. Rolka, C. A. Kalnmals, J. Am. Chem. Soc. 2019, 141, 14098-14103.DOI: 10.1021/jacs.9b07340
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.