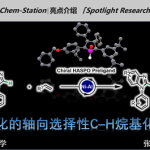
今天介绍的是2年前的篇文章,2015年、普林斯顿大学的・D. W. C. MacMillan、利用氢转移催化剂(HAT)与可见光氧化还原催化剂进行组合使用,在温和条件下成功实现把醇化合物作为烷基化试剂对杂芳环进行C-H烷基化反应。该方法可以适用于医药品的Late-Stage官能团化。
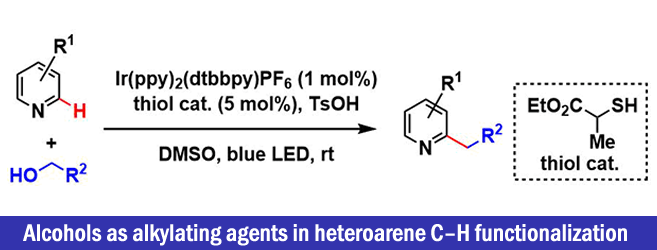
“Alcohols as alkylating agents in heteroarene C–H functionalization”
Jin, J.; MacMillan, D. W. C.* Nature 2015, 525, 87. doi:10.1038/nature14885
课题设定
做药物合成的人都知道,即使是一个小小的甲基的变化,药物表现出的活性等都会有显著的变化,因此杂芳环的烷基的直接导入法在应用这块是非常重要的。但是,常规方法,通常都需要使用当量的强氧化剂,并且需要加热生成烷基自由基,在原子经济与环境调和性上不具有优势。因此如何开发出一种比较高效的,可以催化进行的烷基化反应是一个难题,并且直接烷基化也可以应用于Late-Stage官能团化,进行新的lead compound的探索与library的组建。
具体方法实施
很多合成方法学的开发其实都离不开生源合成的启发,在DNA的生源合成中,通过酶诱发的spin-center shift(SCS)[1]、可以通过自由基机理切断β位的C-O結合进行脱水反应。
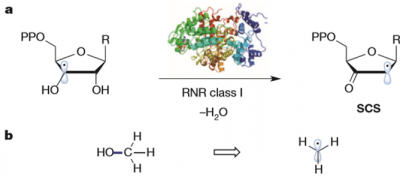
摘自原论文
作者也是收到这个生源合成的启发,设计出以alcohol为原料生成alkyl radical后,对含有杂原子的芳烃进行烷基化后,引发SCS,切断C-O键就可以实现烷基化这一思路。而Macmillan组以可见光氧化还原催化剂催化的自由基反应成名,因此该思路也是运用以往类似的方法,在温和条件下,通过以下设计的催化循环进行反应开发。
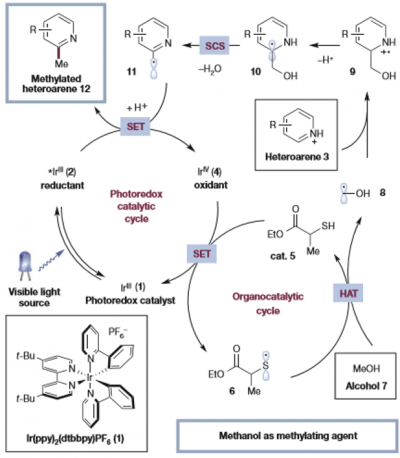
引用于原论文
而在这个体系中比较关键的是体系中生成的硫自由基对alcohol的C-H进行拔氢这一过程,生成的醇的α碳自由基8再与质子化的杂芳环进行自由基加成生成中间体9,接着引发SCS进行脱水得到产物。
MacMillan在同年,还报道了运用可见光催化剂驱动的Minisci反应[2],虽然与这篇看似相似,但是其实大不相同,区别在于这篇中的烷基自由基加成后,运用了SCS的C-O键切断反应。
假设的有效性验证
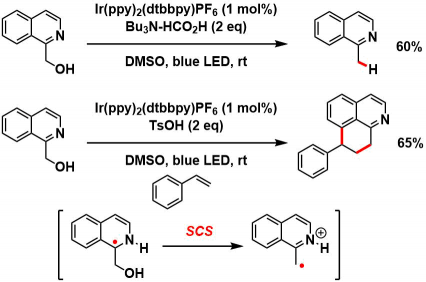
①SCS过程介导的验证
原论文作者进行了下图所示的radical捕捉实验,光、光催化剂、还原剂(Bu3N)、酸(HCO2H或者是TsOH)存在下,观测到了C-O键断裂,与异喹啉苄基位置碳自由基的生成这一结果支持了其假说。
②反应机理的讨论
- 光激发的Ir(III)被质子化的杂芳族环淬灭。另一方面,它不被硫醇或非质子化杂芳烃淬灭。这表明反应中经历了氧化猝灭过程。
- 从氧化还原电位值可以看出、Ir(IV)氧化硫醇的过程是合理的。(Ir(Ⅳ)はE1/2= +1.21 V(vs SCE in MeCN)、硫醇E1/2 = +0.85 V(vs SCE in MeCN))。
- 由于甲醇的BDE(αC-H)=96 kcal/mol、硫醇的BDE(S-H)=85 kcal/mol,虽然强度上看似并不合理,但是作者主张这是由于polarity effect进行断键的。
- 可见光氧化还原催化剂,硫醇,光,酸缺一不可。
③底物的适用性讨论
甲醇用量为溶剂量,其他的醇原料只需要10当量即可。根据底物的不同,硫醇的选用与更改也是有必要的。在四氢呋喃型乙醚的情况下,即使在与一级醇共存的情况下,也是醚的α位的C-H优先被拔掉,进行开环反应。该方法可以用于医药品的Late-Stage烷基化反应。
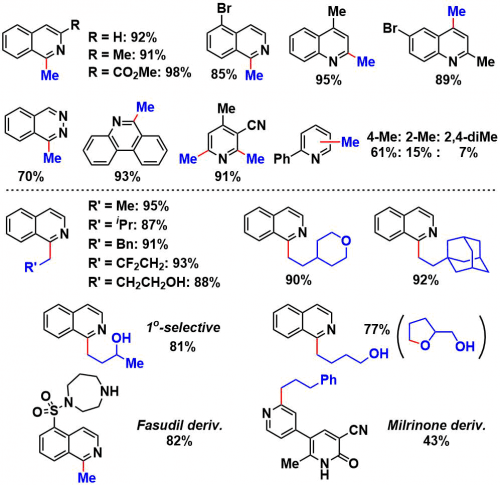
需要改善的点
- alcohol的使用量为溶剂量或者10倍当量,是否能够减少用量?比如通过使用强力的HAT催化剂是否能够实现?
参考文献
- Wessig, P.; Muehling, O. Eur. J. Org. Chem. 2007, 2219. DOI: 10.1002/ejoc.200600915
- Jin, J.; MacMillan, D. W. C. Angew. Chem. Int. Ed. 2015, 54, 1565. DOI: 10.1002/anie.201410432
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.