本文作者:杉杉
导读
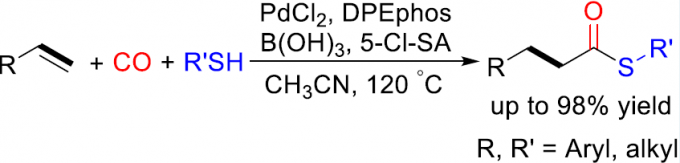
烯烃的硫羰基化(Thiocarbonylation)作为合成硫酯的一种理想方法,然而,对于苯乙烯的硫羰基化反应仍具有挑战。本文报道了一种钯催化体系,可实现烯烃的硫羰基化反应,从而合成直链硫酯(收率高达98%)。同时,一系列易得的烷基、芳基烯烃均为合适的底物。中科院大连化物所和罗斯托克大学的 Wu Xiao-Feng为该论文通讯作者。
Palladium-Catalyzed Thiocarbonylation of Alkenes toward Linear Thioesters
Han-Jun Ai, Fengqian Zhao, Hui-Qing Geng, and Xiao-Feng Wu*
ACS Catal. 2021, 11, 3614−3619
正文
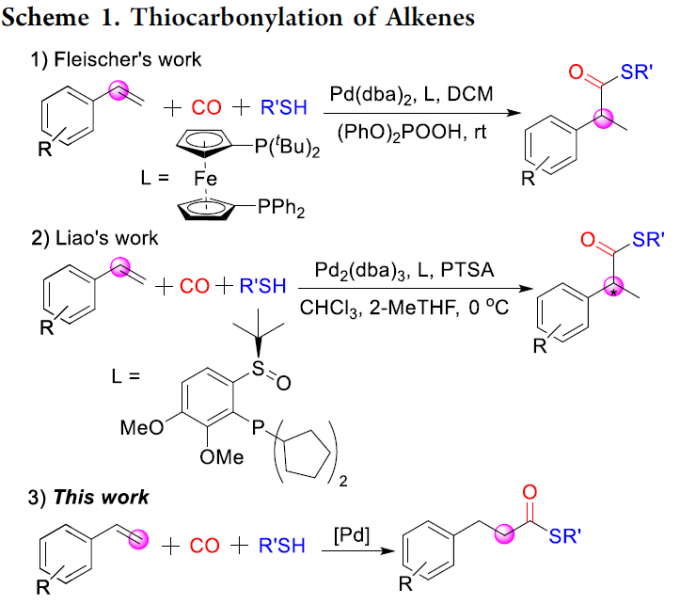
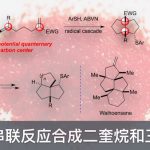
过渡金属催化烯烃的羰基化反应是合成脂肪族羧酸衍生物的理想途径。通过使用一氧化碳作为丰富的C1源可与各类亲核试剂进行加氢甲酰化、烷氧羰基化、氨基羰基化、硫代羰基化等,从而直接合成各种目标产物。同时,通过区域选择性的控制,也可分别获得支链或直链产物。并且,相关不对称催化反应也得以实现,从而获得相应的支链产物。除Alper等[1]早期研究外,烯烃硫羰基化的报道仍然很少。2016年,Fleischer等[2]报道了钯催化烯烃硫羰基化反应,获得高收率的支链产物(Scheme 1, eq 1)。随后,Liao等[3]使用手性亚砜膦配体,实现了相应不对称催化形式(Scheme 1, eq 2)。在上述报道中,反应也获得一定量的直链硫酯副产物,但对于通过苯乙烯直接合成直链硫酯化合物的通用方法仍具有挑战。此外,基于硫酯化合物在生物合成化学领域中的重要价值。在此,本文将介绍一种合成直链硫酯化合物的通用方法,可直接实现烯烃(烷基或芳基)硫羰基化反应(Scheme 1, eq 3)。
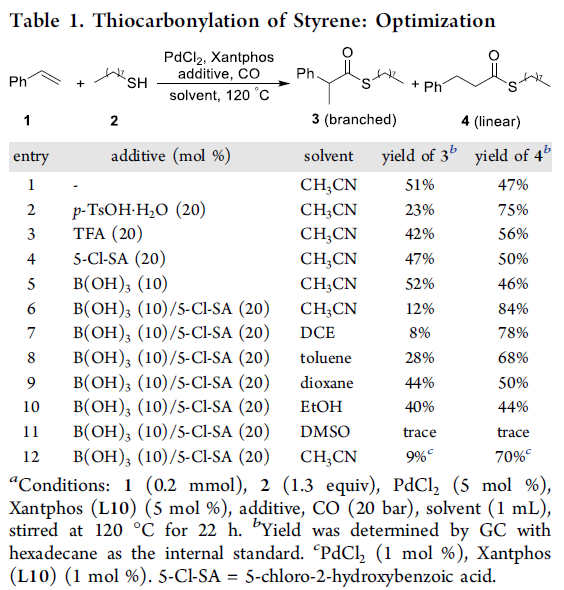
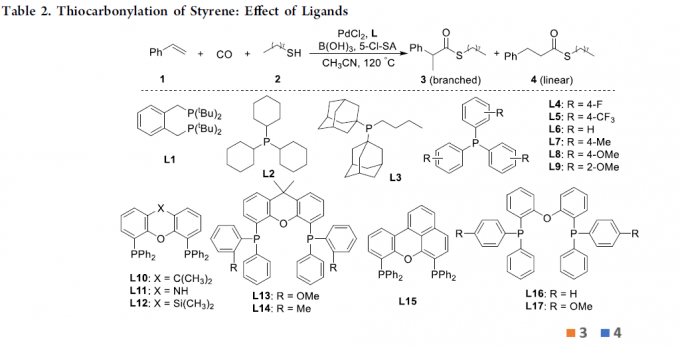
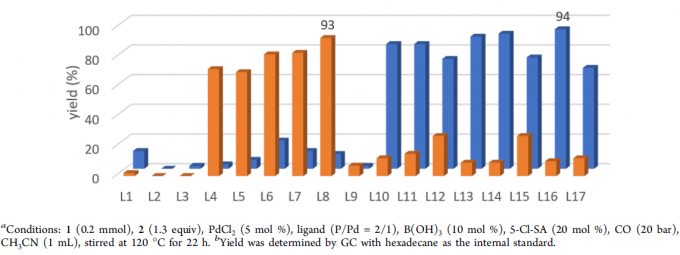
首先,作者以苯乙烯1和1-辛硫醇2a作为模型底物,进行了相关硫羰基化反应条件的筛选,如溶剂、添加剂、配体等(Table 1和Table 2)。反应的最佳条件为:当PdCl2为催化剂,L16为配体,同时加入B(OH)3和5-Cl-SA为酸添加剂,可于乙腈溶剂中120 ℃反应,获得94%的直链产物4。值得注意的是,当使用L8配体时,可获得93%收率的支链产物3。
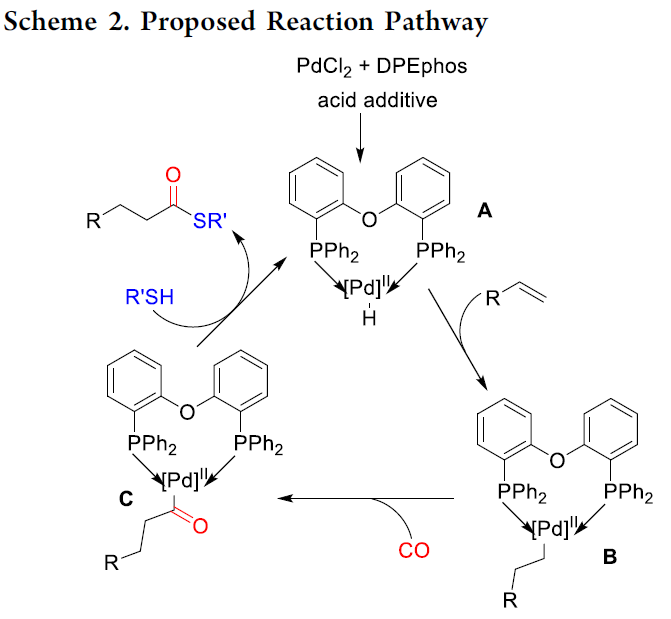
根据相关文献的总结[1-4],作者提出了一种可能的反应机理(Scheme 2)。首先,PdCl2与配体和酸添加剂反应生成L-PdII-H配合物A。随后,配合物A与烯烃加成,形成烷基钯配合物B。紧接着,CO的配位和插入后,形成酰基钯配合物C。最后,配合物C再与硫醇反应,即可获得直链硫酯产物。同时,再生L-PdII-H配合物A,已完成催化循环的过程。
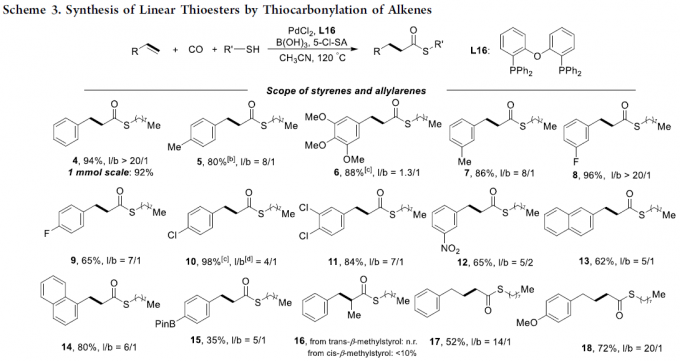
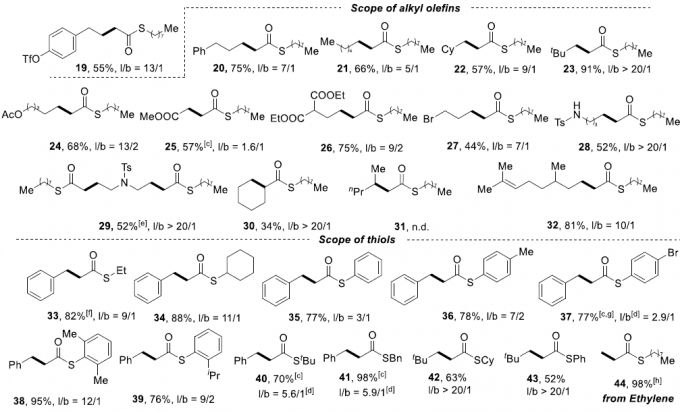
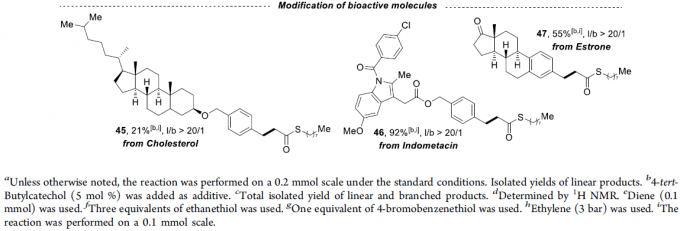
在获得上述最佳反应条件后,作者开始对底物的范围进行了扩展(Scheme 3)。首先,在对芳基烯烃的扩展时发现,芳基上具有不同的给电子基团和吸电子基团时,均可顺利反应,获得相应的产物4–12,收率为65-98%,l/b(直链和支链)比例为1.3:1-20:1。值得注意的是,硫酯产物4的1mmol规模实验,收率为92%。对于萘基取代的烯烃,同样与体系兼容,获得产物13–14。对于苯乙烯的芳环上含有Bpin基团时,仅获得35%收率的直链产物15。然而,当以反式-β-甲基苯乙烯为底物时未能进行相应的反应(空间位阻导致),但以顺式-β-甲基苯乙烯为底物时可获得小于20%收率的产物16。对于其它三个烯丙基芳烃底物,均可获得中等至良好收率的直链产物17–19。其次,一系列脂肪族的烯烃(除α-甲基取代的烯烃31),均可顺利反应,获得相应的产物20–32,收率为34-91%,l/b为1.6:1-20:1。此外,除了烷基硫醇外,其它的硫醇也与体系兼容,获得中等至极好收率的硫代酯33–43。同样,乙烯也可作为起始原料,获得98%收率的产物44。值得注意的是,该策略也成功用于一些生物活性分子的修饰,如45–47,进一步证明了反应的实用性。
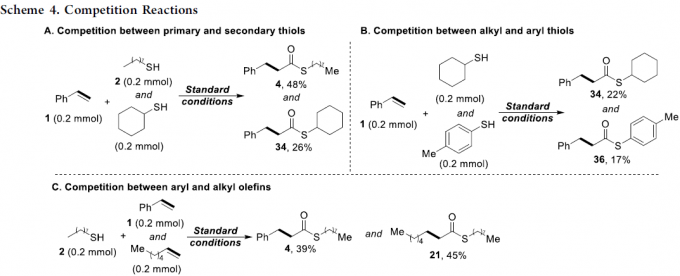
最后,作者在标准条件下进行了相关的竞争性实验(Scheme 4)。首先,将苯乙烯1与伯硫醇2和仲硫醇反应时,伯硫醇的硫酯收率(48%)远高于仲硫醇的收率(26%)(Scheme 4A)。其次,将苯乙烯1与烷基硫醇和芳基硫醇反应时,获得相似收率的产物34和36。同样,将烷基硫醇2与苯乙烯和烷基烯烃反应时,也获得相似收率的硫代酯产物4和21(Scheme 4B和4C)。
总结
本文主要报道了一种通用且高效的钯催化烯烃的硫羰基化反应,可从易得的烯烃直接合成直链硫酯产物。同时,该反应具有高收率(高达98%)、高选择性(l/b高达20:1)、广泛的底物范围(烷基、芳基烯烃)等特点。值得注意的是,该策略作为通过苯乙烯经硫羰基化反应直接合成直链硫酯的第一个实例。
参考文献
[1] (a) Drent, E. Preparation of Thiol Esters. G.B. Patent 2246130A, 1990. (b) Foley, P. Hydroesterification of 1-Alkene. U.S. Patent 4422977, 1983. (c) Xiao, W.-J.; Vasapollo, G.; Alper, H. Highly Regioselective Palladium-Catalyzed Thiocarbonylation of Allenes with Thiols and Carbon Monoxide. J. Org. Chem. 1998, 63, 2609−2612. (d) Li, C.; Xiao, W.-J.; Alper, H. Palladium-Catalyzed Ring-OpeningThiocarbonylation of Vinylcyclopropanes with Thiols and Carbon Monoxide. J. Org. Chem. 2009, 74, 888−890. (e) Xiao, W.-J.; Alper, H. Highly RegioselectiveThiocarbonylation of Allylic Alcohols with Thiols and Carbon Monoxide Catalyzed by Palladium Complexes: A New and Efficient Route to β,γ-Unsaturated Thioesters. J. Org. Chem. 1998, 63, 7939−7944. (f) Xiao, W.-J.; Vasapollo, G.; Alper, H. Highly Chemo- and Regioselective Thiocarbonylation of Conjugated Enynes with Thiols and Carbon Monoxide Catalyzed by Palladium Complexes: An Efficient and Atom-Economical Access to 2-(Phenylthiocarbonyl)-1,3-dienes. J. Org. Chem. 1999, 64, 2080−2084. (g) Xiao, W.-J.; Vasapollo, G.; Alper, H. Highly Regioselective Thiocarbonylation of Conjugated Dienes via Palladium-Catalyzed Three-Component Coupling Reactions. J. Org. Chem. 2000, 65, 4138−4144. (h) Xiao, W.-J.; Alper, H. First Examples of Enantioselective Palladium-Catalyzed Thiocarbonylation of Prochiral 1,3-Conjugated Dienes with Thiols and Carbon Monoxide: Efficient Synthesis of Optically Active β,γ-Unsaturated Thiol Esters. J. Org. Chem. 2001, 66, 6229−6233.
[2] Hirschbeck, V.; Gehrtz, P. H.; Fleischer, I. Regioselective Thiocarbonylation of Vinyl Arenes. J. Am. Chem. Soc. 2016, 138, 16794−16799. [3] Wang, X.; Wang, B.; Yin, X.; Yu, W.; Liao, Y.; Ye, J.; Wang, M.; Hu, L.; Liao, J. Palladium-Catalyzed Enantioselective Thiocarbonylation of Styrenes. Angew. Chem., Int. Ed. 2019, 58, 12264−12270. [4] (a) Vieira, T. O.; Green, M. J.; Alper, H. Highly Regioselective Anti-Markovnikov Palladium-Borate-Catalyzed Methoxycarbonylation Reactions: Unprecedented Results for Aryl Olefins. Org. Lett. 2006, 8, 6143−6145. (b) Ferreira, A. C.; Crous, R.; Bennie, L.; Meij, A. M. M.; Blann, K.; Bezuidenhoudt, B. C. B.; Young, D. A.; Green, M. J.; Roodt, A. Borate Esters as Alternative Acid Promoters in the Palladium-Catalyzed Methoxycarbonylation of Ethylene. Angew. Chem., Int. Ed. 2007, 46, 2273−2275.
















No comments yet.