概要
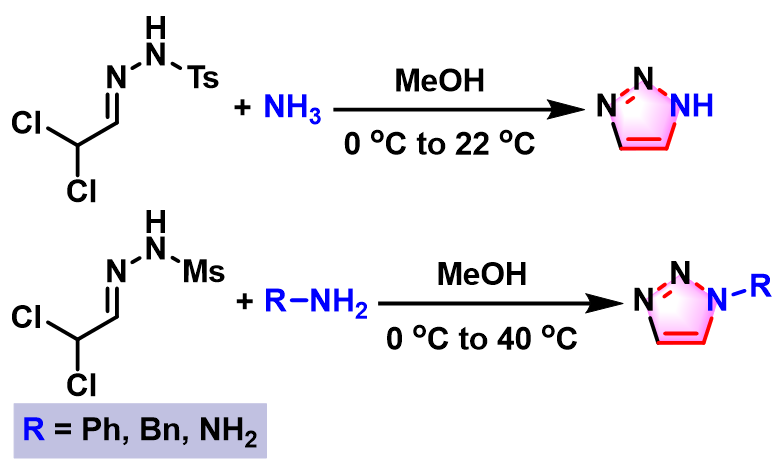
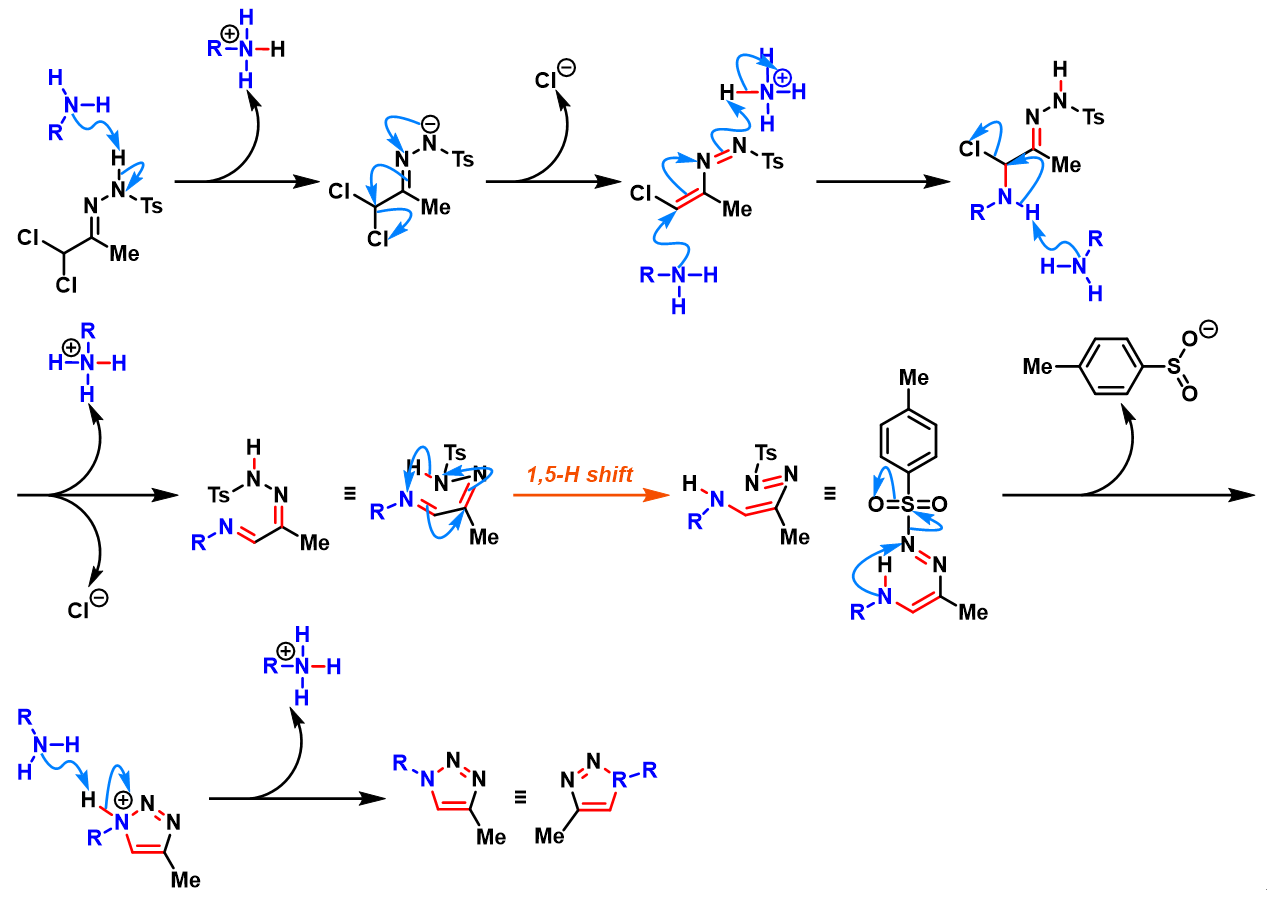
Sakai反应 (Sakai Reaction)是α,α-二氯对甲苯磺酰腙与伯胺之间发生环缩合 (cyclocondensation)过程,形成1,4-二取代三唑 (1,4-DT, 1,4-disubstituted triazole)的反应。该反应由日本Sagami化学研究中心 (相模中央化学研究所,Sagami Chemical Research Center)的Sakai (酒井 邦和, Sakai Kunikazu) 研究室在1986年首次报道[1]。
1998年,Harada (原田 勝正, 宇部興産宇部研究所, Harada Katsumasa, Ube Research Laboratory UBE Industries, Ltd)进一步将底物扩展至氨与肼及α,α-二氯甲磺酰腙[2]。
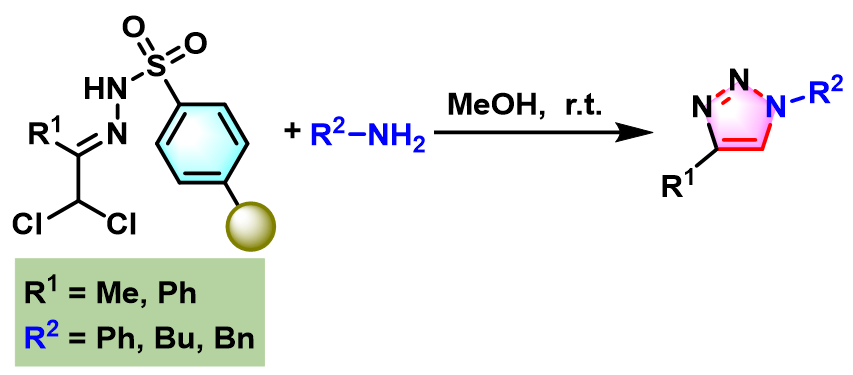
2004年,Y. Lam团队采用聚苯乙烯-磺酰肼树脂 (polystyrene-sulfonyl hydrazide resin.),进一步将Sakai反应方法学应用于1,4-DT的区域专一性固相合成[3]。
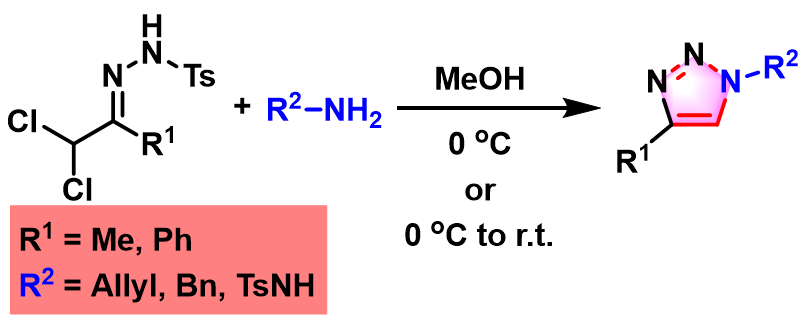
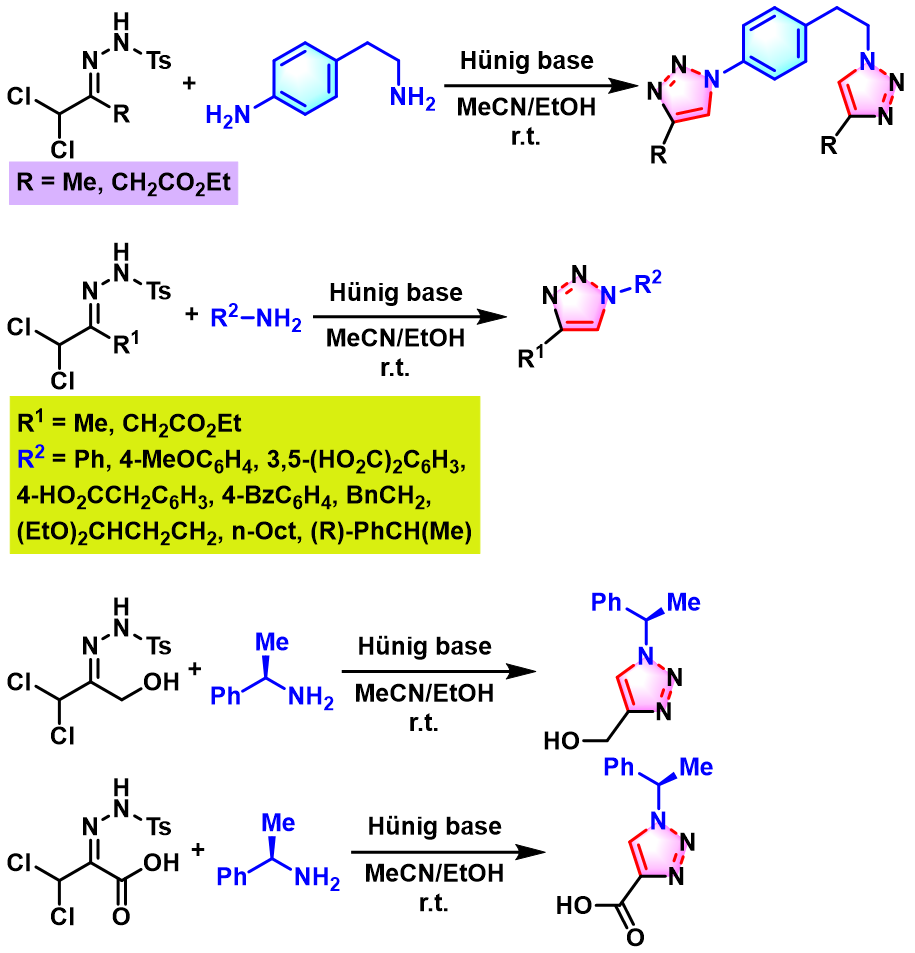
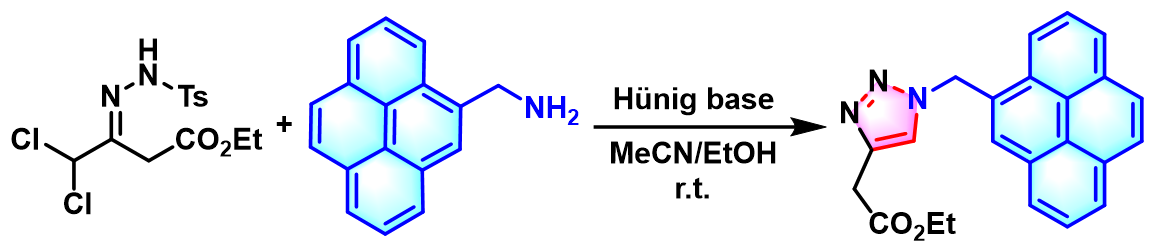
2012年,B. Westermann课题发现,加入Hünig碱,能够将Sakai反应进一步应用于各类取代芳胺与脂肪胺,并获得中等至优良的收率 (55-97%)[4]。同时,B. Westermann观察到,在Hünig碱存在下进行的Sakai反应,具有高度的化学选择性与优良的官能团兼容性,对于带有羧基官能团取代的芳胺以及羧基与羟基官能团取代的α,α-二氯对甲苯磺酰腙底物,同样能够有效地获得1,4-DT产物,有效避免了繁琐的保护基引入与去除步骤,极大简化了实验操作。
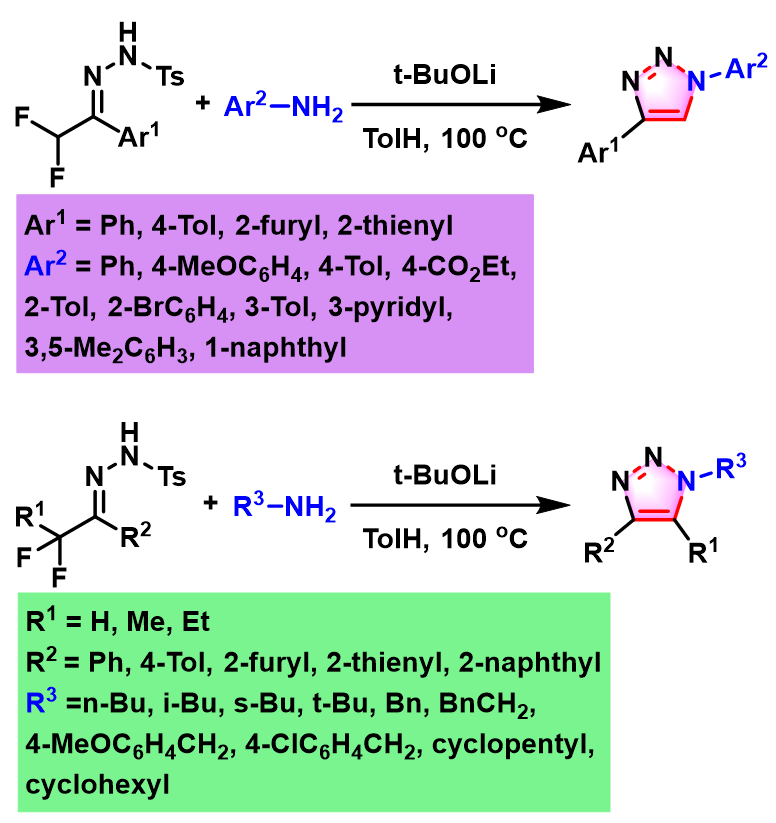
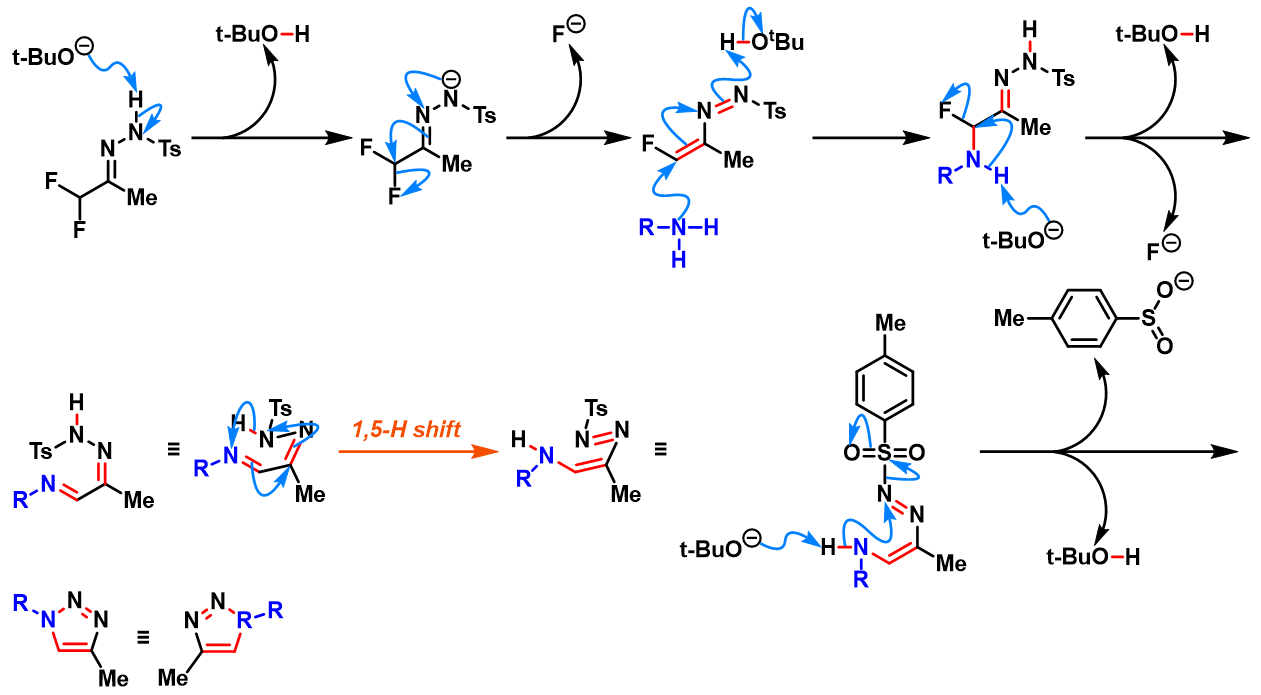
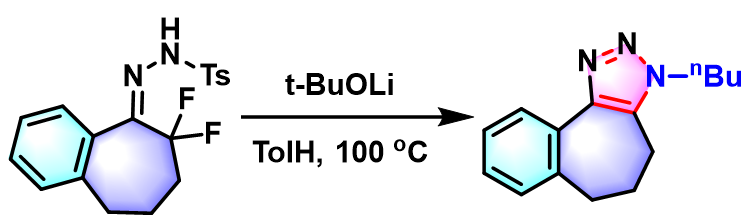
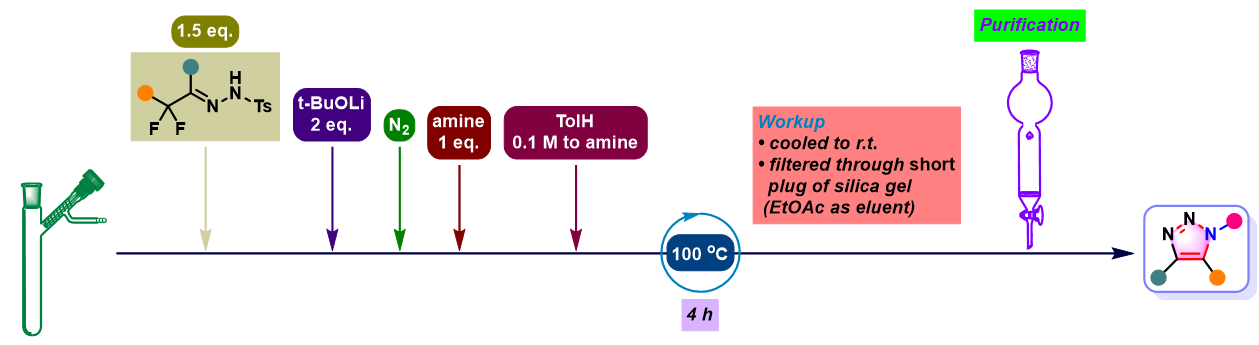
2019年,Wang小组通过选择叔丁醇锂作为碱,将Sakai发展的三唑合成的方法学成功应用于各类官能团取代的α,α-二氟对甲苯磺酰腙。同时,进一步将上述方法学扩展至1,4,5-三取代1,2,3-三唑的合成[5]。
Sakai反应提供了一种在无有机叠氮试剂 (azide-free)[6]-[7]、无氧化剂 (oxidant-free)[8-[11]以及无金属 (metal-free)[12]-[15]条件下构建1,4-二取代三唑分子与1,4,5-三取代1,2,3-三唑的有效策略[4]-[7]。该反应原料廉价易得,条件温和,环境友好,相比传统的叠氮化物-炔环加成反应 (azide-alkyne cycloaddition)[12]-[19]而言,操作更加安全。同时,Sakai反应具有高度的化学与区域选择性及优良的官能团兼容性[2], [6]-[7]。目前,该方法学已经逐渐应用于各类天然产物的化学选择性修饰 (chemoselective modification)[2]与部分生物活性分子[20]-[21]的合成。
基本文献
- [1] K. Sakai, N. Hida, K. Kondo, Bull. Chem. Soc. Jpn. 1986, 59, 179. doi: 10.1246/bcsj.59.179.
- [2] K. Harada, M. Oda, A. Matsushita, M. Shirai, Heterocycles 1998, 48, 695. doi: 10.3987/COM-97-8080.
- [3] M. S. Raghavendra, Y. Lam, Tetrahedron Lett. 2004, 45, 6129. doi: 10.1016/j.tetlet.2004.06.055.
- [4] S. S. van Berkel, S. Brauch, L. Gabriel, M. Henze, S. Stark, D. Vasilev, L. A. Wessjohann, M. Abbas, B. Westermann, Angew. Chem. Int. Ed. 2012, 51, 5343. doi: 10.1002/anie.201108850.
- [5] J. Wang, Q. Zhou, Z. Fu, L. Yu, Asian J. Org. Chem. 2019, 8, 646. doi: 10.1002/ajoc.201800514.
- [6] B. Westermann, M. W. Paixao, A. Ali, S. S. van Berkel, C. Lima, Chem. Commun. 2015, 51, 10784. doi: 10.1039/C5CC04114G.
- [7] M. Ahmed, H. R. Ch., M. Faisal, A. N. Siyal, A. Haider, Syn. Commun. 2017, 1193. doi: 10.1080/00397911.2017.1303511.
- [8] Z. Chen, Q. Yan, Z. Liu, Y. Xu, Y. Zhang, Angew. Chem. Int. Ed. 2013, 52, 13324. doi: 10.1002/anie.201306416 .
- [9] Z. Chen, Q. Yan, H. Yi, Z. Liu, A. Lei, Y. Zhang, Chem. Eur. J. 2014, 20, 13692. doi: 10.1002/chem.201403515.
- [10] Z. Cai, X. Lu, Y. Zi, C. Yang, L. Shen, J. Li, S. Wang, S. Ji, Org. Lett. 2014, 16, 5108. doi: 10.1021/ol502431b.
- [11] H. Bai, Z. Cai, S. Wang, S. Ji, Org. Lett. 2015, 17, 2898. doi: 10.1021/acs.orglett.5b01000.
- [12] J. R. Johansson, T. S. Beke-Somfai, A. S. Stalsmeden, N. Kann, Chem. Rev. 2016, 116, 14726. doi: 10.1021/acs.chemrev.6b00466.
- [13] E. Rasolofonjatovo, S. Theeramunkong, A. Bouriaud, S. Kolodych, M. Chaumontet, F. Taran, Org. Lett. 2013, 15, 4698. doi: 10.1021/ol402008u.
- [14] N. Salam, A. Sinha, A. S. Roy, P. Mondal, N. R. Jana, S. M. Islam, RSC Adv. 2014, 4, 10001. doi: 10.1039/C3RA47466F.
- [15] J. Barluenga, C. Valdes, G. Beltran, M. Escribano, F. Aznar, Angew. Chem. Int. Ed. 2006, 45, 6893. doi: 10.1002/anie.200601045.
- [16] N. J. Agard, J. M. Baskin, J. A. Prescher, C. R. Bertozzi, ACS. Chem. Biol. 2006, 1, 644. doi: 10.1021/cb6003228.
- [17] E. M. Sletten, C. R. Bertozzi, Org. Lett. 2008, 10, 3097. doi: 10.1021/ol801141k.
- [18] T. Plass, S. Milles, C. Koehler, C. Schultz, E. A. Lemke, Angew. Chem. 2011, 123, 3964. doi: 10.1002/ange.201008178.
- [19] J. Dommerholt, S. Schmidt, R. Temming, L. J. A. Hendriks, F. P. J. T. Rutjes, J. C. M. van Hest, D. J. Lefeber, P. Friedl, F. L. van Delft, Angew. Chem. Int. Ed. 2010, 49, 9422. doi: 10.1002/anie.201003761.
- [20] O. A. Phillips, E. E. Udo, M. E. Abdel-Hamid, R. Varghese, Eur. J. Med. Chem. 2009, 44, 3217. doi: 10.1016/j.ejmech.2009.03.024.
- [21] G. E Hanselmann, G. J. Job, R. Lou, J. G. Martynow, M. M. Reeve, Org. Process Res. Dev. 2010, 14, 152. doi: 10.1021/op900252a.
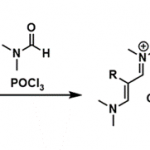
反应机理
Sakai反应
Hünig碱促进的Sakai反应
叔丁醇锂参与的Sakai反应
参考文献
- [1] B. Westermann, M. W. Paixao, A. Ali, S. S. van Berkel, C. Lima, Chem. Commun. 2015, 51, 10784. doi: 10.1039/C5CC04114G.
- [2] J. Wang, Q. Zhou, Z. Fu, L. Yu, Asian J. Org. Chem. 2019, 8, 646. doi: 10.1002/ajoc.201800514.
反应实例
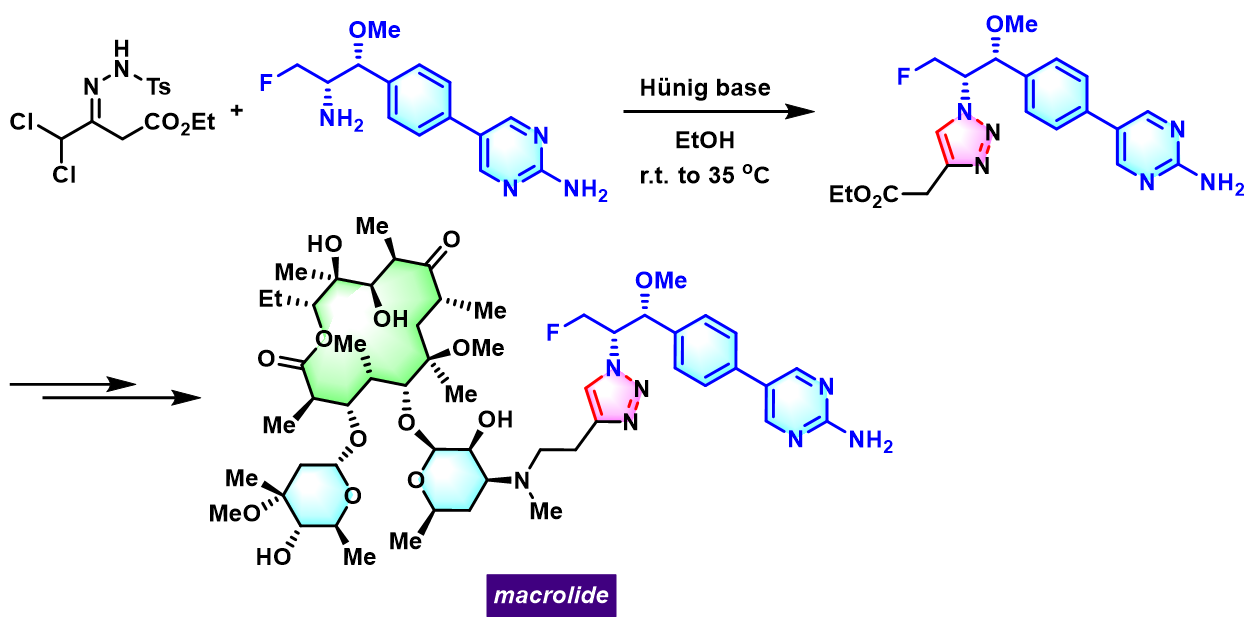
新型macrolide的合成[1]
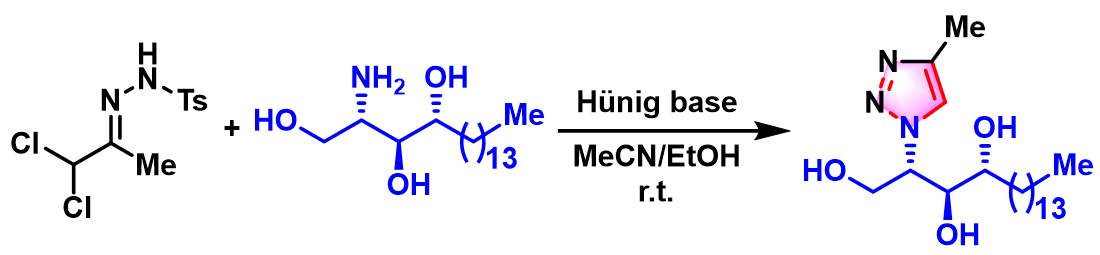
三唑修饰的 (triazole-modified phytoceramide)的合成[2]
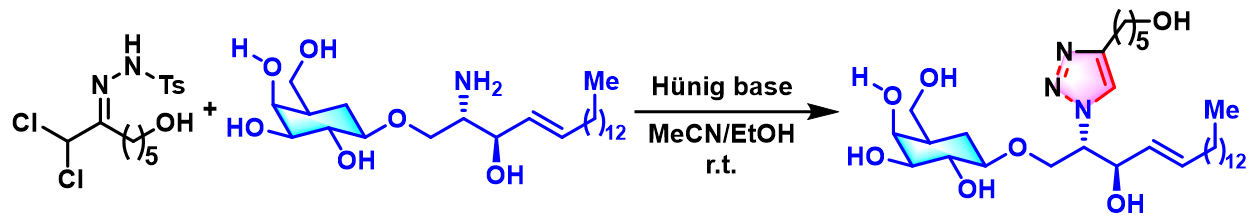
三唑修饰的psychosine的合成[2]
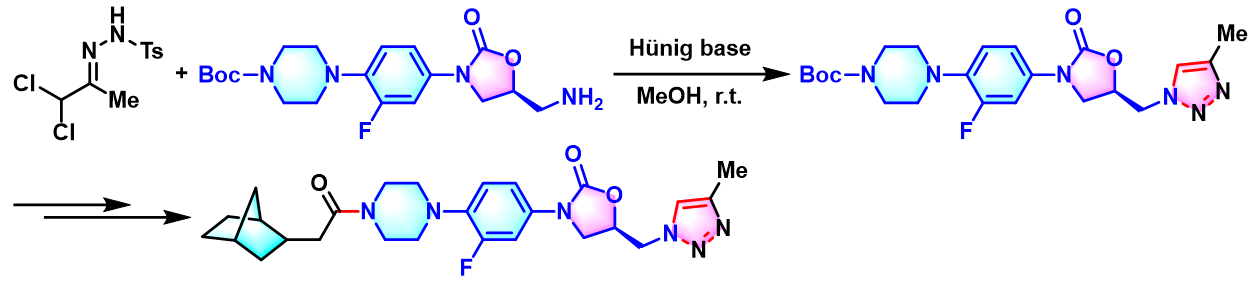
5-(4-甲基-1H-1,2,3-三唑基)甲基噁唑烷酮衍生物的合成[3]
1,4,5-三取代1,2,3-三唑的合成[4]
1,4-二取代1,2,3-三唑的合成[5]
实验步骤
Sakai反应
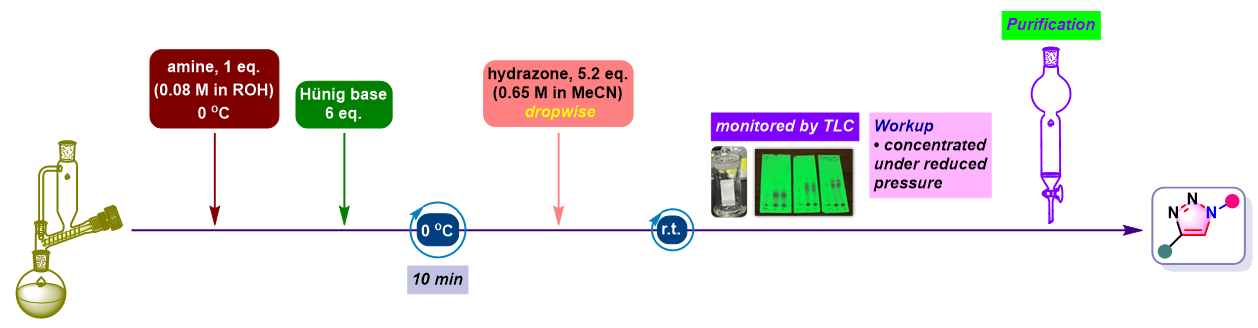
Hünig碱参与的Sakai反应
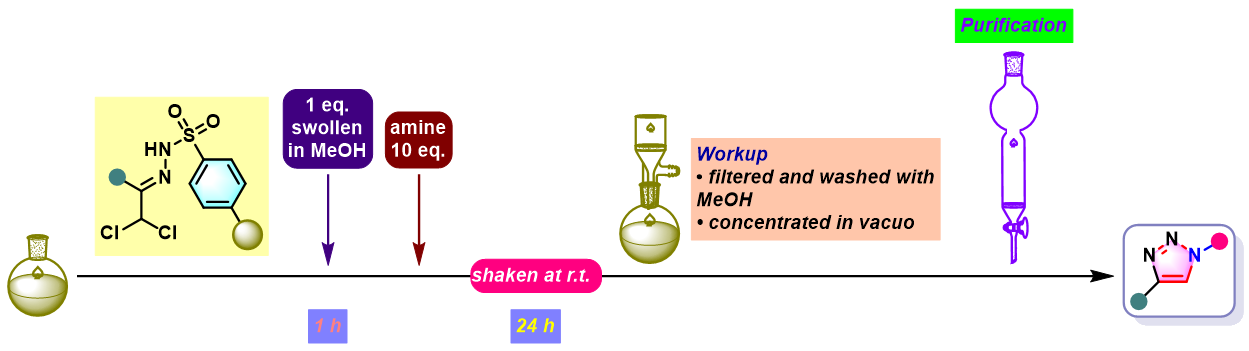
固相Sakai反应
叔丁醇锂参与的Sakai反应
参考文献
- [1] G. E Hanselmann, G. J. Job, R. Lou, J. G. Martynow, M. M. Reeve, Org. Process Res. Dev. 2010, 14, 152. doi: 10.1021/op900252a.
- [2] S. S. van Berkel, S. Brauch, L. Gabriel, M. Henze, S. Stark, D. Vasilev, L. A. Wessjohann, M. Abbas, B. Westermann, Angew. Chem. Int. Ed. 2012, 51, 5343. doi: 10.1002/anie.201108850.
- [3] O. A. Phillips, E. E. Udo, M. E. Abdel-Hamid, R. Varghese, Eur. J. Med. Chem. 2009, 44, 3217. doi: 10.1016/j.ejmech.2009.03.024.
- [4] J. Wang, Q. Zhou, Z. Fu, L. Yu, Asian J. Org. Chem. 2019, 8, 646. doi: 10.1002/ajoc.201800514.
- [5] S. S. van Berkel, S. Brauch, L. Gabriel, M. Henze, S. Stark, D. Vasilev, L. A. Wessjohann, M. Abbas, B. Westermann, Angew. Chem. Int. Ed. 2012, 51, 5343. doi: 10.1002/anie.201108850.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.