导读
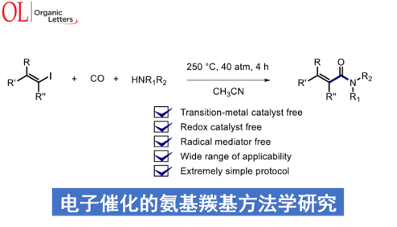
近日,台湾阳明交通大学Ryu Ilhyong (柳 日馨, リュウ イルヒョン)课题组在Org. Lett.中发表论文,报道一种烯基碘、CO与胺之间的氨基羰基化反应方法学,并以良好的反应收率,获得一系列α,β-不饱和酰胺衍生物。反应过程中无需采用催化剂,同时具有良好的官能团兼容性。并且,这一全新的氨基羰基化策略同样能够应用于官能团化的丙烯酰胺分子的构建。之后,作者提出一种涉及链电子转移的混合自由基/离子机理 (hybrid radical /ionic mechanism)。
Electron-Catalyzed Aminocarbonylation: Synthesis of α,β-Unsaturated Amides from Alkenyl Iodides, CO, and Amines
B. Picard, T. Fukuyama, T. Bando, M. Hyodo, I. Ryu, Org. Lett. 2021, ASAP doi: 10.1021/acs.orglett.1c03714.
正文
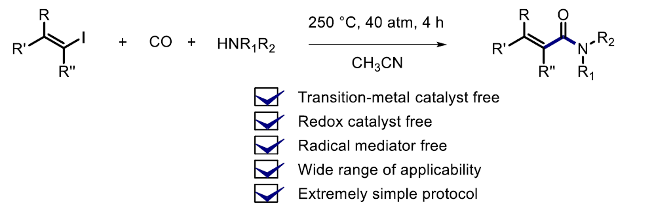
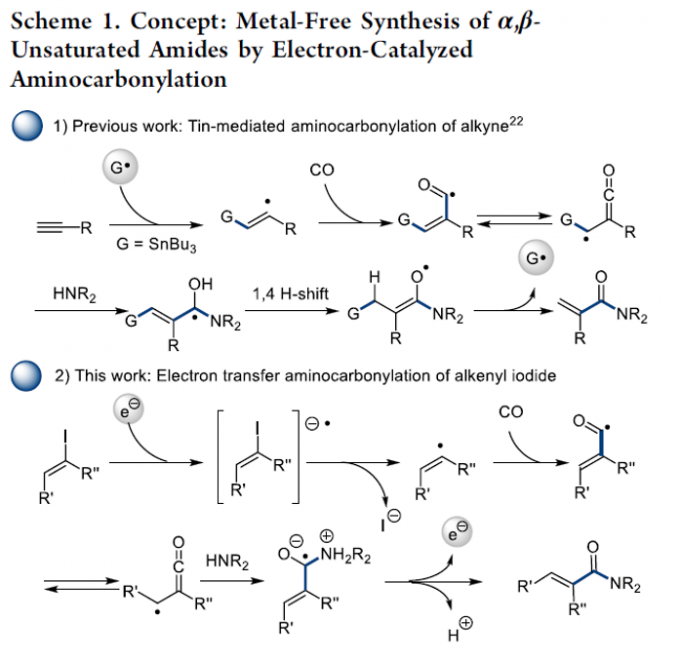
α,β-不饱和酰胺骨架广泛存在于一系列天然产物分子中,并且,同样能够作为有机合成化学以及材料分子合成中的关键砌块。目前,已经成功设计出诸多构建α,β-不饱和酰胺类分子的合成转化策略[1]-[3]。其中,在无过渡金属催化剂存在的条件下,通过烯基自由基中间体进行的氨基羰基化反应方法学已经开始受到有机合成化学家的关注[4]。这里,受到本课题组前期对于通过三丁基锡基自由基参与的炔基化合物的形式氨基羰基化反应方法学[4] (Scheme 1, eq 1)以及近期对于通过锡基自由基参与的芳基碘羰基化反应方法学[5]相关研究的启发,本文中,作者成功设计出一种全新的烯基碘、CO与胺之间的氨基羰基化反应方法学,进而成功实现一系列α,β-不饱和酰胺分子的高效构建 (Scheme 1, eq 2)。
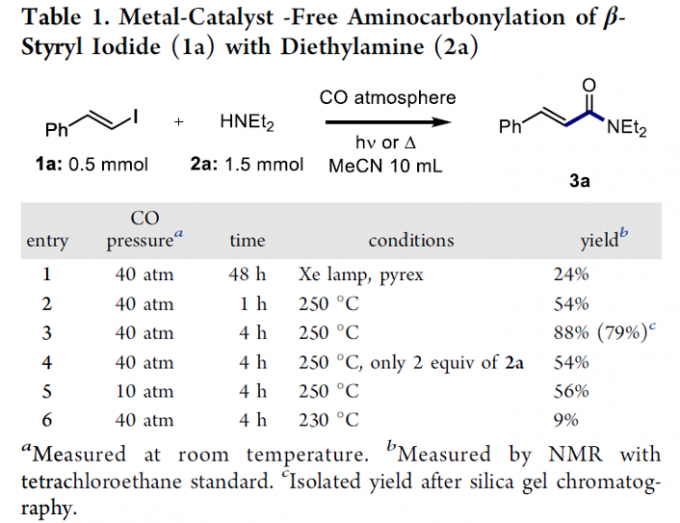
首先,作者采用β-碘苯乙烯1a与二乙胺2a作为模型底物,进行相关氨基羰基化反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:在40 atm的CO气氛中,采用乙腈作为反应溶剂,反应温度为250 oC,并获得88%收率的氨基羰基化产物3a。
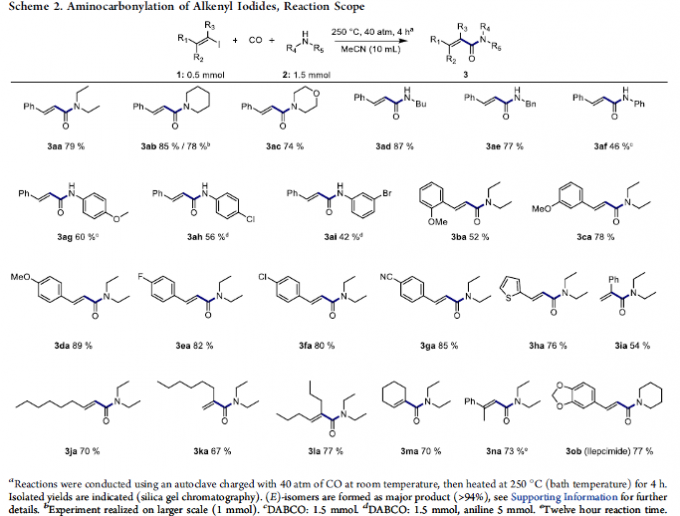
在上述的最佳反应条件下, 作者开始对一系列2-芳基-1-烯基碘1与胺2的底物应用范围进行考察 (Scheme 2)。首先,作者发现,一系列一级与二级烷基胺底物均能够较好地与上述的标准反应条件兼容,并获得相应的氨基羰基化产物3aa–3ae (74-87% 收率)。而对于取代的苯胺底物,则需要加入DABCO作为添加剂,进而获得中等收率的目标产物3af–3ai。接下来,该小组进一步发现,上述的标准反应体系对于烯基末端具有一系列不同电子性质的芳基与噻吩基团取代的烯基碘底物,均能够良好地兼容,并获得相应的氨基羰基化产物3ba–3ha (52-89% 收率)。同样地,研究表明,α-碘苯乙烯底物 (1i)同样能够有效地参与上述的合成转化过程,并获得54%收率的氨基羰基化产物3ia。之后,该小组进一步对一系列具有非芳香基团取代的烯基碘底物进行深入研究。作者观察到,各类非芳香基团取代的烯基碘底物在上述的标准反应条件下,均能够顺利地完成上述的合成转化过程,获得相应的产物3ja–3na (67-77%收率)。同时,作者发现,这一全新的氨基羰基化策略能够有效地应用于各类天然生物碱以及药物相关分子的的合成,进而表现出潜在的合成应用价值。
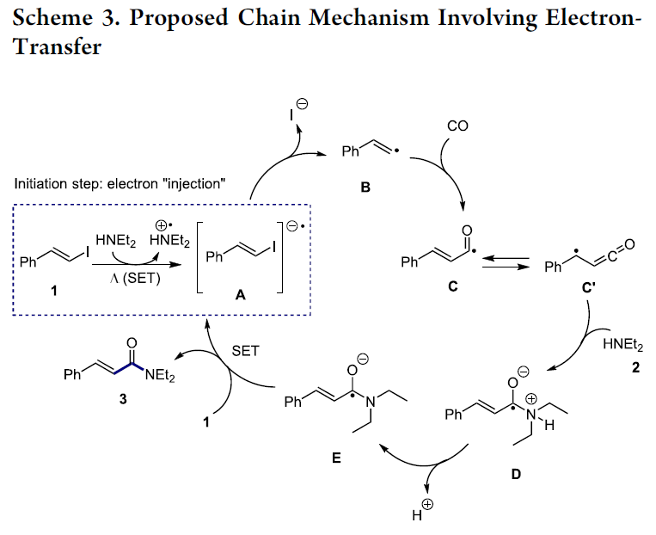
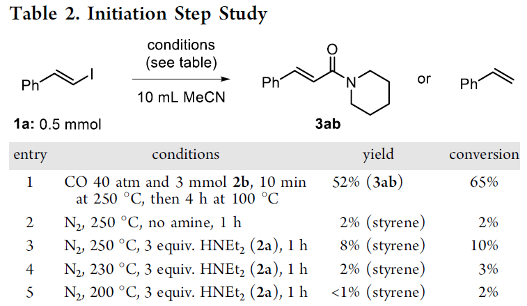
接下来,作者提出一种合理的反应机理路径 (Scheme 3)。同时,该小组同样对上述反应机理过程中可能的引发步骤 (即自由基形成步骤)进行进一步研究 (Table 2)。
总结
台湾阳明交通大学的Ryu Ilhyong课题组报道一种在无金属催化剂存在以及过热的 (superheated)反应条件下进行的烯基碘、CO与胺之间的氨基羰基化反应方法学,进而成功实现一系列α,β-不饱和酰胺衍生物的构建。这一全新的氨基羰基化策略具有无需采用渡金属催化剂、氧化还原催化剂以及自由基媒介等优势。
参考文献
[1] (a) K. M. Driller, S. Prateeptongkum, R. Jackstell, M. Beller, Angew. Chem. Int. Ed. 2011, 50, 537. doi: 10.1002/anie.201005823.(b) F. Sha, H. Alper, ACS Catal. 2017, 7, 2220. doi: 10.1021/acscatal.7b00367.
[2] R. Shi, H. Zhang, L. Lu, P. Gan, Y. Sha, H. Zhang, Q. Liu, M. Beller, A. Lei, Chem. Commun. 2015, 51, 3247. doi: 10.1039/C4CC08925A. [3] (a) R. F. Cunico, B. C. Maity, Org. Lett. 2003, 5, 4947. doi: 10.1021/ol030110l.(b) W. Ren, M. Yamane, J. Org. Chem. 2010, 75, 8410. doi: 10.1021/jo101611g.
[4] Y. Uenoyama, T. Fukuyama, O. Nobuta, H. Matsubara, I. Ryu, Angew. Chem. Int. Ed. 2005, 44, 1075. doi: 10.1002/anie.200461954. [5] (a) T. Kawamoto, A. Sato, I. Ryu, Chem. – Eur. J. 2015, 21, 14764. doi: 10.1002/chem.201503164.(b) H. Zhang, R. Shi, A. Ding, L. Lu, B. Chen, A. Lei, Angew. Chem. Int. Ed. 2012, 51, 12542. doi: 10.1002/anie.201206518.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载

















No comments yet.