本文作者:杉杉
导读:
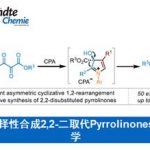
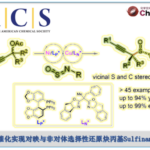
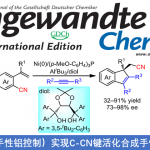
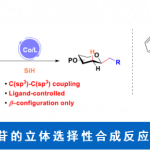
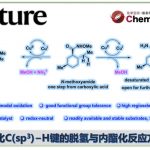
近日,美国Scripps研究所余金权教授课题组在Angew. Chem. Int. Ed.上发表论文,报道了以Mo(CO)6为羰基源,在钯催化剂和双齿配体的催化体系中,成功实现了游离羧酸的β-或γ-C(sp3)-H羰基化,从而合成一系列环状酸酐衍生物。同时,合成的琥珀酸酐可进一步进行脱羧官能化反应,从而在β-位成功地引入烷基、烯基、芳基、炔基、硼烷基、甲硅烷基、氟原子等基团,成为实现羧酸β-C-H活化的另一种高效策略。此外,该策略也可用于游离环丙烷羧酸的对映选择性羰基化反应。
Syntheses of Cyclic Anhydrides via Ligand-Enabled C-H Carbonylation of Simple Aliphatic Acids
Zhe Zhuang, Alastair N. Herron, and Jin-Quan Yu*
Angew. Chem. Int. Ed. ASAP DOI:10.1002/anie.202104645
正文
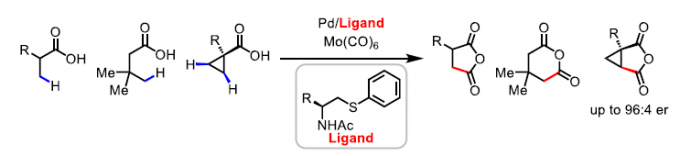
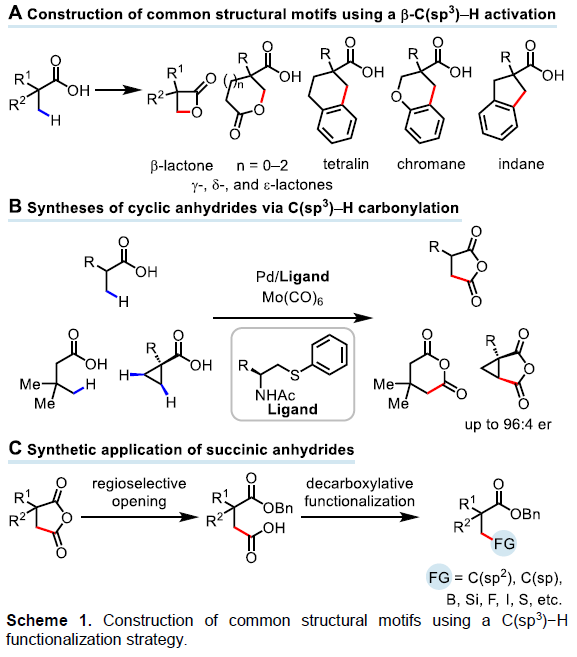
脂肪族羧酸作为一种廉价的底物,已用于各种类型的有机反应中。α,β-不饱和羰基化合物共轭加成,已成为在β–位引入取代基的重要策略。近年来,羧酸的β-C(sp3)-H官能化迅速发展,从而大大扩展了构建C-C和C-Y(Y =杂原子)键的范围。其中,对于使用天然羧酸作为导向基团(DGs)的策略具有明显的优势,可避免DGs的引入和除去过程。同时,本课题组[1]近期也报道了一种通过游离脂肪酸直接合成β-内酯的策略,涉及β-C(sp3)-H活化的过程。该反应使用廉价且实用的过氧化物氧化剂,可从游离羧酸直接合成γ-、δ-和ε-内酯以及四氢萘,苯并二氢吡喃和茚满化合物(Scheme 1A)。在此,美国Scripps研究所余金权教授课题组报道了以Mo(CO)6为羰基源,在钯催化剂和双齿配体的体系中,成功实现了游离羧酸的β-或γ-C(sp3)-H羰基化,从而合成一系列环状酸酐衍生物(Scheme 1B)。同时,合成的琥珀酸酐可进一步进行脱羧官能化反应,从而在β-位成功的引入烷基、烯基、芳基、炔基、硼烷基、甲硅烷基、氟原子等基团,这是以前羧酸β-C-H活化反应所不能实现的策略(Scheme 1C)。此外,该策略也可用于游离环丙烷羧酸的对映选择性羰基化反应。
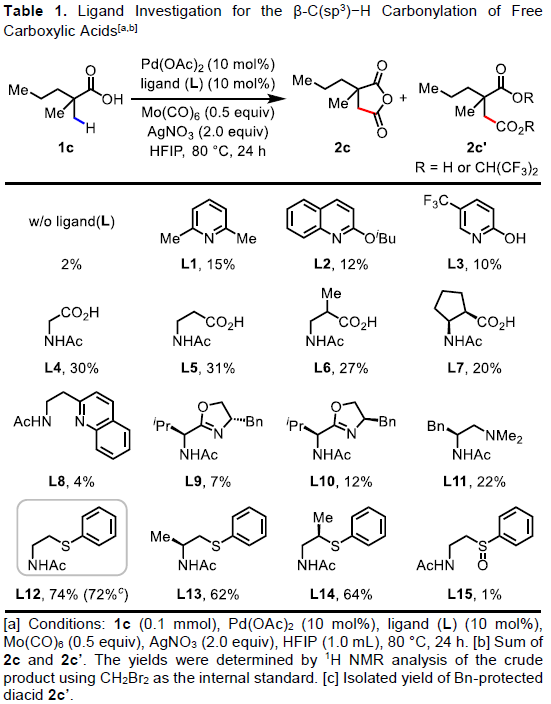
首先,作者以脂肪族羧酸1c作为模型底物,进行了羰基化反应中的配体筛选(Table 1)。筛选结果表明,以Mo(CO)6为羰基源,L12为配体,Pd(OAc)2为催化剂,同时加入2当量的AgNO3,可在HFIP溶剂中80 °C反应,从而获得74%收率的酸酐产物2c。
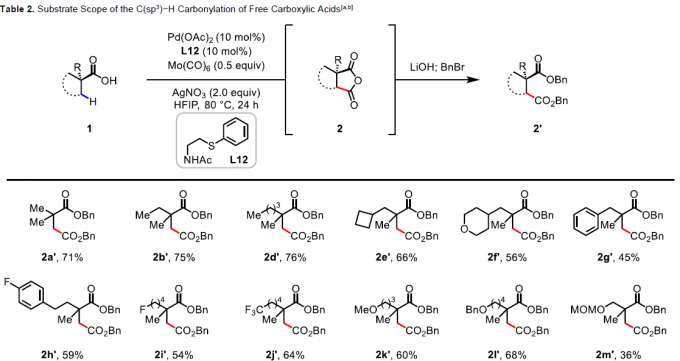
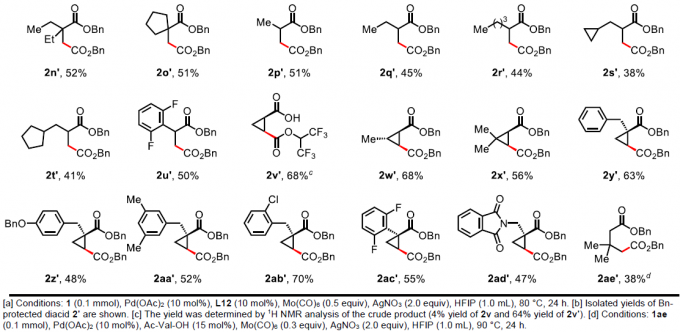
在获得上述最佳反应条件后,作者开始对脂肪族羧酸的范围进行了扩展(Table 2)。为了便于纯化和分析,作者对环状酸酐产物进行了水解和Bn保护。当脂肪族羧酸的α-位取代为三取代(如单/双甲基和各种脂肪族烷烃)时,均可顺利反应,获得相应的产物2a’–2o’。其次,对于脂肪族羧酸的α-位为双取代基时,也与体系兼容,获得相应的产物2p’–2u’。此外,环丙烷羧酸也为合适的底物,可获得产物2v’–2ad’,具有顺式选择性。然而,对于其它游离环状羧酸(如环丁烷,环戊烷和环己烷)不能获得琥珀酸酐产物。同时,该策略可通过γ-C(sp3)-H羰基化形成具有价值的戊二酸酐2ae’,但产率适中(38%)。
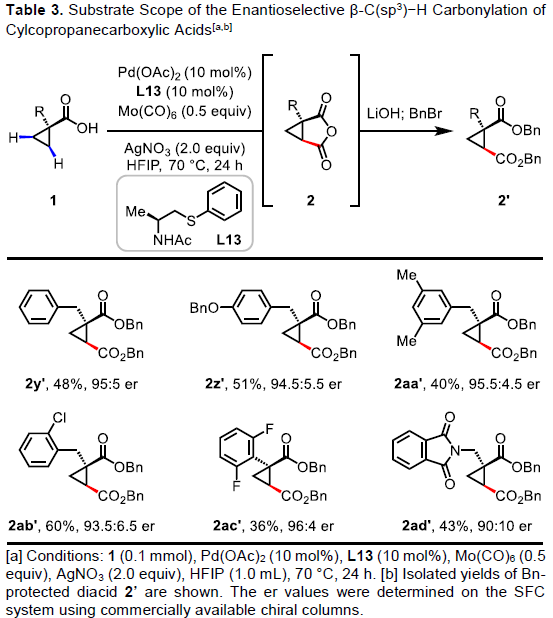
随后,作者对环丙烷羧酸的对映选择性β-C(sp3)-H羰基化反应进行了研究(Table 3)。通过对反应条件的再次优化后发现,当使用配体L13时,一系列环丙烷羧酸均与体系兼容,从而获得良好对映选择性(高达96:4 er)和中等收率(36-60%)的环丙烷稠合产物2y’–2ad’。
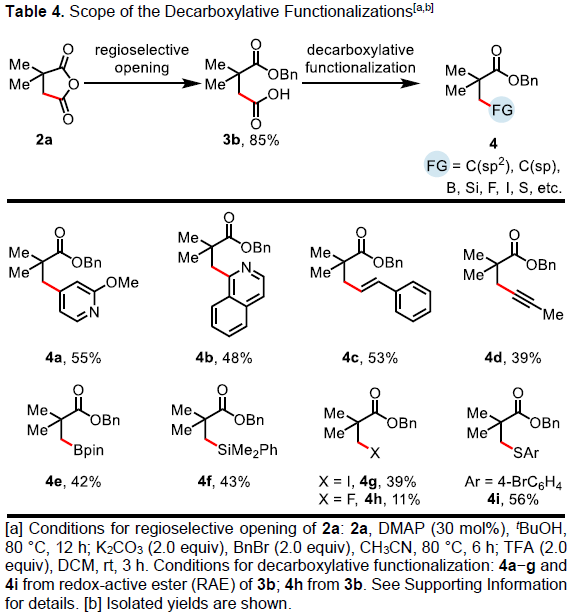
此外,合成的琥珀酸酐,可在β-位上构建C-C和C-Y(Y = 杂原子)键,进一步证明了反应的实用性(Table 4)。首先,将2a转化为β-羧基酯3b,随后通过脱羧官能团化反应,即可在β-位上引入一系列芳基、烯基、炔基、硼基、甲硅烷基、氟原子、碘原子、硫酚等。
总结
美国Scripps研究所余金权教授课题组报道了一种Pd(II)催化剂和双齿配体的催化体系,以Mo(CO)6为羰基源,可实现脂肪羧酸的高效C-H羰基化反应,从而合成一系列环状酸酐衍生物。同时,合成的琥珀酸酐可进一步进行脱羧官能化反应,从而在β-位成功的引入一系列官能团。此外,该策略也可用于游离环丙烷羧酸的对映选择性羰基化反应。

















No comments yet.