导读
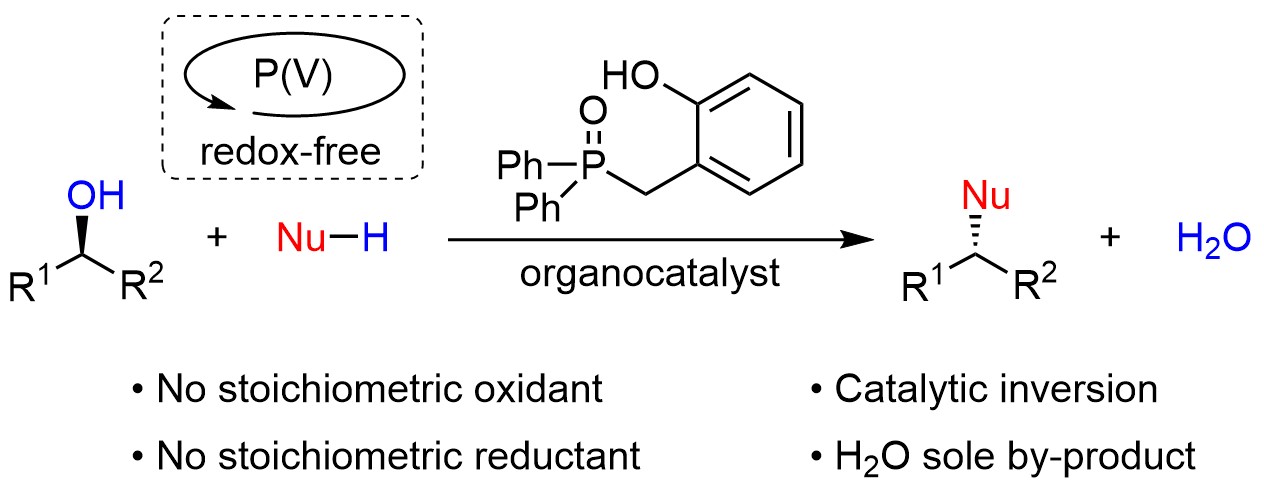
醇类化合物的亲核取代反应是有机化学中最基础且应用最广泛的反应之一,过去的半世纪时间里Mitsunobu反应(光延反应)一直是将醇类化合物经亲核取代转化为立体专一性其他官能化产物的有效方法,然而反应必须依赖化学计量的三苯基膦和危险的偶氮试剂,同时也不可避免产生化学计量的副产物为后续分离纯化带来困难,这种低原子经济性的反应显然也不符合现今倡导的绿色可持续化学理念。鉴于此,英国诺丁汉大学的Denton教授等人精心设计了可参与催化循环的氧化膦(phosphine oxide)有机催化剂,无需借助任何化学计量的氧化剂和还原剂即可实现催化的Mitsunobu反应,整个过程中唯一的副产物是H2O,改良后的方法还可用于C-N键和C-S键的构建以及复杂天然产物的结构修饰,具有非常广阔的应用前景,目前相关成果发表于国际顶级期刊:
Rhydian H. Beddoe, Keith G. Andrews, Valentin Magné, James D. Cuthbertson, Jan Saska, Andrew L. Shannon-Little, Stephen E. Shanahan,Helen F. Sneddon, Ross M. Denton
Redox-neutral organocatalytic Mitsunobu reactions
Science 2019, 365, 910-914. DOI: 10.1126/science.aax3353
研究背景
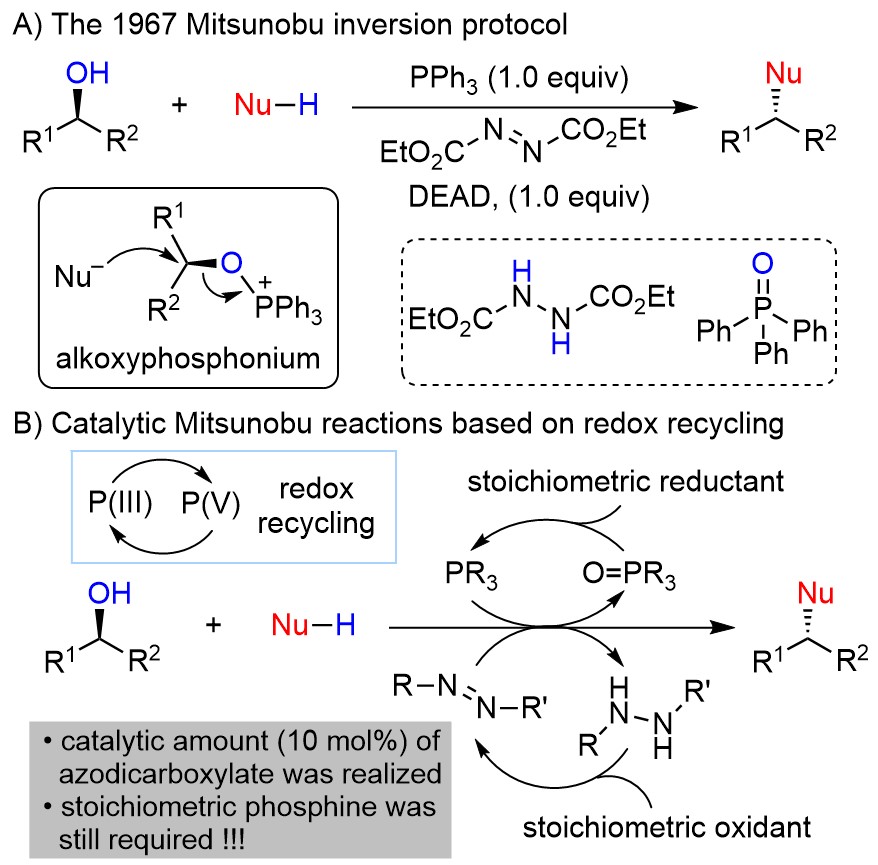
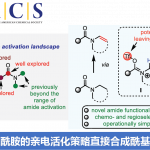
Mitsunobu反应是日本化学家光延旺洋(Oyo Mitsunobu)等人于1967年发现的,在化学计量的偶氮二羧酸二乙酯(DBED)和三苯基膦作用下,伯醇和仲醇与亲核试剂发生分子间SN2反应得到立体专一性构型翻转的产物,其中立体专一性的关键是亲核试剂对烷氧基膦正离子(alkoxyphosphonium)进攻后的瓦尔登翻转(Walden inversion),尽管这一反应在有机合成领域有着广泛应用,但它的局限在于需要化学计量的试剂以及会产生化学计量的副产物(图1,A)。为了克服上述局限,全世界多个课题组都在试图发展催化循环版的Mitsunobu反应,较为代表性的工作都是利用化学计量的氧化剂和还原剂分别针对三苯基膦和偶氮物种设计催化循环,尽管目前已经可以将催化量的偶氮化合物用于反应,但三苯基膦循环仍然无法实现仅仅使用催化量的反应物。此外,这种策略由于离不开额外化学计量的氧化剂和还原剂,显然仍不是最理想的方法和策略(图1,B)。
图 1 研究背景
研究思路
不同于上述策略,Denton教授等人设想能否不改变膦元素的氧化态,在反应起始就直接利用五价的膦物种,这就要求形成烷氧基膦正离子中间体3的过程不同于传统机理。具体说来,他们设计了一种五价膦催化剂1,通过与亲核试剂间脱水-环化的步骤形成环状的膦盐2,随后底物醇进攻开环形成烷氧基膦正离子中间体3,后续步骤与经典的Mitsunobu反应并无太大差异,亲核试剂“背面”进攻中间体3得到构型翻转的产物,同时恢复膦氧双键结构使催化剂再生(图2)。然而,由于膦氧双键很稳定比较难以破坏,因而反应需要的条件也相对严苛,再考虑到亲核试剂与催化剂作用后脱去的水分子会导致膦盐物种水解以及影响反应的平衡,作者最终决定采用Dean-Stark技术通过与甲苯或二甲苯共沸除水,从而保证反应能够顺利进行。
图 2 作者新的催化循环研究思路
研究内容
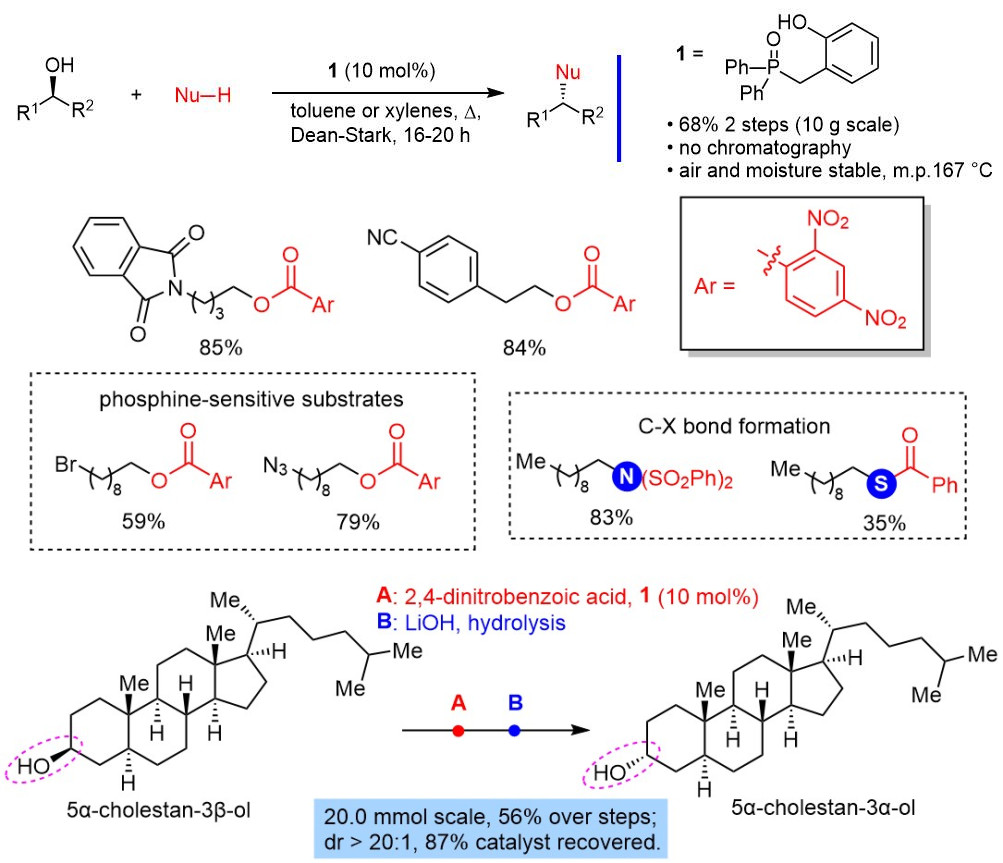
为了验证上述设想,作者以手性纯的(+)-2-辛醇(> 99% ee)为底物,首先对亲核试剂羧酸的作用进行探究后发现其酸性对反应至关重要,若酸性过弱[例如苯甲酸,pKa(H2O) = 4.2]则不能引发反应,随着酸性的增强[例如4-硝基苯甲酸,pKa(H2O) = 3.4]催化循环开始发生,这可能与脱水过程需要较强的酸来活化有关。然而,底物的酸性亦不能太强,否则底物醇经质子活化后得到碳正离子直接与羧酸成酯,丧失立体选择性,此外底物醇也可能会发生消去副反应生成烯烃。鉴于此,作者优化后发现二硝基苯甲酸的酸性正合适,可以得到84%产率的酯化产物,同时构型翻转后依然保持有极高的手性纯度(98% ee)。
得到最佳反应条件后,作者对反应的底物适用范围进行了探究,以2,4-二硝基苯甲酸为亲核试剂时,多种结构差异巨大的伯醇和仲醇以及含特定官能团的底物都能顺利发生反应,即使对膦物种敏感的底物(底物易发生脱卤素和叠氮还原等)也能完美兼容,更值得一提的是该方法还可用于复杂天然产物的结构修饰,原位水解后得到羟基翻转的产物,产率和非对映选择性(> 20:1 dr)都非常理想,整个过程结束后催化剂可以回收再利用,并未见催化活性的明显降低。除羧酸外,磺酰胺和硫代苯甲酸都是合适的亲核试剂能够用于C-N键和C-S键的构建,图3
图 3 代表性的底物范围
为更进一步拓展反应的应用性,作者拟 采用弱酸性的苯酚作为亲核试剂,尽管苯酚自身的酸性不足以与催化剂直接作用引发反应,但作者另辟蹊径加入TsOH•H2O后先实现底物醇的催化对甲苯磺酰化(tosylation)后再与苯酚发生酯化,这一策略成功用于抗结核药物thiocarlide的合成。最后,作者还成功实现了醇分子在三氟甲磺酸(TfOH)和氧化膦催化剂1共催化下的自偶联反应,反应过程中部分醇分子先经Mitsunobu反应催化循环转化为三氟甲磺酸酯,剩余的醇分子则作为亲核试剂与三氟甲磺酸酯原位成醚,该方法有望成为新型的醚合成法,图4。
图 4 苯酚为亲核试剂及醇的醚化反应
论文评价
英国诺丁汉大学的Denton教授等人首次实现了真正意义上催化的Mitsunobu反应,对此项突破性成果,美国科罗拉多州立大学化学系的Andy McNally教授在Nature Chemistry期刊发表亮点介绍性论文(Nat. Chem. 2019, 11, 966-967. DOI: 10.1038/s41557-019-0362-2)并评价说:“站在可持续性角度来看,这种新型的催化版Mitsunobu反应无疑是巨大进步,所有反应物的原子几乎全部转移到了产物;此外,反应所需的新型氧化膦催化剂性质稳定、能够实现大克级合成并且可循环使用,而其合成价值更体现在广泛的底物适用范围以及对于天然产物分子结构修饰和药物分子的高效合成上···”。事实上,这篇论文非常值得从事有机合成研究的人员阅读和学习,作者的研究思路和策略以及最后通过同位素标记实验、核磁共振实验对机理进行验证的实验方法对我们从事相关研究都具有重要的参考意义。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.