本文作者:杉杉
导读
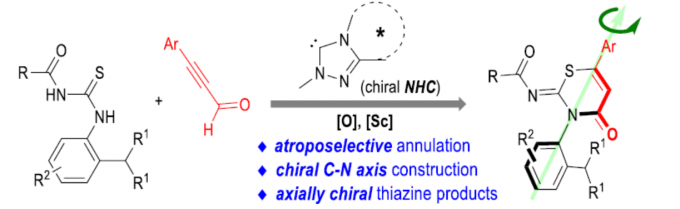
近日,贵州大学金智超教授课题组在Angew. Chem. Int. Ed.上发表论文,报道了N-杂环卡宾催化硫脲与炔基醛(ynals)的催化阻转选择性(atroposelective)环加成反应,从而构建具有C-N轴手性的噻嗪衍生物。同时,通过对产物的后期修饰,进一步证明了反应的实用性。
N-Heterocyclic Carbene-Catalyzed Atroposelective Annulation for Access to Thiazine Derivatives with C-N Axial Chirality
Tingting Li, Chengli Mou, Puying Qi, Xiaolin Peng, Shichun Jiang, Gefei Hao, Wei Xue, Song Yang, Lin Hao, Yonggui Robin Chi, and Zhichao Jin
Angew. Chem. Int. Ed. ASAP DOI: 10.1002/anie.202010606
正文
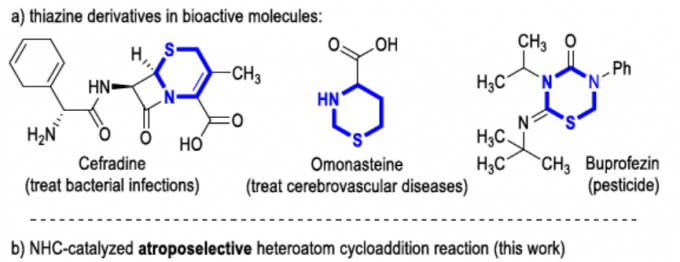
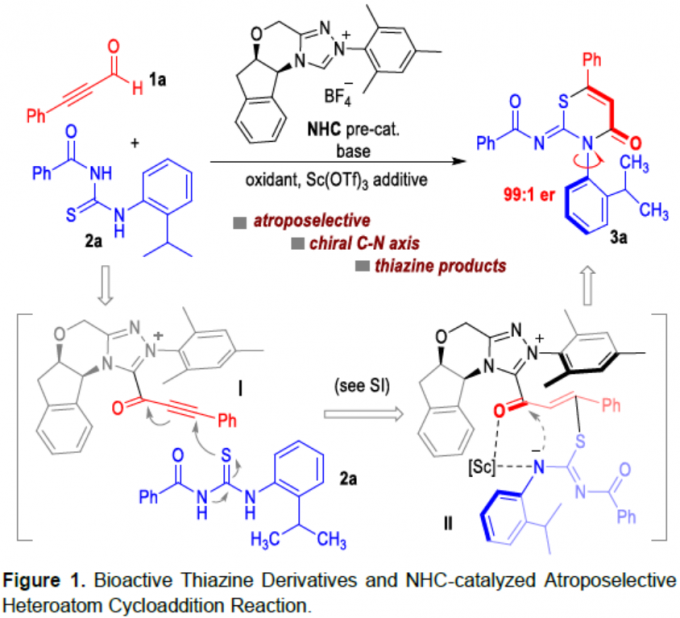
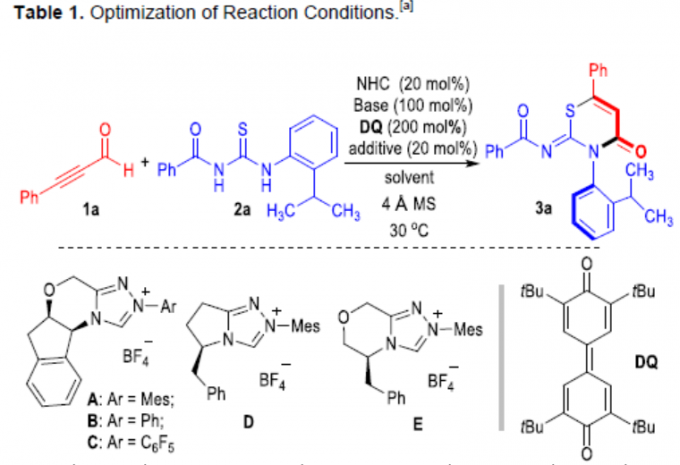
噻嗪化合物广泛存在于药物、农药中,如头孢菌素中的头孢拉定(Cefradine)已广泛用作治疗或预防细菌感染的人用药物,奥莫司坦(Omonasteine)用于治疗呼吸道疾病,扑虱灵(Buprofezin)用于保护农作物免受各种昆虫侵害的农药(Figure 1a)。因此,对于非手性或对映体富集的噻嗪衍生物在合成化学领域已受到大量的关注。迄今为止,大多数手性噻嗪衍生物是通过引入手性中心从而获得。同时,具有轴手性的分子在催化和医学等领域具有优异的性能。此外,对于C-N手性轴的阻转选择性合成一直作为合成化学领域中的热点。如Miller[1e-g]、Gustafson[1k]等已报道有机催化阻转选择性溴化反应,从而构建手性C-N轴。Jørgensen[1a-b]、Tan[1h]、Zhang[1j]和Yang [1l]等报道了有机催化阻转选择性Friedel-Crafts胺化反应,从而合成轴手性N-芳基化合物。由手性路易斯酸或碱促进的N-亲核反应,也作为合成具有C-N轴手性化合物的方法[1c-d, 1i]。 据文献查阅,仅有Zhao、Wang、Zhu等[2]报道了通过NHC催化从而构建C-C轴手性的例子。对于涉及杂原子中心亲核试剂的NHC催化阻转选择性环化反应,仍未被有效的开发。在此,贵州大学金智超教授课题组报道了N-杂环卡宾(NHC)催化硫脲与炔基醛之间的阻转选择性环加成反应,从而合成具有C-N轴手性的噻嗪衍生物(Figure 1b)。在此类反应中,NHC催化将硫脲(2a)加成到乙炔酰基唑离子中间体(I)中,形成新的C(sp2)-S键(中间体II)。随后,N负离子进攻羰基形成内酰胺,再经阻转选择性,从而获得手性噻嗪衍生物3a。
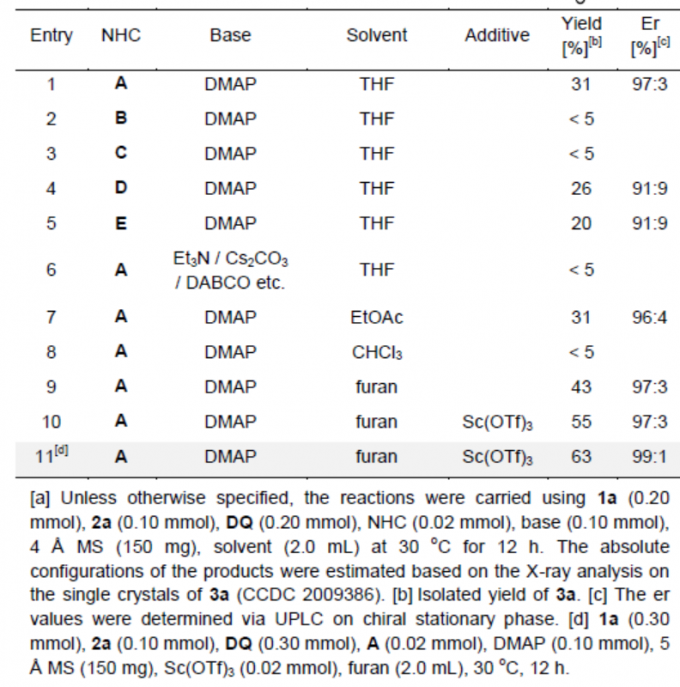
首先,作者以炔基醛1a和苯甲酰硫脲2a作为模型底物,进行了相关环化反应条件的筛选(Table 1)。反应的最佳条件下:使用20 mol %的NHC催化剂A,一当量的DMAP作为碱,20 mol %的Sc(OTf)3为添加剂,同时加入2当量DQ时,可于呋喃溶剂中30 ℃中反应,从而获得目标产物3a,er为99:1。
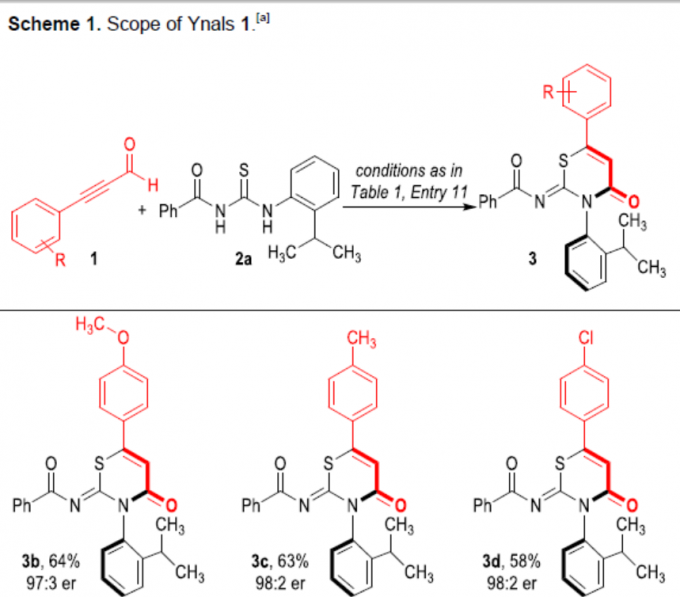
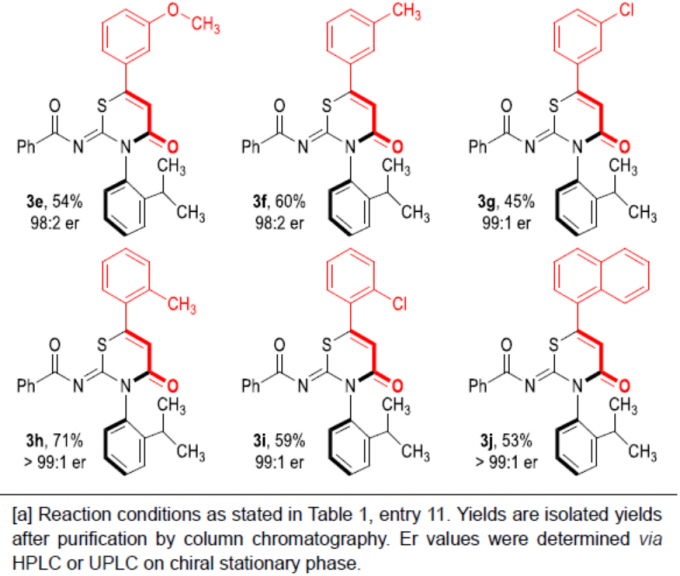
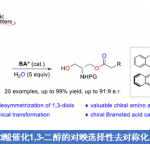
在获得上述最佳反应条件后,作者对炔基醛底物1进行了扩展(Scheme 1)。反应结果表明,炔基醛中的芳基取代不受电子效应和定位效应的影响,均可顺利反应,获得相应的产物3b–3i,收率为45-71%,er为97:3->99:1。同时,将芳基取代改为萘基时,也可进行反应,获得53%收率的产物3j,er为>99:1。
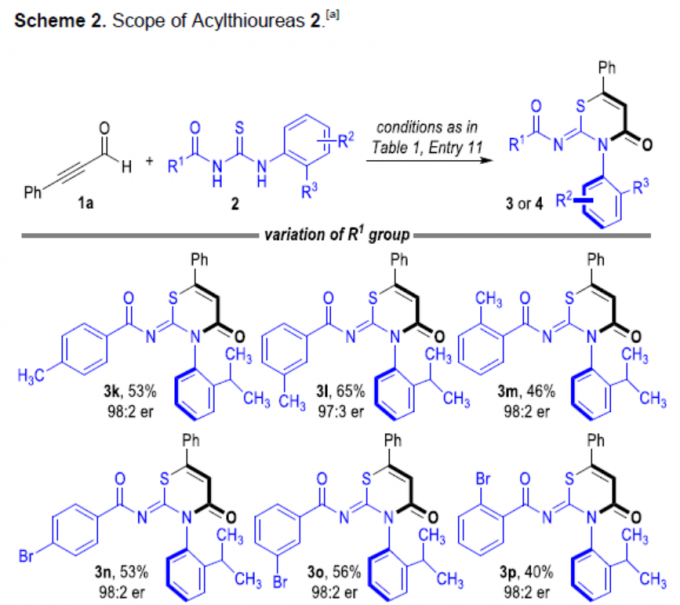
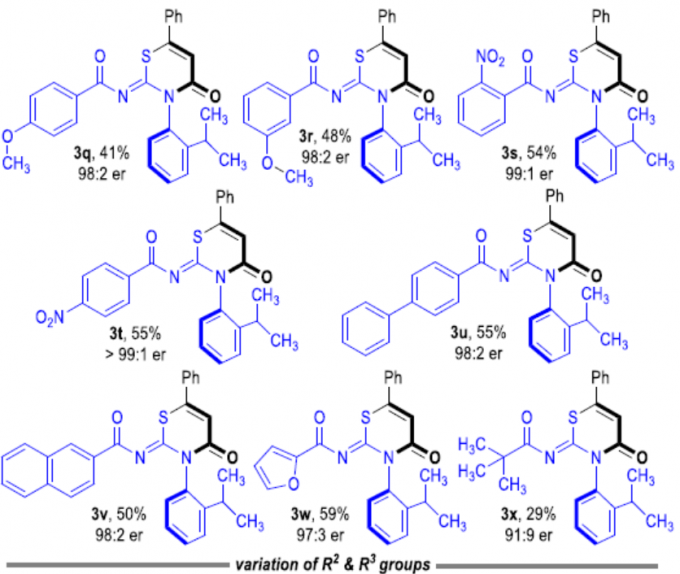
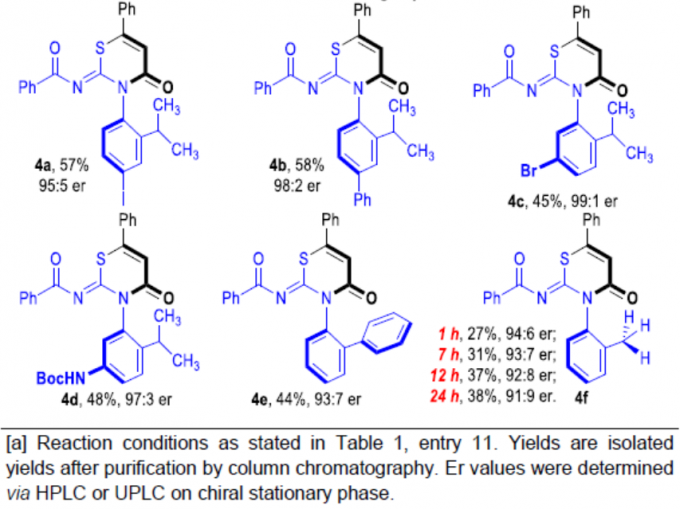
随后,作者对硫脲底物2进行了相关的扩展(Scheme 2)。当R1基团为芳基,反应不受电子效应和定位效应的影响,均可获得相应的产物3k–3u。同时,当R1基团为萘基、呋喃基和叔丁基时,反应也能顺利进行,获得产物3v–3x。此外,具有不同取代基的R2和R3时,也能获得中等收率的相应产物4a–4f。值得注意的是,随着反应时间的延长,4f的er值逐渐降低。
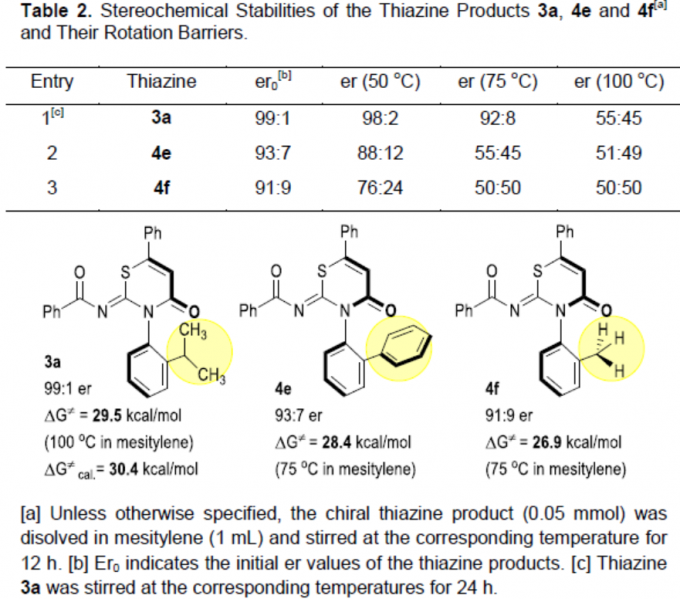
紧接着,作者对产物的立体化学稳定性进行了相关的研究(Table 2)。反应结果表明,3a的er值在50 ℃时稳定,当升至100 ℃时保持24 h后,er值下降至55:45。4e在50 ℃时不如3a稳定,当升至75 ℃时保持4 h后,er值下降至55:45。对于4f,er值受温度影响更为明显。
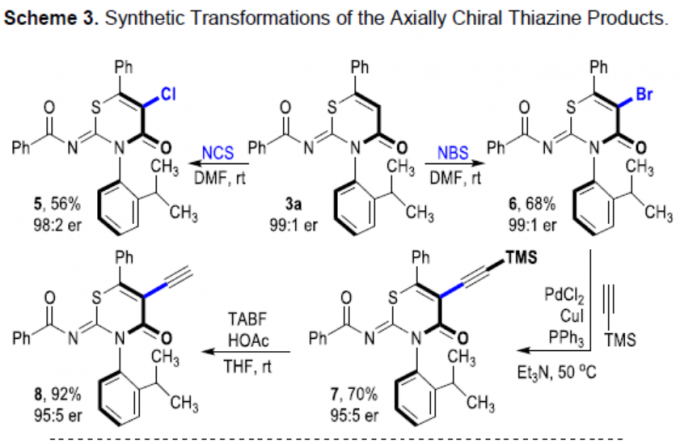
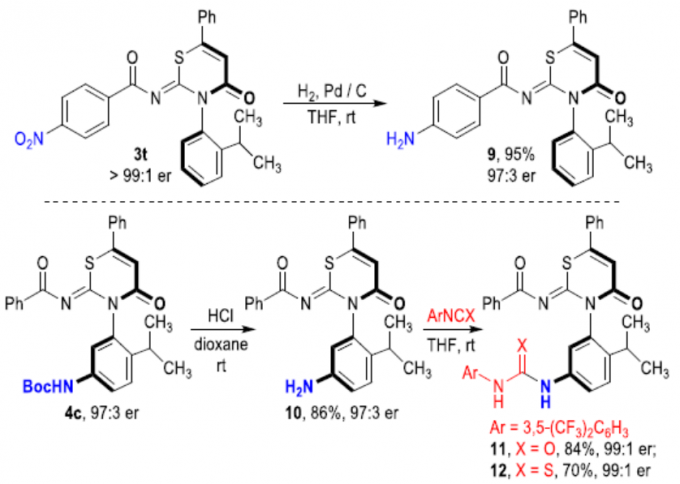
为了进一步证明反应的实用性,作者对产物进行了后期衍生化(Scheme 3)。首先,3a可在温和的条件下进行α-卤代反应,以中等收率得到产物5和6,且光学纯度没有明显的下降。同时,α-溴化产物6可与炔烃进行偶联反应,以良好的收率和优异的对映选择性获得炔烃产物7,若将TMS基团脱保护,则可形成手性末端炔烃8。值得注意的是,8中的末端炔基可进行多种转化。其次,轴向手性产物3t中硝基,可在加氢还原的条件下反应,获得游离氨基产物9,er值略有下降。此外,4c中的Boc保护基可在酸性条件下除去形成游离的氨基,再与ArNCX(X = O,S)反应,则可形成脲11或硫脲12。
总结
贵州大学金智超教授课题组报道了一种N-杂环卡宾催化硫脲与炔基醛之间的阻转选择性环加成反应,从而合成对映体富集的噻嗪衍生物。同时,通过NHC有机催化,首次实现手性C-N轴的构建。其次,该反应具有良好的官能团耐受性。此外,通过对产物的后期修饰,进一步证明了反应的实用性。


















No comments yet.