本文作者:杉杉
导读
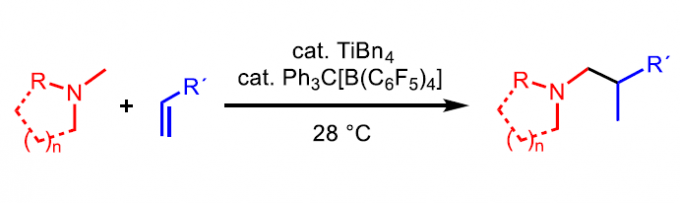
近日,德国奥登堡大学Sven oye课题组在Angew. Chem. Int. Ed.上发表论文,首次报道了一种阳离子钛催化体系,可用于烯烃与叔胺的分子间氢胺烷基化反应,从而获得一系列支链烷基胺产物。同时,该反应具有温和的反应条件、极好的区域选择性等特点。值得注意的是,对于特定的胺(N-甲基氮杂环庚烷),可同时在N-甲基和α-CH2-基上发生C-H键活化。
Titanium-Catalyzed Intermolecular Hydroaminoalkylation of Alkenes with Tertiary Amines
Dennis Geik, Michael Rosien, Jens Bielefeld, Marc Schmidtmann, and Sven Doye
Angew. Chem. Int. Ed. ASAP DOI:10.1002/anie.202100431
正文
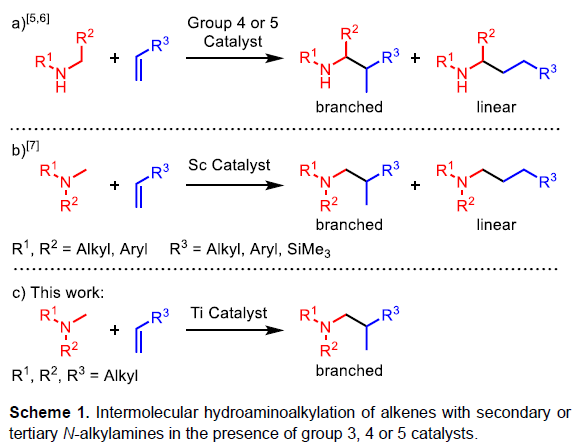
叔胺化合物广泛存在于天然产物(如生物碱)、农用化学品、药物等中。在2018年200种最畅销的小分子药物中,15%以上均包含叔胺骨架。近年来,烯烃的氢胺烷基化反应是一种极具原子经济性的合成方法。同时,也可通过前(后)过渡金属催化剂实现此类转化。目前,已有课题组[1,2]报道通过金属催化实现烯烃与伯(仲)胺的氢胺烷基化反应,然而叔胺底物却不适用(Scheme 1a)。虽然已报道[3,4]后过渡金属催化叔胺的氢胺烷基化反应,但对于胺底物需包含一个额外金属结合的导向基团。近年来,阳离子钪催化剂已被广泛使用,同时也可实现无任何导向基团的叔胺底物与烯烃的氢胺烷基化反应[5](Scheme 1b)。但是,钪催化剂作为一种非常昂贵的金属,并且合成过程麻烦,需在70-120 °C下才具有活性。基于前期对钛催化烯烃、丙二烯和炔烃的氢胺烷基化反应的总结[6],作者设计了一种可替代的、成本更低的钛催化剂体系,可用于简单叔胺与烯烃的分子间氢胺烷基化反应(Scheme 1c)。
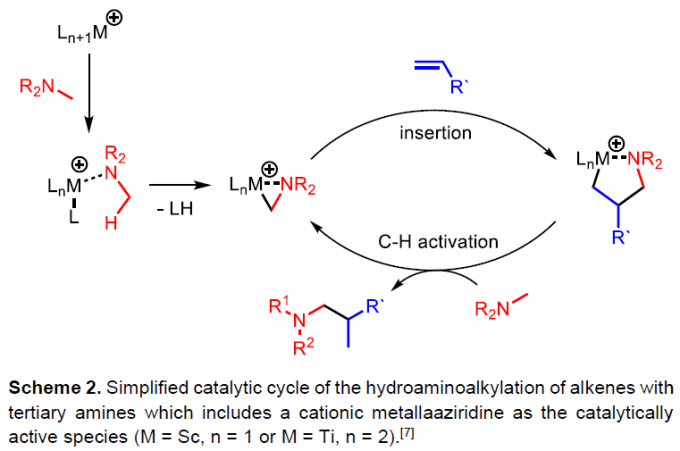
钛催化不饱和底物与伯(仲)胺的氢胺烷基化反应中,由中性钛(IV)前体和胺底物形成中性钛氮丙啶(titanaaziridines)作为催化活性的物质,相应的钛催化叔胺的反应涉及阳离子金属氮丙啶中间体的形成,随后经烯烃的插入以及C-H键的活化,即可获得目标产物(Scheme 2)。
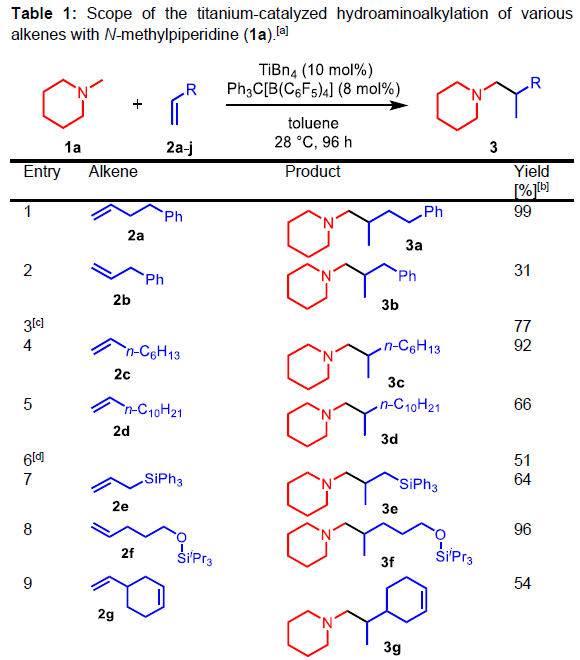
通过对反应条件的优化后发现,当使用10 mol%TiBn4和8 mol%Ph3C [B(C6F5)4],可与甲苯溶剂中室温反应96 h,即可获得相应的产物。紧接着,作者对末端烯烃2a–2j的底物范围进行了扩展(Table 1)。反应结果表明,一系列单取代的末端烯烃均可与N-甲基哌啶(1a)顺利反应,获得54-99%收率的产物 3a–3g。其次,对于双取代末端烯烃可获得84%收率的产物3h。而降冰片烯以及环己烯,也可顺利反应获得产物3i–3j,但收率偏低。
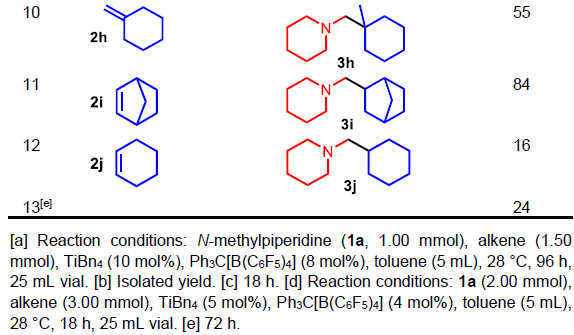
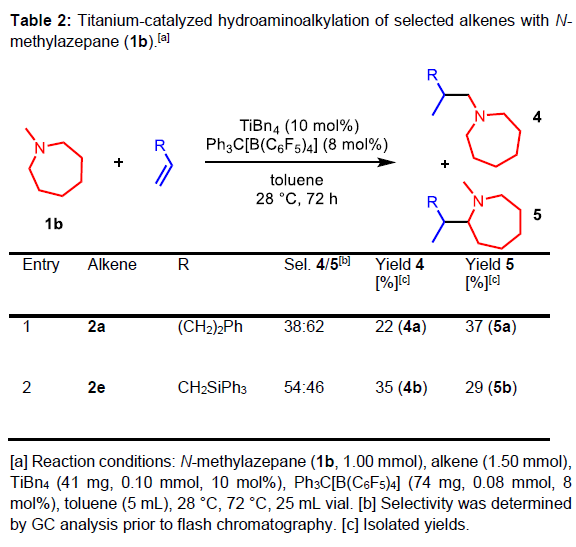
其次,当以N-甲基氮杂环庚烷(1b)与4-苯基丁烯(2a)反应时,α-烷基化同时发生在七元环的N-甲基取代基或α-CH2-基团上,并且亚甲基位上优先,从而获得37%收率的5a和22%收率的4a(Table 2, entry 1)。当使用空间上位阻较少的硅取代烯烃时,分别以35%和29%收率获得产物4b和5b。此外,当使用N-甲基吡咯烷(1c)和各种烯烃(2a–2d)反应时,无法分离两种氢氨烷基化产物,但可分离出相应的混合产物,收率为18-36%,GC表明在杂环的α-CH2-基团上的烷基化优先进行。值得注意的是,烯烃的氢氨烷基化反应中,胺的α-CH2-烷基化优于竞争的α-CH3-烷基化。
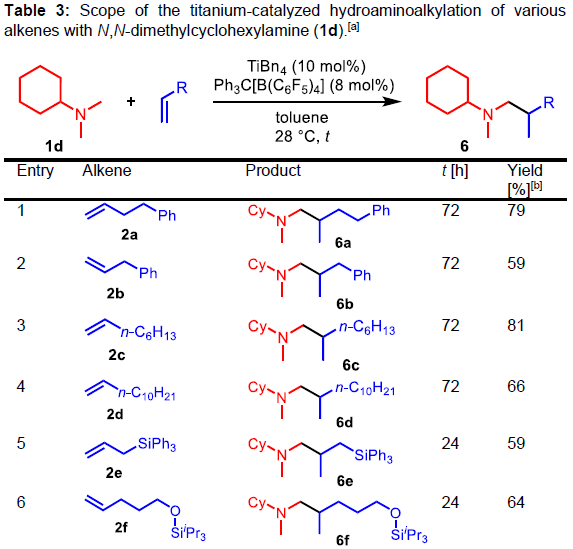
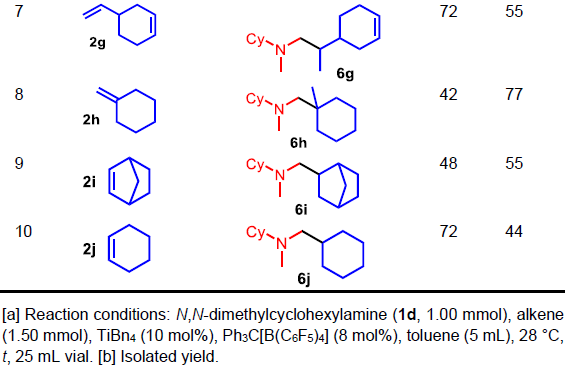
随后,作者研究了N,N二甲基环己胺(1d)与各种烯烃(2a–2j)反应(Table 3)。反应结果表明,一系列烯烃底物,均可顺利反应,获得相应的产物6a–6j,收率为44-81%。值得注意的是,可通过H2PtCl6/KI溶液对其检测。同时,内烯烃比末端烯烃的收率低。
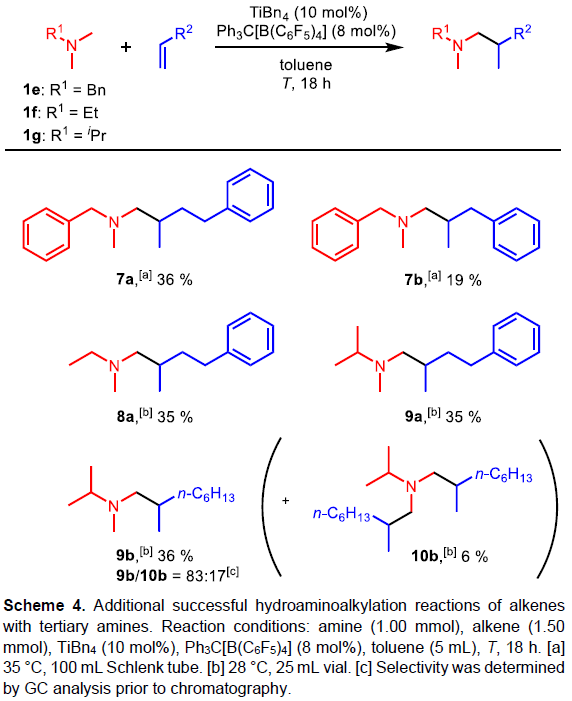
紧接着,作者将叔胺的底物改为N,N-二甲基苄胺(1e)、N,N-二甲基乙胺(1f)和N,N-二甲基异丙基胺(1g),分别与不同的烯烃反应(Scheme 4)。N,N-二甲基苄基胺(1e)的烷基化主要选择在甲基位(而不是活化的苄基位),在35 °C下可获得更好的结果。在N,N-二甲基异丙胺(1g)与1-辛烯(2c)的反应中分离出两种产物,单-(9b)和二烷基化的产物(10b),合并收率为42%,在35 °C下使用20 mol%的催化剂,收率可提高到57%(9b,47%和10b,10%)。然而,当使用N,N-二甲基苯胺与4-苯基丁烯(2a)或1-辛烯(2c)反应时,均失败。
总结
德国奥登堡大学Sven Doye课题组报道了首次报道了一种阳离子钛催化烯烃与叔胺的分子间氢胺烷基化反应,从而获得一系列支链烷基胺产物。对于该催化剂,可通过TiBn4和Ph3C[B(C6F5)4] 原位生成。同时,该反应条件温和,一系列杂环和非杂环脂肪族胺以及单、1,1-或1,2-二取代的烯烃均为合适的底物。值得注意的是,与竞争性的α-CH3-烷基化反应相比,有时胺的α-CH2-烷基化反优先反应。
参考文献
[1] R. Kubiak, I. Prochnow, S. Doye,
Angew.
Chem.
Int.
Ed.
2009,
48, 1153−1156;
Angew.
Chem.
2009,
121, 1173−1176; b) I. Prochnow, R. Kubiak, O. N. Frey, R. Beckhaus, S. Doye,
ChemCatChem 2009,
1, 162–172; c) R. Kubiak, I. Prochnow, S. Doye,
Angew. Chem. Int. Ed. 2010,
49, 2626–2629;
Angew. Chem. 2010,
122, 2683–2686; d) J. Dörfler, T. Preuß, A. Schischko, M. Schmidtmann, S. Doye,
Angew.
Chem.
Int.
Ed.
2014,
53, 7918–7922;
Angew.
Chem.
2014,
126, 8052−8056; e) A. Koperniku, P. J. Foth, G. M. Sammis, L. L. Schafer,
J. Am. Chem. Soc. 2019,
141, 18944–18948; f) J. Bielefeld, S. Doye,
Angew.
Chem.
Int.
Ed.
2020,
59, 6138–6143.
[2] Selected examples of group 5 metal catalysts: a) M. G. Clerici, F. Maspero,
Synthesis 1980, 305–306; b) S. B. Herzon, J. F. Hartwig,
J.
Am.
Chem.
Soc.
2007,
129, 6690−6691; c) P. Eisenberger, R. O. Ayinla, J. M. P. Lauzon, L. L. Schafer,
Angew. Chem. Int. Ed. 2009,
48, 8361–8365;
Angew. Chem. 2009,
121, 8511–8515; d) G. Zi, F. Zhang, H. Song,
Chem.
Commun.
2010,
46, 6296–6298; e) A. L. Reznichenko, K. C. Hultzsch,
J.
Am.
Chem.
Soc.
2012,
134, 3300–3311; f) E. Chong, J. W. Brandt, L. L. Schafer,
J.
Am.
Chem.
Soc.
2014,
136, 10898−10901; g) P. Daneshmand, S.-C.Roşca, R. Dalhoff, K. Yin, R. C. DiPucchio, R. A. Ivanovich, D. E. Polat, A. M. Beauchemin, L. L. Schafer,
J.
Am.
Chem.
Soc.
2020,
142, 15740−15750.
[3] Selected reviews: a) Z. Dong, Z. Ren, S. J. Thompson, Y. Xu, G. Dong,
Chem. Rev. 2017,
117, 9333−9403; b) K. Nakajima, Y. Miyake, Y. Nishibayashi,
Acc. Chem. Res. 2016,
49, 1946−1956.
[4] Selected recent examples: a) L. Leng, Y. Fu, P. Liu, J. M. Ready,
J. Am. Chem. Soc. 2020,
142, 11972−11977; b) A. Trowbridge, D. Reich, M. J.
Gaunt,
Nature 2018,
561, 522−527; c) S. M. Thullen, T. A. Rovis,
J. Am. Chem. Soc. 2017,
139, 15504−15508. [5] Scandium catalysts: a) A. E. Nako, J. Oyamada, M. Nishiura, Z. Hou,
Chem.
Sci.
2016,
7, 6429–6434; b) F. Liu, G. Luo, Z. Hou, Y. Luo,
Organometallics 2017,
36, 1557−1565; c) H. Gao, J. Su, P. Xu, X. Xu,
Org.
Chem.
Front.
2018,
5, 59–63; d) G. Luo, F. Liu, Y. Luo, G. Zhou, X. Kang, Z. Hou, L. Luo,
Organometallics 2019,
38, 1887–1896; e) J. Su, Y. Zhou, X. Xu,
Org.
Biomol.
Chem.
2019,
17, 2013–2019.
[6] a)T. Kaper, M. Fischer, M. Warsitz, R. Zimmering, R. Beckhaus, S. Doye,
Chem. Eur. J. 2020,
26, 14300–14304. b)T. Kaper, M. Fischer, H. Thye, D. Geik, M. Schmidtmann, R. Beckhaus, S. Doye,
Chem. Eur. J. 2021,
27, DOI: 10.1002/chem.202100238.
























No comments yet.