概要
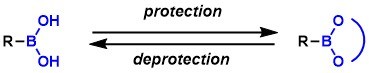
硼酸化合物一般来说对酸、水稳定,而且结晶性也比较好,是一个取用十分简便的试剂。硼酸化合物作为铃木偶联等的底物而备受关注。但是,无保护的硼酸化合物的纯化比较困难,而且容易脱水三聚化,因此定量比较繁琐,同时,有些硼酸化合物对酸或者氧化剂等不稳定,因此常常我们使用的是保护后的硼酸化合物。
常用硼酸保护基实例
经常使用的保护基有以下几种。很多情况下是与二醇反应形成环状酯基来进行对硼酸的保护。随着二醇的立体位阻增大,其被水解的难度也变大,也就更稳定。与单醇成非环状酯的反应通常不作为保护的目的。
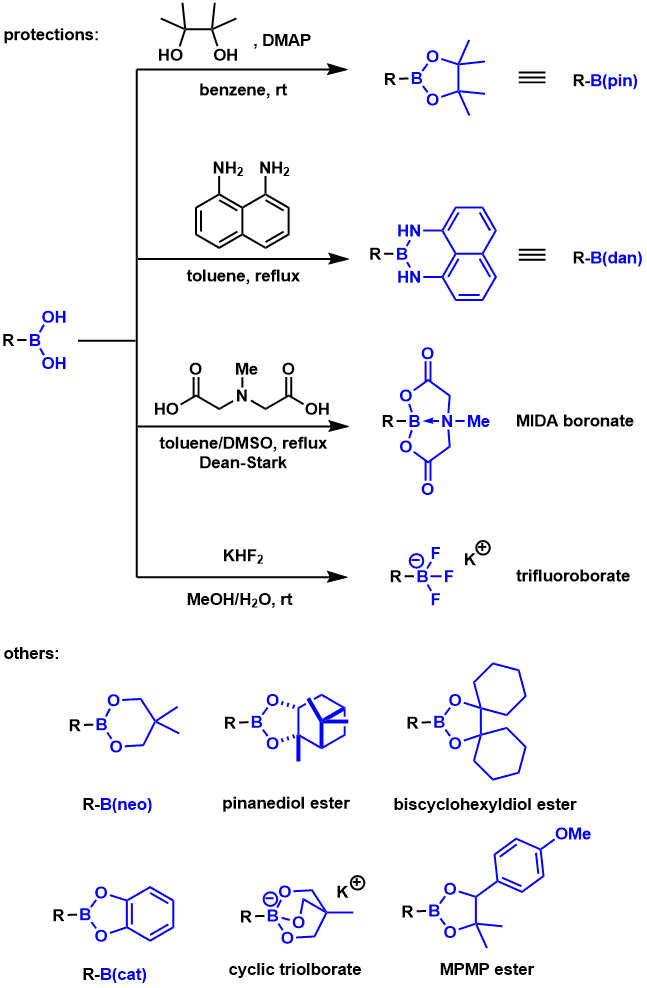
- 频哪醇酯(pin):最受欢迎的保护基。可以通过宮浦硼基化反应、Hartwig-Miyaura C-H硼基化反应等简单的合成制备。保护后的底物反应性适中,可以在氧化条件下转换成醇,另外最主要的是可以直接用作铃木偶联的底物。该保护后的产物可以通过过柱子分离纯化。但是由于过于稳定,所以无法通过水解脱保护成硼酸再转换成其他保护基保护的硼酸酯化合物。
- 二氨基萘酰胺(dan):对各种条件都具有很强的耐受性的保护基。由于邻位的氮原子的电子对硼的空轨道有一个供电子效应,所以该化合物的路易斯酸性与反应性都非常低。
- MIDA硼酸酯:不存在空轨道,因此对各种氧化条件・酸性条件・还原条件具有很强耐受性。可以用硅胶柱直接分离纯化。制备过程中需要在DMSO中加热脱水,并且还要蒸馏除去溶剂,操作麻烦是其最大的缺点。
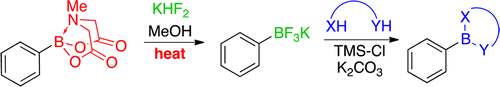
- 三氟硼酸盐:具有很高的结晶性。由于带有吸电性的氟原子,并且没有空轨道的存在所以对氧化条件稳定。有机溶剂中的溶解性比较低。
其他的如邻苯二酚酯(cat)、新戊二醇酯(neo)、不易水解的蒎酯、Biscyclohexyldiol酯、氧化条件下脱保护的MPMP酯、对三氟硼酸盐的缺点进行改良后的三醇硼酸盐等也可以作为候补。
基本文献
<Review>
- Duggan, P. J.; Tyndall, E. M. J. Chem. Soc. Perkin Trans. 1 2002, 1325. DOI: 10.1039/B006767I
- Lennox, A. J. J.; Lloyd-Jones, G. C. Isr. J. Chem. 2010, 50, 664. DOI: 10.1002/ijch.201000074
- Lennox, A. J. J.; Lloyd-Jones, G. C. Chem. Soc. Rev. 2014, 43, 412. DOI: 10.1039/C3CS60197H
- Xu, L.; Zhang, S.; Li, P. Chem. Soc. Rev. 2015, 44, 8848. DOI: 10.1039/C5CS00338E
<diaminonaphthalene>
- Noguchi, H.; Hojo, K.; Suginome, M. J. Am. Chem. Soc. 2007, 129, 758. DOI: 10.1021/ja067975p
<MPMP diol ester>
- Yan, J.; Jin, S.; Wang, B. Tetrahedron Lett. 2005, 46, 8503. doi:10.1016/j.tetlet.2005.10.010
<MIDA boronate>
- Gillis, E. P.; Burke, M. D. J. Am. Chem. Soc. 2007, 129, 6716. DOI: 10.1021/ja0716204
- Li, J.; Grillo, A. S; Burke, M. D. Acc. Chem. Res. 2015, 48, 2297. DOI:10.1021/acs.accounts.5b00128
<trifluoroborate>
- Vedejs, E.; Chapman, R. W.; Fields, S. C.; Lin, S.; Schrimpf, M. R. J. Org. Chem. 1995, 60, 3020. DOI: 10.1021/jo00115a016
- Darses, S.; Genet, J.-P. Chem. Rev. 2008, 108, 288. DOI: 10.1021/cr0509758
<cyclic triolborate>
- Yamamoto, Y.; Takizawa, M.; Yu, X.-Q,; Miyaura, N. Angew. Chem. Int. Ed. 2008, 47, 928. DOI:10.1002/anie.200704162
脱保护条件
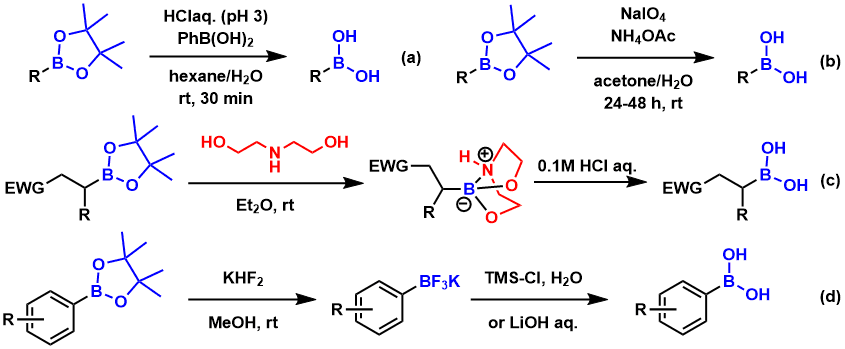
频哪醇酯的脱保护条件[1]: 比较稳定,一般的水解条件进行脱保护比较困难,经常需要酸性・加热条件双管齐下才能达成。生成的频哪醇再通过过碘酸钠分解,或者苯基硼酸捕捉等方法也经常被采用。另外先转换成三氟硼酸盐再转化成硼酸,或者先变成氨基酯型的硼酸盐再变成硼酸的方法比较温和,也是很常用的脱保护手法。具体请看下图所示实例。
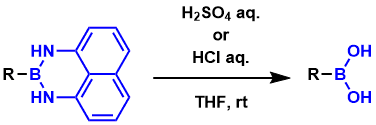
dan基的脱保护[2]:脱保护后拖去的二胺基萘通过酸性溶液萃取就可以很容易的除去。
MIDA酯的脱保护[3]:碱性水溶液下就能简便的脱保护。该保护基对其他条件都比较稳定。
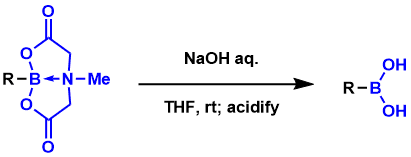
硼酸保护体的相互变换[4]
实验技巧
硼酸频哪醇酯在精制的时候,混有硼酸的硅胶柱可以提高分离效果[5]。
参考文献
- (a, b) Coutts, S. J.; Adams, J.; Krolikowski, D.; Show, R. J. Tetrahedron Lett. 1994, 35, 5109. doi:10.1016/S0040-4039(00)77040-7 (c) Sun, J.; Perfetti, J. S.; Santos, W. L. J. Org. Chem. 2011, 76, 3571. DOI: 10.1021/jo200250y (d) Yuen, A. K. L.; Hutton ,C. A. Tetrahedron Lett. 2005, 46, 7899. doi:10.1016/j.tetlet.2005.09.101
- Noguchi, H.; Hojo, K.; Suginome, M. J. Am. Chem. Soc. 2007, 129, 758. DOI: 10.1021/ja067975p
- Gillis, E. P.; Burke, M. D. J. Am. Chem. Soc. 2007, 129, 6716. DOI: 10.1021/ja0716204
- Churches, Q. I.; Hooper, J. F.; Hutton, C. A. J. Org. Chem. 2015, 80, 5428. DOI:10.1021/acs.joc.5b00182
- Hitosugi, S.; Tanimoto, D.; Nakanishi, W.; Isobe, H. Chem. Lett. 2012, 41, 972. doi:10.1246/cl.2012.972
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
















No comments yet.