概要
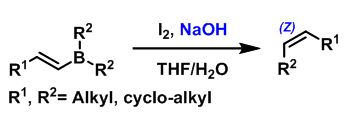
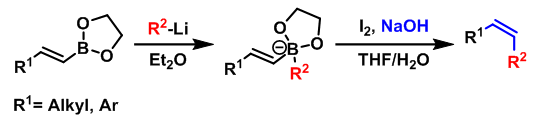
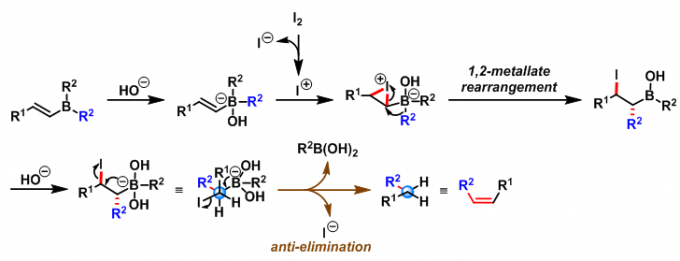
Zweifel 烯基化是在碱性条件下,烯基硼酸酯或烯基硼烷与碘作用形成烯烃的反应。该反应在1967年由美国California大学(Unicersity of California)的G. Zweifel课题组首次报道,反应具有高度的立体选择性,主要生成(Z)-烯烃[1]。(封面图)
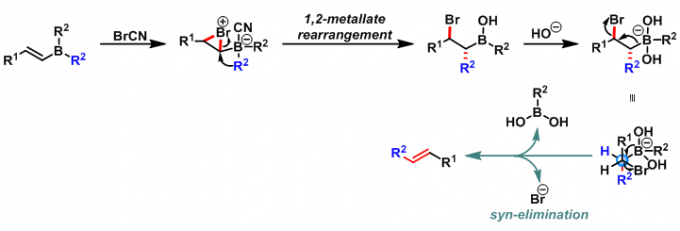
之后,该课题组在无碱存在的条件下,采用溴化氰进行反应,以高度立体选择性的方式获得(E)-烯烃[2]。同时,研究发现采用手性硼烷时,该反应同样具有高度的立体专一性[3]。
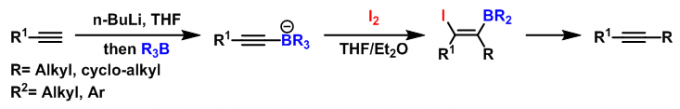
1973年,H. C. Brown将该反应条件应用于炔烃的合成[4]。
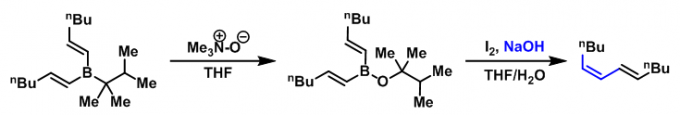
然而,在反应结束后,烯基硼烷的两个烷基中,只有一个烷基能够进入烯烃产物中,由此造成硼烷的浪费(尤其对于一些难以合成且价格昂贵的硼烷),有时还存在不同烷基间的竞争性迁移问题,从而降低烯烃的产率与反应的区域选择性。为解决这一问题,Zweifel采用三甲胺氧化物将而乙烯基硼烷氧化为硼酸酯(在空气中较为稳定),随后进行下一步的烯基化反应,成功地解决了之前采用具有低迁移性能的烷基取代的烯基硼烷时出现的竞争性迁移(烷氧基的迁移能力较低)及硼烷利用率低的问题[5]。
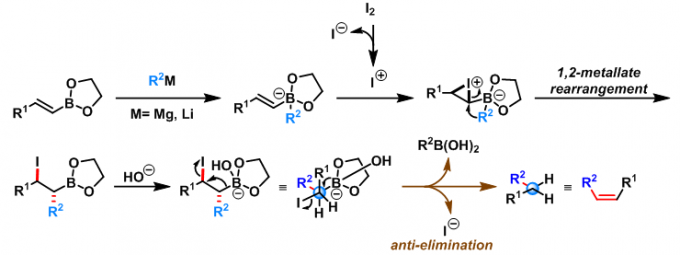
1976年,Evans与Mattesson 采用有机锂试剂与硼酸酯形成的酸根配合物,将硼酸酯的底物范围扩展至烯基硼酸酯与二级烷基硼酸酯[6]-[8]。
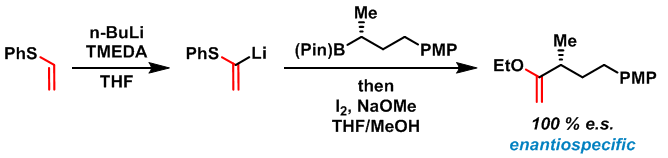
2016年,Aggarwal研究组采用类似条件,将硼酸酯的应用范围进一步扩展至具有杂原子的烯基硼酸酯,同时,使该反应具有高度的对映专一性[9]。
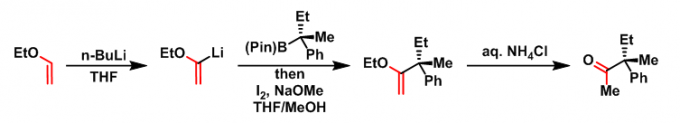
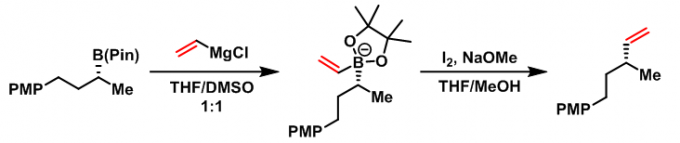
2017年,Aggarwal采用硼酸酯与Grignard试剂形成的酸根配合物,将硼酸酯的应用范围有效地扩展至一级、二级、三级烷基硼酸酯及芳基硼酸酯,同时,将该反应成功应用于大位阻烯烃的合成[10]- [13]。
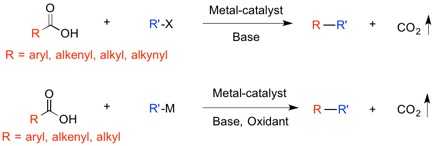
Zweifel 烯基化反应为Suzuki-Miyaura反应的强有力的补充[14],反应无需过渡金属催化剂参与,能够以高度对映专一性的方式实现光学纯度的二级、三级烷基硼酸酯与烯基金属化合物之间的偶联反应。
基本文献
- [1] G. Zweifel, H. Arzoumanian, C. C. Whitney, J. Am. Chem. Soc.1967, 89, 3652. doi: 10.1021/ja00990a061.
- [2] G. Zweifel, R. P. Fisher, J. T. Snow, C. C.Whitney, J. Am. Chem. Soc. 1971, 93, 6309. doi: 10.1021/ja00752a075.
- [3] G. Zweifel, R. P. Fisher, J. T. Snow, C. C. Whitney, J. Am. Chem. Soc. 1972, 94, 6560. doi: 10.1021/ja00773a059.
- [4] A. Suzuki, N. Miyaura, S. Abiko, M. Itoh, H. C. Brown, J. A. Sinclair, M.M. Midland, J. Am. Chem. Soc. 1973, 95, 3080. doi: 10.1021/ja00790a092.
- [5] G. Zweifel, N. L. Polston, C. C. Whitney, J. Am. Chem. Soc. 1968, 90, 6243. doi: 10.1021/ja01024a068.
- [6] D. S. Matteson, P. K. Jesthi, J. Organomet. Chem. 1976, 110, 25.doi: 10.1016/S0022-328X(00)90155-4.
- [7 D. A. Evans, R. C.Thomas, J. A. Walker, Tetrahedron Lett. 1976, 17, 1427. doi: 10.1016/S0040-4039(00)71274-3.
- [8] D. A. Evans, T. C. Crawford, R. C. Thomas, J. A. Walker, J. Org. Chem. 1976, 41, 3947. doi: 10.1021/jo00887a003.
- [9] Y. Wang, A. Noble, E. L. Myers, V. K. Aggarwal, Angew. Chem. Int. Ed. 2016, 55, 4270. doi: 10.1002/anie.201600599.
- [10] R. P. Sonawane, V. Jheengut, C. Rabalakos, R. Larouche-Gauthier, H. K. Scott, V. K. Aggarwal, Angew. Chem. Int. Ed. 2011, 50, 3760. doi: 10.1002/anie.201008067.
- [11] M. Shimizu, Angew. Chem. Int. Ed. 2011, 50, 5998. doi: 10.1002/anie.201407013.
- [12] A. B. Levy, S. J. Schwartz, N. Wilson, B. Christie, J. Organomet. Chem. 1978, 156, 123. doi: 10.1016/S0022-328X(00)84870-6.
- [13] R. J. Armstrong, W. Niwetmarin, V. K. Aggarwal, Org. Lett. 2017, 19, 2762. doi: 10.1021/acs.orglett.7b01124.
- [14] R. J. Armstrong, V. K. Aggarwal, Synthesis 2017, 49, 3323. doi: 10.1055/s-0036-1589046.
反应机理
反应实例
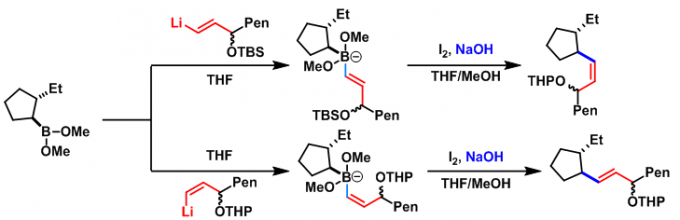
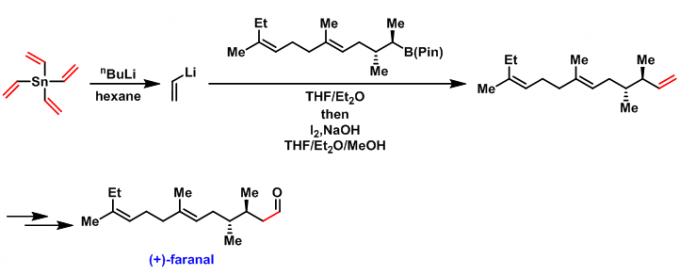
(+)-faranal的全合成[1]
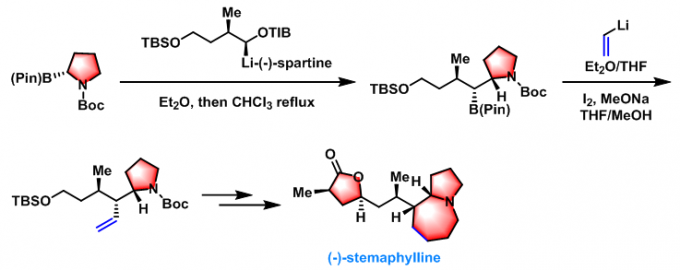
(-)-stemaphylline的全合成[2]
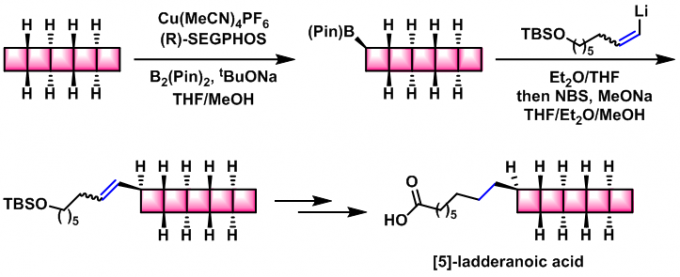
[5]-ladderanoic acid的全合成[3]实验步骤
(Z)-烯烃的合成: 在-10oC下,向原位制备的烯基硼烷(1 eq.)中加入6 M NaOH(3.6 eq.)溶液,随后用恒压滴液漏斗向上述反应混合物中缓慢滴加碘(1.3 eq.)的四氢呋喃溶液(2.5 M, 超过15 min滴加完毕)。再将上述反应液升至室温,直至反应完成。反应结束后,用硫代硫酸钠溶液除去过量的碘,再将上述反应混合物用戊烷进行萃取,合并的有机相采用无水硫酸钠进行干燥。蒸馏纯化后,获得相应目标产物。
(E)-烯烃的合成: ① 烯基硼烷的原位合成:在THF中加入烯烃(2 eq.)与BH3 (1.1 eq.),再将上述溶液中加入炔烃(1 eq.)的THF溶液(2.5 M), 并维持反应液温度在0-5oC之间。之后将上述反应混合物升至室温,并在室温下搅拌30min。②烯基化:在0oC下减压除去烯基硼烷中的THF溶剂,并维持0oC,同时加入二氯甲烷及溴化氰(1.3 eq.)的二氯甲烷(0.83 M)溶液,之后继续维持0oC,将上述反应液搅拌2 h,2 h后,加入6M NaOH溶液,将反应混合物进行稀释。烯烃产物采用戊烷进行萃取,粗产物通过短Vigreux分馏柱进行分馏纯化,获得相应目标产物。
实验实验安全须知
小编郑重提示:溴化氰有剧毒,反应结束后,加碱稀释获得(E)-烯烃的过程中,会产生剧毒的氰化物。反应需要在通风效果极为优良的通风橱内小心操作。反应后处理过程产生的废液及使用过的玻璃器皿均需要采用饱和次氯酸钠溶液进行无害化处理(加入碱将pH调至11,加入次氯酸钠饱和彻底搅拌后,静置过夜。1mol的氰化物需要加入500mL NaOCl饱和溶液),并用氰根试纸检测至氰离子含量(小于10-4 M)合格后,才可倒入指定废液缸。氰化物的处理过程同样需要在通风效果极为优良的通风橱内仔细操作。
参考文献
- [1] G. Dutheuil, M. P. Webster, P. A. Worthington, V. K. Aggarwal, Angew. Chem. Int. Ed. 2009, 48, 6317. doi: 10.1002/anie.200901194.
- [2] A. Varela, L. K. B. Garve, D. Leonori, V. K. Aggarwal, Angew. Chem. Int. Ed. 2017, 56, 2127. doi: 10.1002/anie.201611273.
- [3] J. A. M. Mercer, C. M. Cohen, S. R. Shuken, A. M. Wagner, M. W. Smith, F. R. Moss, M. D. Smith, R. Vahala, A. Gonzalez-Martinez, S. G. Boxer, N. Z. Burns, J. Am. Chem. Soc. 2016, 138, 15845.doi: 10.1021/jacs.6b10706.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!















No comments yet.