本文作者:杉杉
导读
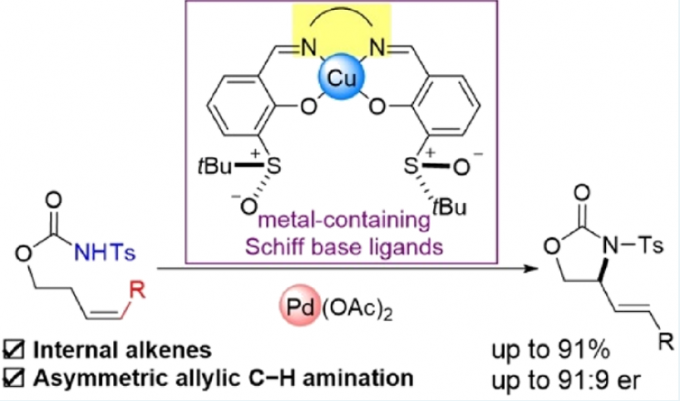
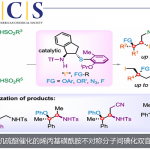
近日,北海道大学Tatsuhiko Yoshino和Shigeki Matsunaga课题组合作在ACS Catal.上发表论文,报道了一种新型手性配体(含金属席夫碱/亚砜),该配体可调节Pd(II)催化剂的选择性和反应性,从而实现分子内不对称烯丙基C-H胺化反应。同时,内部和末端烯烃均为良好的底物,可获得高达91:9 er的C-H胺化产物。
Metal-Containing Schiff Base/Sulfoxide Ligands for Pd(II)-Catalyzed Asymmetric Allylic C−H Aminations
Youka Bunno, Yuta Tsukimawashi, Masahiro Kojima, Tatsuhiko Yoshino,* and Shigeki Matsunaga*
正文
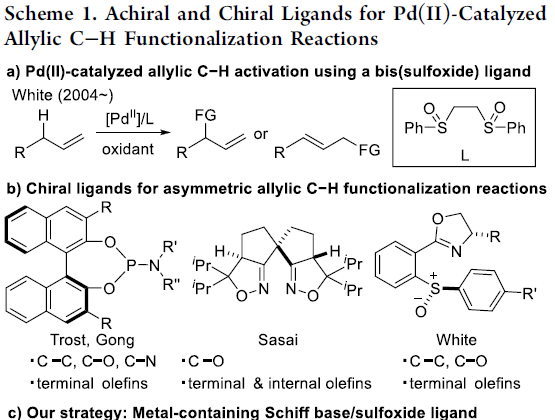
钯催化烯丙基C-H功能化反应,作为合成亲电性π-烯丙基化合物的有效策略,可避免典型Tsuji-Trost反应中所需的卤化物、酯或碳酸盐等离去基团。2004年,White等[1]使用双亚砜配体实现Pd催化烯丙基C-H键的活化,并与多种亲核试剂反应,从而增加了产物的复杂性(Scheme 1a)。此外,手性亚磷酰胺配体常与Pd催化剂相结合,从而实现相应的不对称催化反应(Scheme 1b)。然而,在大多数情况下,底物范围限于活化的烯丙基化合物,如烯丙基芳烃、1,4-二烯或烯丙基酯。Sasai等[2] 使用了手性双(异恶唑啉)配体,实现了烯丙基C-H活化反应,但反应范围仅限于不对称C-O键的形成。此后,White等通过引入一个额外的σ供体配位,从而使手性亚砜-恶唑啉配体表现出优异的对映选择性(Scheme 1b)。尽管如此,可用于Pd催化不对称烯丙基C-H功能化反应的手性配体仍然有限,仍需开发新型手性配体以扩大反应的范围。
受早期报道关于手性Cr-salen配合物和非手性Pd-双(亚砜)配合物使用的启发[3],作者设想,是否可通过一种含手性金属席夫碱/亚砜的配体,可实现Pd催化不对称烯丙基C-H功能化反应。对于含有金属席夫碱/亚砜配体(L-M1)的合成,可通过含有手性亚砜单元的水杨醛与手性胺缩合,形成双核席夫碱配体(L),再将各种金属M1引入内部从而合成含金属席夫碱/亚砜配体(L-M1)(Scheme 1c)。值得注意的是,通过简单地改变手性胺和M1来源,可在L-M1的亚砜单元周围构建各种手性环境。在此,作者开始对Pd(II)/L-M1催化不对称烯丙基C-H胺化反应进行了研究(Scheme 1d)。
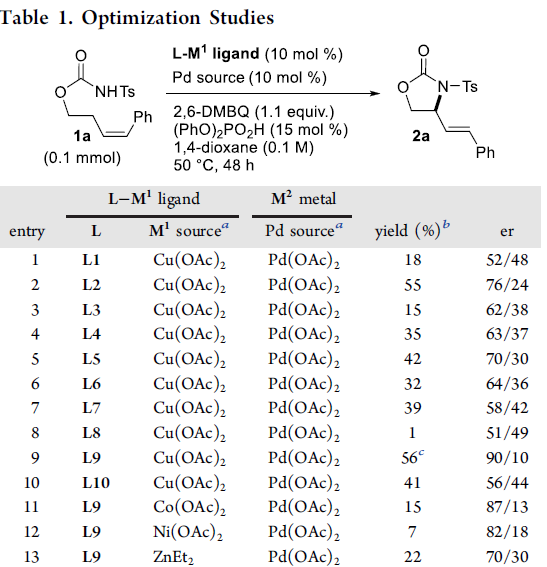
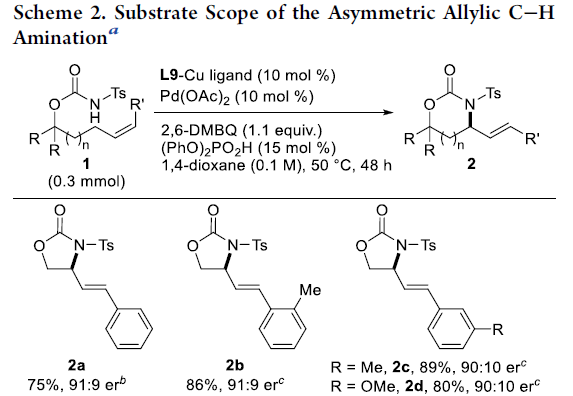
首先,作者以Ts保护的氨基甲酸酯1a作为模型底物,进行了相关不对称烯丙基C-H胺化反应条件的筛选(Table 1, Figure 1)。反应的最佳条件为:以10 mol%的Pd(OAc)2为催化剂,10 mol%的L9-Cu为配体,同时加入1.1当量的2,6-二甲基苯醌(2,6-DMBQ)和15 mol%的(PhO)2PO2H,可在1,4-二氧六环溶剂中50 °C反应,即可获得75%收率和91:9 er的产物2a。
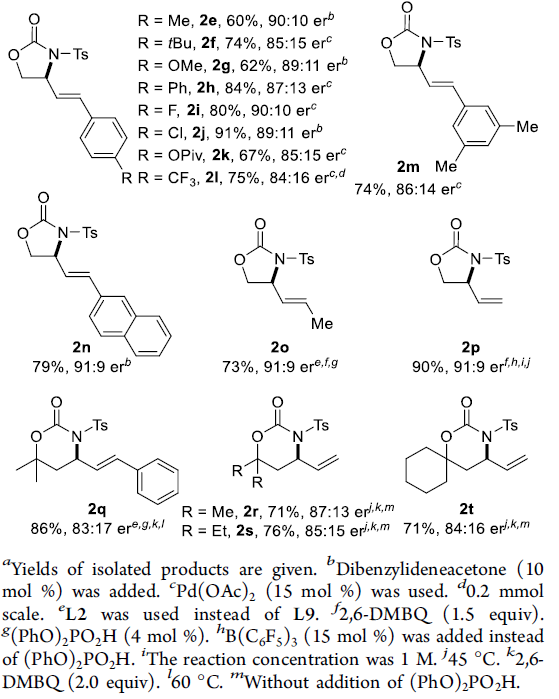
在获得上述最佳反应条件后,作者开始对底物1进行了扩展(Scheme 2)。底物中芳基取代不受电子效应和定位效应的影响,均可顺利反应,获得中等至良好er的产物2a–2m。值得注意的是,对于甲基取代的内烯烃1o,配体L2-Cu比L9-Cu更有效。同时,使用B(C6F5)3作为添加剂,末端烯烃1p也能顺利反应,以90%的收率和91:9的er获得产物2p。此外,在对反应条件进行稍微优化后,具有六元环的底物,也与体系兼容,获得相应的产物2q–2t。
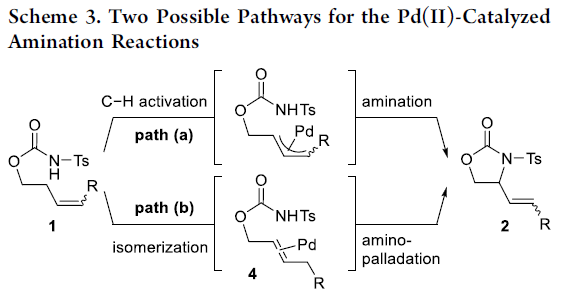
随后,作者提出了两种分子内烯丙基C-H胺化反应的可能途径(Scheme 3)。在path a中,涉及烯丙基C-H活化、胺化途径。在path b中,涉及将1异构化为4,然后进行氨基钯加成/β-H消除的过程。
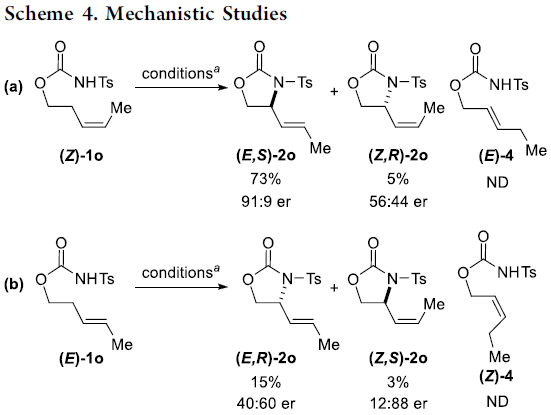
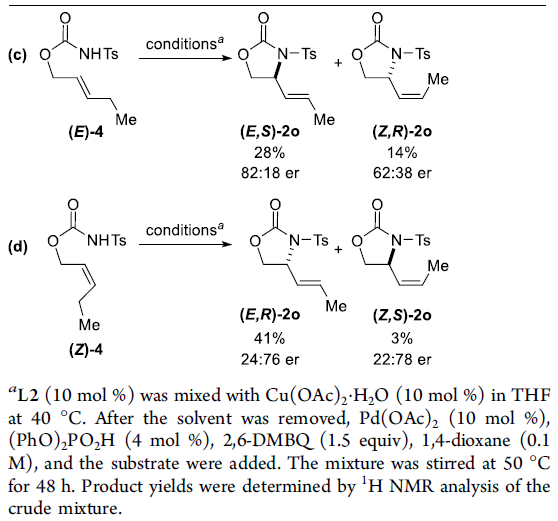
为了进一步了解反应的机理,作者进行了相关的对照实验(Scheme 4)。首先,(Z)-1o在标准条件下反应获得73%收率的主产物(E,S)-2o(Scheme 4a),而(E)-1o在标准条件下获得较差收率和对映选择性的主产物 (E,R)-2o(Scheme 4b),从而表明底物1的几何构型对于反应的收率和对映选择性至关重要。其次,当以(E)-4为底物时,在标准条件下获得28%收率和82:18 er的(E,S)-2o,以及14%收率和62:38 er的(Z,R)-2o(Scheme 4c)。当使用(Z)-4为底物时,在标准条件下获得41%收率和24:76 er的(E,R)-2o,以及3%收率和22:78 er的(Z,S)-2o(Scheme 4d)。这些结果表明,Scheme 3中的Path a更为合理。而在Path b中的异构化、氨基钯加成/β-H消除的过程,对照实验并未发现(Z)-1o选择性异构化为(E)-4。同时,(E)-4底物的对映体比率和E/Z选择性低于(Z)-1o底物,并且(E)-4的反应性比(Z)-1o低得多,在(Z)-1o的反应中也未观察到(E)-4。
总结
北海道大学Tatsuhiko Yoshino和Shigeki Matsunaga课题组合作报道了一种新型含金属席夫碱/亚砜的手性配体,可用于Pd(II)催化不对称烯丙基C-H胺化反应。同时,内部和末端烯烃均为良好的底物,可获得高达91:9 er的C-H胺化产物。此外,机理研究表明,反应涉及烯丙基C-H活化、胺化的途径。





















No comments yet.