本文投稿作者 alberto-caeiro
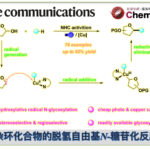
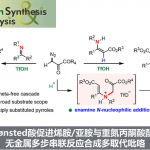
普林斯顿大学Robert Knowles课题组在去年成功开发出光催化的质子偶联电子转移(proton-coupled electron transfer/PCET)体系实现N-烷基酰胺N-H键的均裂反应。这种生成的酰胺基N-自由基再经过氢原子转移体系(hydrogen atom transfer/HAT)可攫取远程不活泼的C(sp3)-H键上的H原子,发生1,5-氢迁移,再发生烷基化,形成最终的产物。
“Catalytic alkylation of remote C–H bonds enabled by proton-coupled electron transfer
Choi, G. J.; Zhu, Q.; Miller, D. C.; Gu, C. J.; Knowles, R. R.* Nature, 2016, 539, 268. DOI:10.1038/nature19811
解决的问题和方法
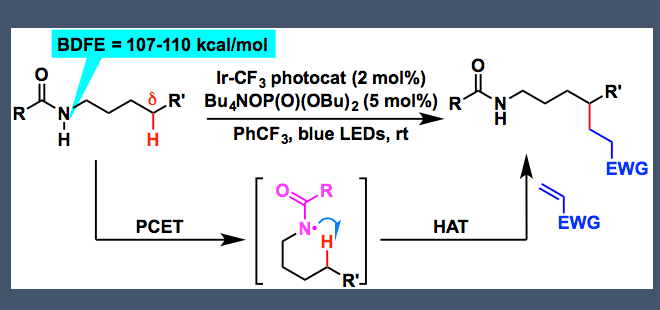
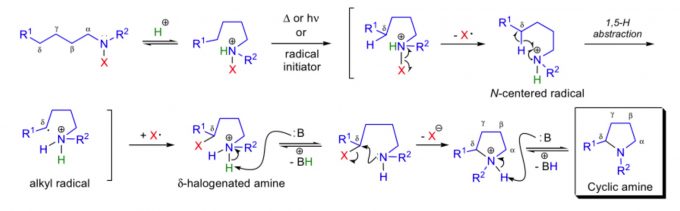
因为N-烷基酰胺N-H键的解离能非常的高,达107-110kcal/mol,因此由N-H键均裂生成的酰胺基N-自由基可以作为HAT反应的活性前体,催化生成烷基自由基。然而,过去并没有关于N-H键选择性均裂反应的工作。而只有在Hofmann-Löffler-Freytag反应中,有过类似的反应。质子化后的饱和卤代烷基胺经光照或加热活化后,生成N-自由基,发生1,5-氢迁移后,自由基与卤原子结合,生成氨基δ位的卤代烷烃,再经分子内的亲核取代生成最终5元环胺。作者受之前卤代烷基胺工作的启发,经PCET成功实现N-H均裂生成自由基,并且改进之前反应的不足,只能使用卤代烷基胺作为底物形成分子内烷基胺,成功实现了新C-C键的构建。
在本篇工作中,作者通过Ir光催化剂和作为碱的磷酸酯,在蓝色LED灯照射下,实现了上述反应。
反应机理
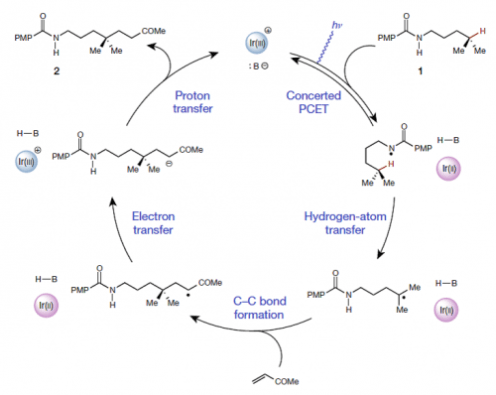
底物酰胺基N上的H先与磷酸酯形成氢键,激发态的Ir(Ⅲ)催化剂氧化N-H键,使其发生均裂,形成N-自由基,即PCET催化过程。这在作者以前的工作中有过报道[1, 2]。接着发生1,5-氢迁移,生成烷基自由基。烷基自由基再与连有吸电子基团的烯烃发生反应,在α羰基自由基,后氧化Ir(Ⅱ)形成烯醇负离子和激发态的Ir(Ⅲ),烯醇负离子夺取磷酸酯上的氢,形成最终产物,并得到磷酸酯,开启下一个催化循环。
反应的有效验证
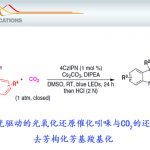
- 反应条件优化
碱基仍采用以往工作中报道的NBu4OP(O)(OBu)2[1],而光催化剂则选用具有高度缺电子结构的Ir-CF3。
- 底物范围
除了可生成较为稳定的3级自由基的次甲基,亚甲基也可以发生此类反应,并且对于有两个化学环境类似次甲基的底物,反应也有不错的选择性。C-H键α位有杂原子的反应也能顺利进行。反应对攫氢的位置也有精准的把控,几乎全部都只发生1,5-氢迁移。遗憾的是,在用丙烯酸酯和丙烯酸酰胺进行反应时,只能得到痕量的产物。作者认为,其α羰基自由基的还原电势太低(E 1/2 =−1.37 V versus Fc/Fc + ),不能氧化Ir(Ⅱ)( E 1/2 =-1.07 V versus Fc/Fc + ),故选用二羰基化合物发生反应。而其产物可以通过脱CO2,得到与丙烯酸酯反应的产物。在60℃条件下,分子间的攫氢反应也可以顺利进行。
推荐阅读文章
在本期杂志中,本篇工作的后面,紧接着Tom Rovis也报道了类似反应体系[3],并在底物拓展中做了类似的工作。
在Tom Rovis的报道中,从机理(Ir(Ⅲ)催化生成自由基,后自由基转移,接着形成C-C键),催化剂(带有强吸电子基团的Ir(Ⅲ)催化剂),到磷酸酯作为碱,工作思路几近相同。但在底物酰胺的选择上有所不同,此处选用的是三氟甲基,前者为芳香基,但都为吸电子基团。在底物拓展的方向相同,只是思考方式有所不同。除此之外,接受、出版的时间也完全一样。在此,只能感叹两者神奇的进度和工作思路了。
参考文献
- Choi, G. J.; Knowles, R. R. Am. Chem. Soc. 2015, 137, 9226. DOI: 10.1021/jacs.5b05377
- Miller, D. C.; Choi, G. J.; Orbe, H. S.; Knowles, R. R. Am. Chem. Soc. 2015, 137, 13492. DOI:10.1021/jacs.5b09671
- Chu, J. C. K.; Rovis, T. Nature 2016, 539, 272. doi:10.1038/nature19810
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.