本文作者:石油醚
概述
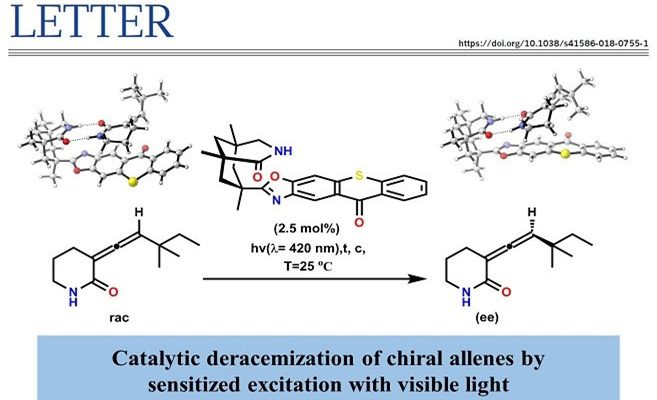
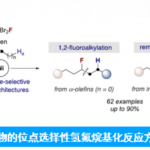
手性化合物以对映异构体的形式存在,彼此互不重叠。由于对映体纯的手性化合物的重要性(例如,作为活性药物成分),广泛进行了外消旋物(对映体的1:1混合物)的分离。但是,通常只需要手性化合物的单一对映体形式,外消旋体如何选择性地转化为单一对映体就是现在面临的问题。近日,慕尼黑工业大学Thorsten Bach教授课题组开发了在可见光照射下,以催化量(2.5 mol%)的手性催化剂可以使得联烯化物高对应选择性去外消旋化。通过该法,作者将17种手性外消旋异戊烯转化为各自的单个对映体,ee值 89%至97%
Nature , 2018, 564, 240–243 DOI: 10.1038/s41586-018-0755-1
Catalytic deracemization of chiral allenes by sensitized excitation with visible light
Hölzl-Hobmeier, A., Bauer, A., Silva, A. V., Huber, S. M., Bannwarth, C. & Bach, T.
Nature (2018) 564, 240-243, doi:10.1038/s41586-018-0755-1.
正文
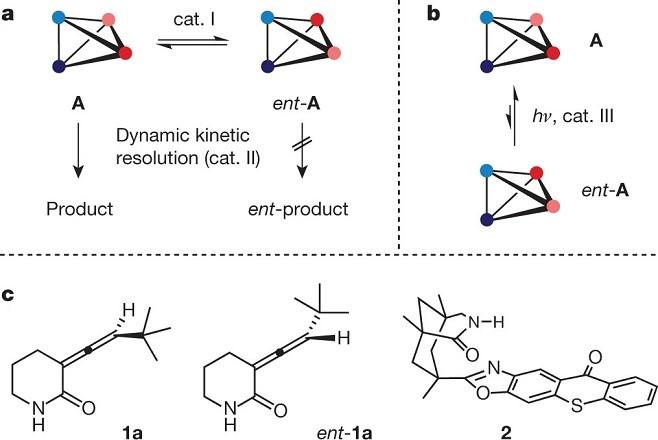
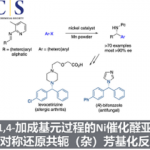
由于对映异构体能量的简并性,不能通过手性或非手性催化剂建立对映体A或对映体A占优势的平衡(Fig. 1a)。但是,对于两步工艺而言有很多先例,其中两种对映异构体保持在50:50的平衡状态,并且其中一种对映体在手性催化剂(Cat.II)的存在下于第二种酶催化中反应(动力学拆分)。尽管在热力学上是不可能的,但在存在手性催化剂(Cat.III)通过光催化的条件下有利于一种对映异构体A或ent–A的光化学平衡的实现(Fig. 1b)。该领域的先前工作主要致力于单重态能量转移在平面手性烯烃中的(E)-双键异构化。但是,该方法涉及异构体非手性(Z)-烯烃,另一种情况下,可以通过从手性光敏剂转移三重态能量,将仅以对映异构体A和ent-A基态形式存在的化合物。目前,已知的具有手性轴的丙二烯(1,2-丙二烯)在光催化条件下三重态敏化激发会发生构型转换。已经报道的光催化联烯去对称化反应存在副产物过多,超计量的光敏剂以及很低的对映选择性等方面的问题。Thorsten Bach教授课题组开发了在可见光照射下,以催化量(2.5 mol%)的手性噻吨酮催化剂可以使得内酰胺联烯化物1a与ent–1a高对映选择性的去外消旋化,获得手性的联烯化物(Fig. 1c)。(手性噻吨酮的三重态能量为263 kJ mol-1(±3 kJ mol-1))。
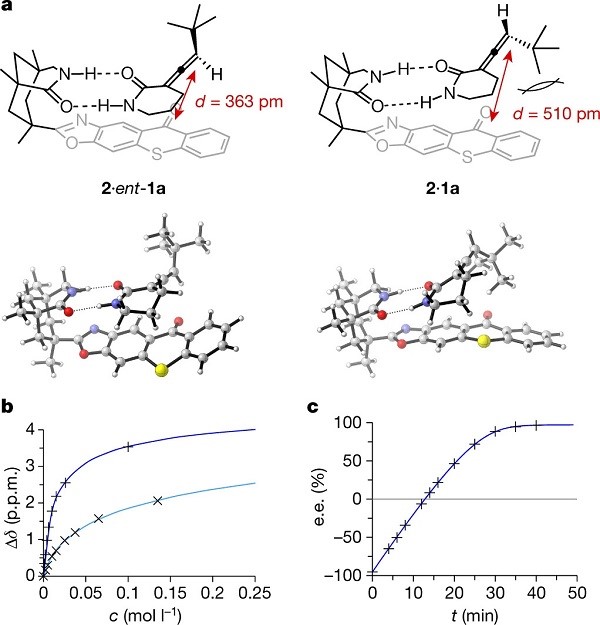
Figure 1手性化合物A与ent-A和 化合物1,ent-1a和2的结构
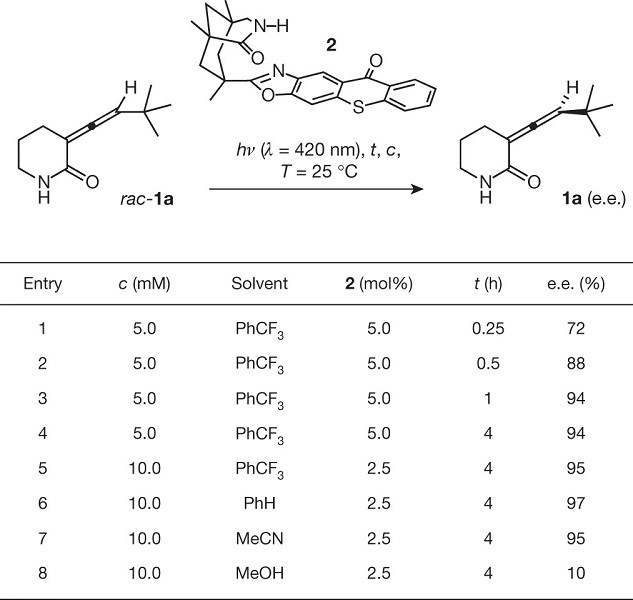
由于联烯1a未显示任何可检测的磷光,因此无法确定该化合物的三重态能量。然而,先前关于母体联烯的研究表明,联烯的三重态可以通光催化获得。室温下,在三氟甲苯中对rac-1a(1a / ent-1a = 50/50,0%ee)外消旋混合物和5 mol%的光敏剂2在λ= 420 nm的波长下进行初始光照实验(Fig.2)。通过初步的筛选发现了一个快速且几乎完全的去外消旋化作用的条件(entries 1–4 in Fig. 2),一小时后达到了最优(entry 3)。然而进一步的光照并没有提高对映选择性(entry 4)。经过优化后,发现底物浓度为10 mM,催化剂用量为2.5 mol%,是在低催化剂用量下实现几乎完全去外消旋化的理想方法(entry 5)以及在极性较小的溶剂苯中,对映选择性更高(entry 6)。但由于苯熔点高,无法在较低的温度下进行反应。令人惊讶的发现是乙腈中也可以同样高对映选择性的发生反应(entry 7)。而在完全排除1a和2之间的氢键的溶剂中,去外消旋化反应不成功(entry 8)。
Figure 2 条件筛选
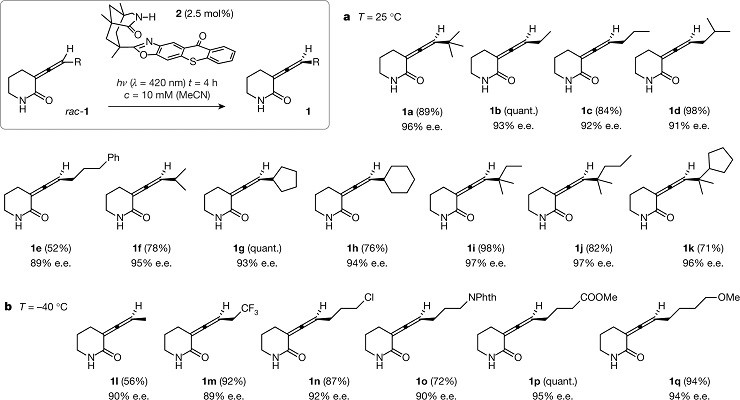
上述获得最优条件后,作者进行的底物拓展以及通过圆二色性光谱确定了主要对映体的绝对构型(该光谱数据与计算的1a光谱相匹配以及该化合物是左旋并在λ= 230 nm处表现出负的Cotton效应。)在室内温度下,将其他外消旋联烯rac-1置于优化的反应条件(Fig.2 entry 7)。在最优条件下,联烯化合物的碳原子上带有伯,仲或叔烷基的始终具有很高的对映选择性(91%-97% e.e .;产物1a–1d,1f–1k)和收率(71%-98%)并且在某些情况下可以定量分离手性联烯。在所施加的光照条件下,3-苯基丙基取代的亚1e是不稳定,导致较低的产率和对映选择性略微降低。而反应温度降低-40oC会导致对映选择性增加,并将此温度用于敏感的甲基取代的联烯1l和一些官能化的联烯1m-1q。例如,以87%的收率和92%的e.e.分离得到3-氯丙基取代的联烯1n。(Fig.3)
Figure 3 底物拓展
底物拓展的结果很优异,作者进行了更深层次的研究。与先前的工作一致,研究表明如果在不存在光敏剂和以λ= 420 nm照射下联烯构型很稳定。因此,观察到的去外消旋化作用似乎与能量从光激发到噻吨酮然后转移到联烯的两种对映体形式有关。这种能量转移可以在噻吨酮2与联烯的复合物中发生在分子间或分子内,并且1a和ent-1a之间的相互转化通过平面三重态的中间体进行。在Fig.4a中,显示出联烯1a和ent-1a的两种复合物的优化结构(密度泛函理论(DFT)计算中获得)。最值得注意的是,对于两种非对映体复合物而言联烯双键至发色团的距离差异很大。在复合物2•ent-1a中,噻吨酮的羰基碳原子与联烯末端内环碳原子之间的距离为363 pm,在络合物2•1a中为510 pm。通过核磁共振滴定法与DFT计算获得:1)在C6D6溶液中复合物的缔合常数(Fig.4b);2)ent-1a与光敏剂的结合(缔合常数Ka = 84±6 M-1)比其对映异构体1a(Ka = 18±2 M-1)强得多。
DFT计算和核磁共振滴定法获得的数据,作者认为观察到的去外消旋化反应是对映体ent-1a和1a对催化剂的缔合常数(基态热力学)不同以及光催化效率(激发的状态动力学)等有关。三重态中间体的能量转移与距离密切相关,在复合物2•ent-1a中,光敏剂与底物之间的距离导致快速定量的三重态能量的转移。然而,与ent-1a相比,化合物1a与光敏剂的结合度较低且能量供体与受体之间的距离增大,因此通过分子内光敏化合物1a机理是不可取的。
Figure 4基于DFT计算,缔合常数和量子产率对机研究
总结
总而言之,Thorsten Bach教授课题组开发了在可见光照射下,以催化量(2.5 mol%)的手性噻吨酮催化剂可以使得内酰胺联烯化物1a与ent-1a高对映选择性的去外消旋化,获得手性的联烯化物的方法。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.