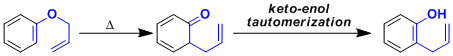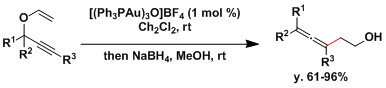- 概要
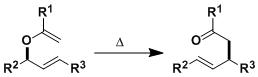
从烯丙基乙烯基醚出发进行[3,3]-σ键迁移生成γ,δ-不饱和羰基化合物的反应。
该反应的底物是Cope重排中的碳原子换成氧原子而进行的重排反应。Cope重排反应通常为可逆反应,而Claisen重排生成了相比于原料而言热力学更稳定的产物,所以是不可逆反应。
重排的时候氧原子的手性保持不变。手性的异丙醇利用Sharpless不对称环氧化,CBS还原等反应比较容易得到。随后通过Claisen重排,形成碳-碳键,可以有效的合成比较困难的不对称季碳中心以及远位的不对称中心。
该反应也能结合芳香环的π键进行。这也是取代芳香醇的合成手法之一。
- 基本文献
・Claisen, L. Ber. 1912, 45, 3157.
・Claisen, L.; Eisleb, O. Ann. 1914, 401, 21.
・Claisen, L.; Tietze, E. Ber. 1925, 58, 275.
・Claisen, L.; Tietze, E. Ber. 1926, 59, 2344.
・Tarbell, D. S. Org. React. 1944, 2, 1.
・Rhoads, S. A.; Raulins, N. A. Org. React. 1975, 22, 1.
・Ziegler, F. E.Chem. Rev. 1988, 88, 1423. DOI: 10.1021/cr00090a001
・Wipf, P. Comprehensive Organic Synthesis 1991, 5, 827.
・Castro, A. M. M. Chem. Rev. 2004, 104, 2939. DOI: 10.1021/cr020703u
- 反应机理
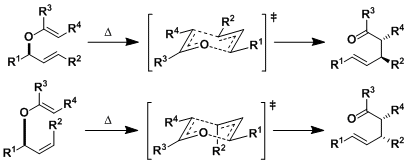
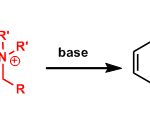
该反应机理是热力学控制的σ[3,3]重排(协同的)。中间体迁移状态是1,3-diaxial排斥最小的六圆环椅式结构。只要没有别的其他原因,其立体选择性可以依照如下所示进行解释。
- 反应实例
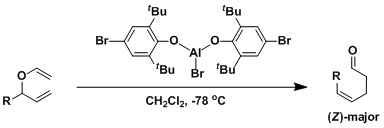
通过添加对氧亲和性高的Lewis酸,在低温条件(速度论支配)下可以进行Claisen重排反应。如果使用立体位阻大的配体的话,也可以得到热力学不稳定的Z-Claisen重排产物[1]。
在最近几年,金催化剂表现出的一些特有的特性被逐渐阐明。有报告表明,Au(I)催化剂可以促进丙炔-Claisen重排反应的进行[2]。
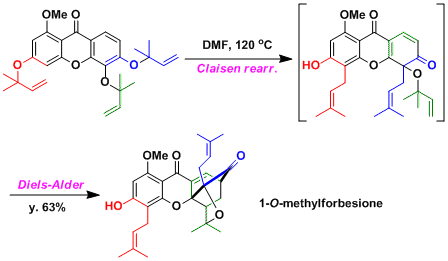
1-O-methylforbesione的Biomimetic合成[3]
- 实验步骤
- 实验技巧
- 参考文献
[2] Sherry, B. D.; Toste, F. D. J. Am. Chem. Soc. 2004, 126, 15978. DOI: 10.1021/ja044602k
[3] Nicolaou, K. C.; Li, J. Angew. Chem. Int. Ed. 2001, 40, 4264. [abstract]