本文作者:石油醚
导读
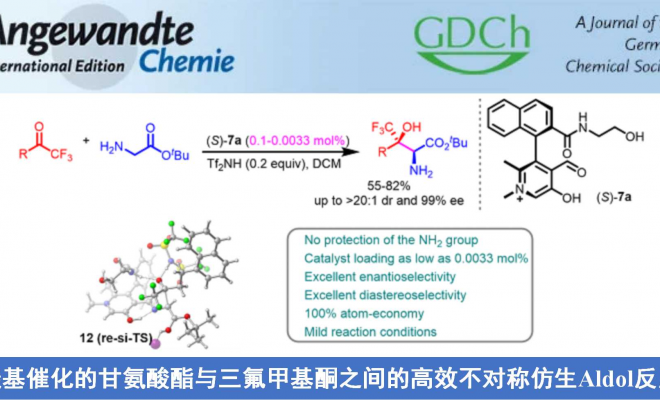
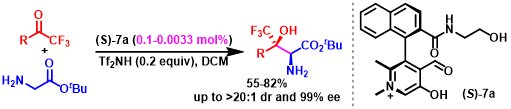
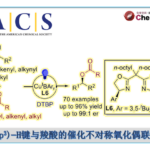
光学活性的β-羟基-α-氨基酸及其衍生物是一类具有高度生物活性的重要化合物,广泛存在于多种天然产物与药物分子中。采用甘氨酸酯进行的不对称Aldol反应方法学是制备手性β-羟基-α-氨基酸衍生物的一种较为直接的路线。然而,由于甘氨酸分子中具有反应活性的NH2基团难以与常规的反应条件良好地兼容,因此,实现上述的合成转化具有较多的挑战。受到酶催化的采用甘氨酸参与的Aldol反应研究的启发,上海师范大学赵宝国教授课题组采用0.1-0.0033 mol%的手性N-甲基吡哆醛 (chiral N-methyl pyridoxal)7a作为催化剂,在极为温和的反应条件下,成功开发出通过采用甘氨酸酯5与三氟甲基酮4之间的不对称Aldol反应方法学策略,并以55-82%的反应收率 (syn-diastereomers)与>20:1dr以及99% ee,合成出一系列手性β-三氟甲基-β-羟基-α-氨基酸酯6类化合物。该策略通过与酶催化的甘氨酸参与的Aldol反应相类似的催化循环途径进行,其中,手性吡哆醛催化剂7a能够同时活化两种反应底物,并将两种底物按照特定的空间取向进行组装,进而实现较高的催化效率、优良的非对映选择性与对映选择性。
Efficient Asymmetric Biomimetic Aldol Reaction of Glycinates and Trifluoromethyl Ketones by Carbonyl Catalysis
A.Cheng, L.Zhang, Q. Zhou, T. Liu, J. Cao, G. Zhao, K. Zhang, G. Song, B. Zhao,
Angew. Chem. Int. Ed. 2021, Early View. doi: 10.1002/anie.202104031.
正文
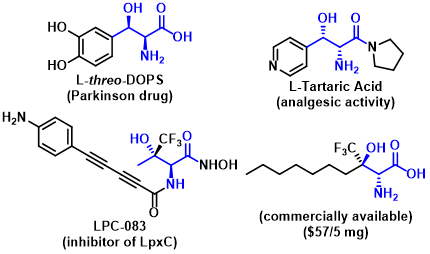
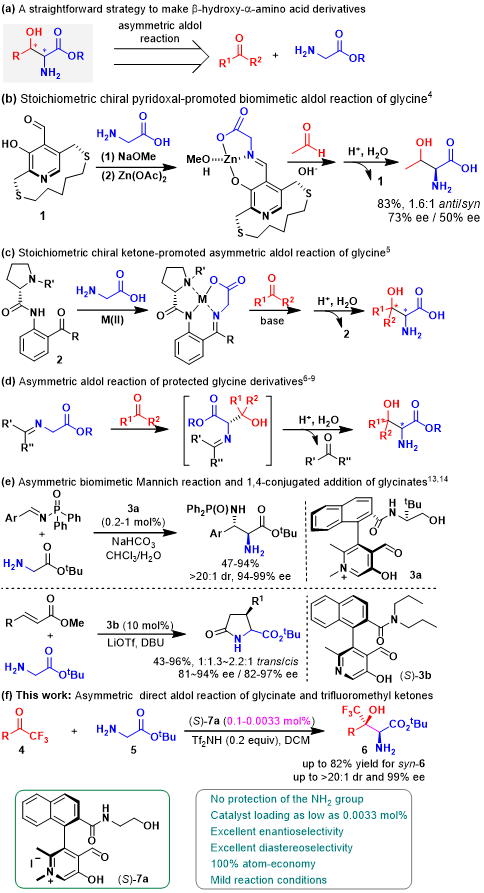
光学活性的β-羟基-α-氨基酸是一类具有高度生物活性的重要化合物,广泛存在于多种天然产物与药物分子中。例如,用于治疗Parkinson症的药物L-threo-DOPS[1] [Figure1a,b]以及候选药物[2](2R,3S)-2-氨基-3-羟基-3-(吡啶-4-基)-1-(吡咯烷-1-基)丙-1-酮 [Figure1c]。通过甘氨酸酯与醛或酮之间的不对称Aldol反应方法学,能够提供一种较为便捷并极具吸引力的路线,进而高效构建手性β-羟基-α-氨基酸衍生物 (Scheme 1a)。然而,甘氨酸酯中的NH2基团由于其较好的亲核性与N-H酸性,在反应过程中容易受到破坏。为解决NH2基团兼容性的问题,保护基策略已经广泛应用与上述转化过程。例如,1) Kuzahara与 Breslow采用化学计量手性吡哆醛催化相应甘氨酸的仿生Aldol反应[3,4] (Scheme 1b);2) Belokon[5]与Soloshonk[6]选择甘氨酸 Schiff 碱-金属配合物参与不对称Aldol反应过程 (Scheme 1c);3) Hayashi[7]、Miller[8]与Trost[9]等研究团队开发出采用二苯亚甲基保护的甘氨酸衍生物参与相应的不对称Aldol反应 (Scheme 1d);4) 采用吡哆醛依赖性醛缩酶 (pyridoxal-dependent aldolases),例如,如苏氨酸醛缩酶 (threonine aldolases)促进具有游离氨基的甘氨酸参与相关的不对称Aldol反应[10],直接构建一系列手性β-羟基-α-氨基酸。然而,对于非酶反应体系,通过直接采用甘氨酸进行相应的不对称Aldol反应仍然存在较大的挑战。
Figure 1具有β-羟基-α-氨基酸结构的药物分子
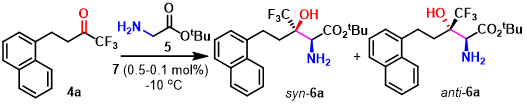
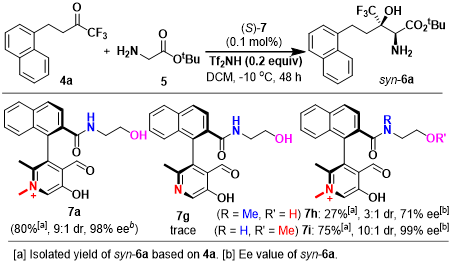
受到苏氨酸醛缩酶 (threonine aldolases)促进甘氨酸与醛发生Aldol反应的启发,上海师范大学赵宝国教授课题组基于辅酶 (coenzyme)Vitamin B6的相关结构,设计出一系列新型的手性吡哆醛/吡哆胺 (pyridoxal/pyridoxamine)催化体系,并顺利实现了一系列α-酮酸的仿生转氨化 (biomimetic transamination)反应 (Org. Lett. 2015, 17, 5784;Org. Lett. 2016, 18, 3658;J. Am. Chem. Soc. 2016, 138, 10730.),同时,该小组成功开发出采用手性吡哆醛作为催化剂的仿生羰基催化反应方法学 (Science. 2018, 360, 1438; Angew. Chem. Int. Ed. 2021, 60, 10588)。而且,在模拟酶催化过程的研究中,作者设想,通过羰基催化策略 (carbonyl catalysis strategy)可能为化学催化的甘氨酸参与的不对称Aldol反应的发展,提供一种潜在的可能性。通过选择手性吡哆醛作为催化剂,本课题组已经成功开发出相关的不对称仿生Mannich反应方法学 (Science. 2018, 360, 1438)以及甘氨酸酯α-C的Michael加成(Angew. Chem. Int. Ed. 2021, 60, 10588)反应方法学,并分别获得具有优良对映纯度的手性α,β-二氨基酸酯与手性焦谷氨酸酯 (pyroglutamic acid ester)产物 (Scheme 1e)。近日,赵宝国小组采用0.1-0.0033 mol%的手性N-甲基吡哆醛7a作为催化剂,成功开发出甘氨酸酯5与三氟甲基酮4之间的催化不对称Aldol反应方法学,并以55-82%收率、 >20:1dr以及99% ee,制备出一系列手性β-三氟甲基-β-羟基-α-氨基酸酯6。与类似的酶促转化 (enzymatic transformations)反应方法学相比,该反应策略表现出与之相当甚至更高的立体选择性 (>20:1 dr以及99% ee)与催化活性 (催化剂用量低至0.0033 mol%) (Scheme1c)。
Scheme 1 β-羟基-α-氨基酸的合成策略
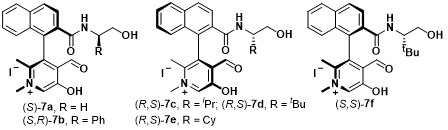
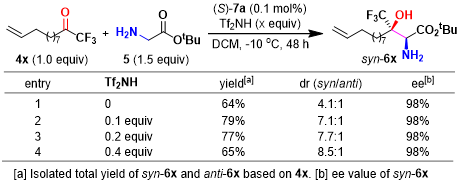
首先,作者采用三氟甲基酮4与甘氨酸叔丁酯5作为模板底物,进行了相关反应条件的优化筛选。研究表明,在0.5 mol %手性吡哆醛(S)-7a (作为羰基催化剂)存在下,反应能够顺利进行,并以68%的反应收率获得β-三氟甲基-β-羟基-α-氨基酸酯产物6a (4:1 syn/anti),其中syn–6a的对映选择性为96% ee (Entry 1, 其中,syn-6a与anti–6的绝对构型通过 X-射线晶体学分析确定)。同时,吡哆醛催化剂的存在对于反应过程的顺利进行尤为重要,在无吡哆醛催化剂存在的条件下,无法获得预期的目标产物 (Entry 2)。并且,作者发现,在上述反应体系中加入HOAc等酸性添加剂时,能够使反应收率 (68% vs 85%)与非对映选择性 (7:1 dr)显著提高 (Entry 3)。接下来,作者通过对反应条件的进一步筛选表明,当加入 0.2 equiv的 Tf2NH 时,能够获得80%反应收率、9:1 dr以及98% ee的非对映异构体syn–6a (Entry 10 vs. 3-9)。同时,作者发现,选择DCM作为反应溶剂 (Entry 11 vs 3 and 12-15),并采用催化剂7a,能够获得最佳的实验结果 (Entry 11 vs 16-20)。令人惊喜的是,将催化剂用量降低至 0.1 mol%时,反应同样能够顺利进行,并且,不影响反应过程的催化效率与选择性 (Entry 21 vs. 10)。综上所述。作者通过大量的条件筛选,最终,确定最佳的反应条件为:采用4 (1.0mmol),5 (1.5 mmol),(S)–7a (0.1 mol%),Tf2NH (0.2 mmol),DCM (4.0 mL)作为反应溶剂, 反应温度为-10°C的条件下,能够以80%的反应收率,9:1 dr以及98% ee获得相应的目标产物 (Entry21)。
| entry | catalyst | additive | solvent | yield (%) | syn/anti | ee (%) |
| 1 | (S)-7a | – | DCE | 68 | 4:1 | 96 |
| 2 | none | – | DCE | 0 | – | – |
| 3 | (S)-7a | AcOH | DCE | 85 | 7:1 | 96 |
| 4 | (S)-7a | PhCO2H | DCE | 87 | 7:1 | 92 |
| 5 | (S)-7a | PhOH | DCE | 68 | 4:1 | 93 |
| 6 | (S)-7a | CF3CO2H | DCE | 73 | 7:1 | 96 |
| 7 | (S)-7a | TfOH | DCE | 42 | 7:1 | 95 |
| 8 | (S)-7a | TsOH | DCE | 67 | 9:1 | 96 |
| 9 | (S)-7a | Tf2NH | DCM | 50[b] | 9:1 | 97 |
| 10[c] | (S)-7a | Tf2NH | DCM | 80[b] | 9:1 | 98 |
| 11 | (S)-7a | AcOH | DCM | 88 | 7:1 | 96 |
| 12 | (S)-7a | AcOH | dioxane | 39 | 6:1 | 93 |
| 13 | (S)-7a | AcOH | DMF | 55 | 3:1 | 71 |
| 14 | (S)-7a | AcOH | MeCN | 63 | 3:1 | 92 |
| 15 | (S)-7a | AcOH | THF | 58 | 6:1 | 96 |
| 16 | (S,R)-7b | AcOH | DCM | 56 | 5:1 | 98 |
| 17 | (R,S)-7c | AcOH | DCM | 64 | 4:1 | -97 |
| 18 | (R,S)-7d | AcOH | DCM | 93 | 5:1 | -96 |
| 19 | (R,S)-7e | AcOH | DCM | 41 | 4:1 | -97 |
| 20 | (S,S)-7f | AcOH | DCM | 95 | 5:1 | 92 |
| 21[d] | (S)-7a | Tf2NH | DCM | 80[b] | 9:1 | 98 |
Table 1反应条件的筛选
Figure 2催化剂的筛选
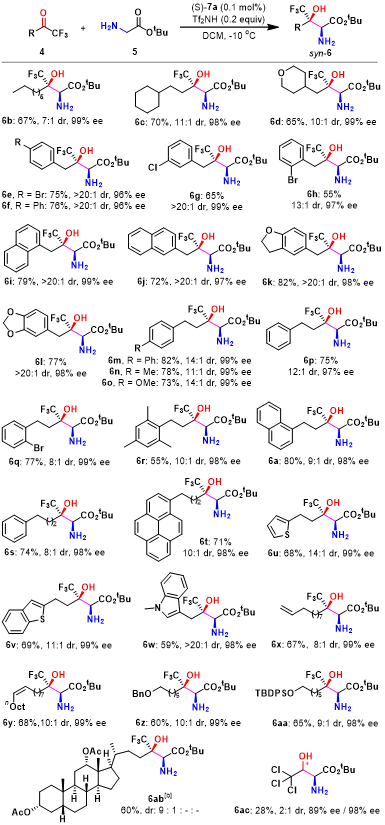
在获得上述最佳反应条件之后,作者进一步对吡哆醛催化的甘氨酸酯与三氟甲基酮之间的仿生不对称Aldol反应的底物应用范围进行考察 (Table 2)。研究表明,一系列烷基三氟甲基酮底物4均能够顺利参与相应的Aldol反应过程,并以中等至优秀的反应收率 (55-82%)、较高的非对映选择性 (up to >20:1)以及优良的对映选择性 (96-99% ee),获得相应的手性β-三氟甲基-β-羟基-α-氨基酸酯产物 6a-aa。而且,酮底物烷基链中的取代基,例如,脂肪族杂环 (6d)、芳基 (6e-t)、芳香杂环 (6u-w)、硅基 (6aa)以及C=C双键 (6x-y)对反应收率与选择性无显著影响。同时,作者发现,采用手性烷基三氟甲基酮底物,例如4ab,同样能够以高度的非对映选择性,获得相应的手性β-羟基-α-氨基酸酯6ab。并且,研究发现,三氯乙醛底物4ac同样能够较好地参与上述的Aldol过程,然而,却无法获得良好的非对映选择性 (2:1 dr)。此外,该小组进一步观察到,在上述的标准反应条件下,苯甲醛、癸-9-烯醛以及全氟代酮均无法有效地进行上述的Aldol反应过程。
Table 2底物适用范围的研究
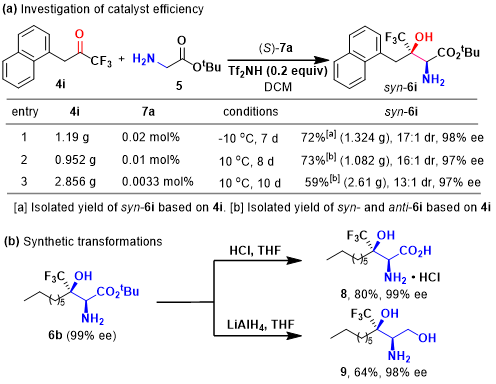
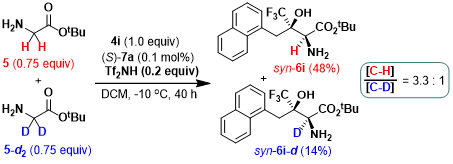
为了进一步考察甘氨酸酯与三氟甲基酮之间的仿生不对称Aldol反应中的催化效率。作者选择甘氨酸酯5 与三氟甲基酮4i 为模板底物,在较低催化剂用量下,例如,0.02或0.0033 mol%,进而研究仿生不对称Aldol反应的催化效率。实验结果表明,在0.02或0.0033 mol%的催化剂用量下,均能够以中等至良好的反应收率、优良的非对映选择性与对映选择性,获得相应的β-三氟甲基-β-羟基-α-氨基酸酯产物6i (Scheme 2a)。同时,作者发现在反应后期,速率显著降低,这可能源自于催化剂的部分失活。接下来,作者对β-三氟甲基-β-羟基-α-氨基酸酯6b进行相关的合成转化实验研究。研究过程中,作者发现,将6b中的叔丁基进行去保护以及通过LAH进行还原,均能够以中等的反应收率与优良的对映选择性获得了相应的手性β-羟基-α-氨基酸与手性 2-氨基-1,3-二醇转化产物 (Scheme 2b)。
Scheme 2催化剂效率研究与合成转化实验研究
上述羰基催化的甘氨酸酯与三氟甲基酮之间的高效仿生不对称Aldol反应具体的机理路径,与采用生物酶催化的Aldol反应过程类似[11]。为进一步研究上述仿生不对称Aldol反应的机理路径,作者对其反应机理进行进一步研究:1) 通过HRMS能够检测出催化剂(S)-7、亚胺中间体10以及后续形成的中间体13 (Scheme 3);2) 通过动力学同位素效应的研究表明,亚胺10去质子化步骤为[12-14]反应过程中的决速步骤 (Scheme 4);3) 反应动力学实验的研究表明,反应速率对于甘氨酸酯5为一级反应,对于三氟甲基酮4为零级反应,对于催化剂(S)-7a中为一级反应 (参阅SI),由此进一步表明决速步骤中涉及甘氨酸酯5,中间体11与三氟甲基酮4的亲核加成为快速反应步骤 4) 对于酸性添加剂Tf2NH用量的研究中,作者发现在较低pH的条件下,不利于10去质子化,形成11的机理步骤的进行 (Scheme 5);5) 为进一步理解 Tf2NH 的作用以及手性诱导的过渡态,作者进行相关的DFT计算 (参阅SI)与催化剂比较的控制实验 (Scheme 6),实验结果表明,酮4受到通过(S)-7a酰胺侧链的N-H 基团以及Tf2NH添加剂形成的双重氢键的活化。其中,4的CF3基团平行指向于(S)-7a酰胺的侧链方向,进而避免与具有较大位阻的Tf2N基团之间产生相应的立体排斥。同时,烯醇化的甘氨酸酯通过底面靠近三氟甲基酮4,并通过进一步反应,形成具有(2S,3R)绝对构型的手性β-羟基-α-氨基酸酯6。
Scheme 3反应机理研究
Scheme 4 KIE实验
Scheme 5 Tf2NH用量考察
Scheme 6 催化剂考察
基于上述实验事实,作者提出一种合理的反应机理 (Scheme 3a)。首先,手性吡哆醛(S)-7a与甘氨酸酯5通过缩合过程,形成亚胺10。中间体10经历去质子化过程,形成离域的碳负离子11。酮4受到通过(S)-7a酰胺侧链的N-H 基团以及Tf2NH添加剂形成的双重氢键的活化。其中,4的CF3基团平行指向于(S)-7a酰胺的侧链方向,进而避免与较大位阻的Tf2N基团之间产生相应的立体排斥。同时,烯醇化的甘氨酸酯通过底面靠近三氟甲基酮4,进而通过过渡态12形成中间体13,并通过中间体13的进一步水解,获得相应的手性β-羟基-α-氨基酸酯6,同时,使吡哆醛催化剂(S)-7a再生,进而完成相应的催化循环过程。
总结
综上所述,赵宝国教授课题组在温和的反应条件下,采用0.1-0.0033 mol%的手性N-甲基吡哆醛7a作为催化剂,成功开发出甘氨酸酯5与三氟甲基酮4之间的不对称Aldol反应方法学,并以55-82%收率、>20:1dr与99% ee,制备出一系列手性β-三氟甲基-β-羟基-α-氨基酸酯类化合物。反应过程中无需对具有反应活性的NH2基团进行保护。这一方法学的成功设计,为手性β-三氟甲基-β-羟基-α-氨基酸酯类分子的合成,开辟出一种操作简便,并具有良好原子经济的合成策略。

















No comments yet.