本文作者 漂泊
钼元素是一种重要的合金元素,它能提高钢的强度、韧性、抗腐蚀性和耐磨性。钼也是一种重要的生理元素,它是人体及动植物必需的微量元素:钼是黄嘌呤氧化酶/脱氢酶、醛氧化酶和亚硫酸盐氧化酶的组成成分。二维二硫化钼材料还有望成为下一代的晶体管材料,为信息产业带来革命。
钼的基本物理性质
| 分类 | 第ⅥB族▪金属 |
| 原子序号・原子量 | 42(95.94) |
| 电子配置 | 4d55s1 |
| 密度 | 10200kg / m 3 |
| 熔点 | 2620°C |
| 沸点 | 5560°C |
| 色・形状 | 银白色金属 |
| 丰度 | 1.3ppm(地壳) |
| 发现者 | Peter Jacob Hjelm |
| 主要的同位素 | 92Mo, 94Mo, 95Mo, 96Mo, 97Mo, 98Mo, 100Mo |
| 用途例 | 合金,肥料,固体润滑剂 |
| 前后的元素 | 铌-钼-锝 |
钼的发现
钼很早就为人们所使用了,早在14世纪,日本就开始用含钼的钢制造刀剑;在16世纪,辉钼矿是一种软的黑色矿物,因为与铅、方铅矿及石墨的外观和性质都很相似,被人们当作石墨使用,当时的欧洲人还将这几种矿石统称为“molybdenite”。这个名字来源于古希腊Μόλυβδος molybdos,意思是铅。
1754年,瑞典化学家Bengt Andersson Qvist检测了辉钼矿,发现里面不含铅,因而他认为辉钼矿与方铅矿并不是同一种物质。到了1778年,瑞典的化学家舍勒发现硝酸与石墨不起反应,而与辉钼矿反应后获得一种白色粉末,将它与碱溶液共同煮沸,结晶析出一种盐。他认为这种白色粉末是一种金属氧化物,用木炭混合后强热,并没有获得金属,而当它与硫在一起加热后却得到原来的辉钼矿,因而他认为辉钼矿应该是一种未知元素的矿物。根据舍勒的启发,1781年,瑞典人Peter Jacob Hjelm用亚麻子油调过的木炭和钼酸混合物密闭灼烧,分离出一种新的金属,并将该金属命名为“Molybdenum”。这就是钼元素被发现的过程,它得到贝齐里乌斯等人的承认。[1-2]
金属钼辉钼矿
钼合金
钼是一种熔点很高的金属,它的熔点高达2620℃,且有良好的高温性能和耐腐蚀性能,钼与钢铁结合力强,因而是汽车部件生产中主要的热喷涂材料。汽车部件一般采用钼丝高速火焰喷涂,喷枪的气体混合喷射装置产生高温燃气燃烧,特殊设计的燃烧室和气体喷射混合室,使钼丝在完全熔化前,以极高的速度喷涂在工件的表面上,喷射钼的致密度可达99%以上。这一工艺过程能有效地改善受磨面的耐磨性,也提供了一个可以浸渍润滑油的多孔表面。它广泛地应用于汽车工业以提高活塞环、同步环、拨叉和其他受磨部件的性能,也用于修复磨损的曲轴、轧辊、轴杆和其他机械部件。钼也常常被用来制造高温炉的发热体和结构材料。在钨钼及硬质合金生产过程中,大都采用钼丝加热的方式制作还原炉和烧结炉,这类炉子一般为还原性气氛或非氧化性气氛,在氢气和分解氨中钼丝可使用至接近熔点,氮气中可使用至2000℃。高于1700℃使用时,可采用再结晶温度更高、强度更好的TZM合金或钼镧合金作发热体。钼在熔化的石英中有很好的抗烧蚀性能,在玻璃工业中用作通电熔融电极,每生产一吨玻璃钼电极仅损失7.8克,使用寿命可长达一年多。除作电极外,钼还用作玻璃熔化高温结构材料,如导槽、管子、坩埚、流口以及稀土冶炼的搅拌棒。
在众多应用当中,钼在钢铁工业中的应用仍然占据着最主要的位置。钼能提高钢的强度、韧性、抗腐蚀性和耐磨性;还能改善钢的淬透性、焊接性和耐热性。它还是一种良好的形成碳化物的元素,它在炼钢的过程中不会氧化,可单独使用也可与其他合金元素共同使用。钼作为铁的合金添加剂,有助于形成完全珠光体的基体,能改善铸铁的强度和韧性,提高大型铸件组织的均匀性。在轧制状态下有微细珠光体组织的含钼合金钢,是铁轨和桥梁建设中的重要钢材。含钼灰口铸铁具有很好的耐磨性,可作重型车辆的闸轮和刹车片。
钼与铬、镍、锰和硅等可制造不同类型的不锈钢、工具钢、高速钢和合金钢等。所制成的不锈钢有良好的耐腐蚀性能,可用于石油开采的耐腐蚀钢管。以钼为基体加入其他元素(如钛、锆、铪、钨及稀土元素等)构成有色合金,这些合金元素不仅对钼合金起到固溶强化和保持低温塑性的作用,而且还能形成稳定的、弥散分布的碳化物相,提高合金的强度和再结晶温度。
在现代电子工业中除使用纯钼外,Mo-Re合金可作电子管和特种灯泡的结构材料,Mo-Re合金还可作高功率微波管和毫米波管中的热离子阴极结构元件,其工作温度可达到1200℃,电流密度可达10A/cm2。[3-5]
钼合金
神奇的肥料
1958年,新西兰有一个牧场出现了一个很奇怪的现象:这个牧场的牧草大多枯黄,遍地萎死,但令人惊奇的是:横穿牧场的一条路边,却长满了茂盛的绿草。这个现象吸引了科学家们的注意。他们通过观察发现:牧场东边的矿工们上下班的时候,为了抄近路会横穿牧场,他们鞋上的矿物粉末在经过牧场时掉在地上,这些矿物粉末正是让枯草变绿的原因所在。这些矿物粉末里含有大量的钼,牧草之所以枯黄就是因为缺钼。科学家把钼加进了肥料,让牧民洒到草场。不久之后,牧草都变绿了,牧场恢复了生机。
钼是植物体内必须的“微量元素”之一,是不可缺少和不可替代的,它约占植物干物量的0.5ppm左右。近年来国内外广泛地采用钼酸铵作为微量元素肥料,能显著地提高豆类植物、牧草及其他作物的质量和产量。这是因为钼是植物体内固氮菌中钼黄素蛋白酶和植物硝酸还原酶的主要成份之一,能促进根瘤菌和其他固氮生物对空气中氮的固定,并将氮元素进一步转化成植物所需的蛋白质。钼还能激发磷酸酶活性,促进植物对磷的吸收和在植物体内发挥其作用;以及还能加快植物体内醣类的形成与转化,促进作物内糖和淀粉的合成与输送,有利于作物早熟。除此之外,它还能提高植物叶绿素的含量与稳定性,使植物生长繁茂。
施用钼肥的特点是用量少,收效大,成本低,是提高农业收成特别是使大豆丰收的一项重要措施。钼在农业上的广泛应用,也为我国钼生产工厂的废水、废渣及低品位矿的综合利用,开辟了一条新的途径。
钼也是动物体内肝、肠中黄嘌呤氧化酶、醛类氧化酶的基本成份之一,同时还是亚硫酸肝素氧化酶的基本成份。研究表明,钼还有明显防龋作用,钼对肾结石的形成有强烈抑制作用,人体缺钼易患肾结石。但钼过量的摄入也会加速人体动脉壁中弹性物质——缩醛磷脂的氧化。所以,土壤含钼过高的地区,癌症发病率较低但痛风病、全身性动脉硬化的发病率较高。[6-7]
钼肥
二硫化钼
二硫化钼是一种具有层状结构的金属硫化物。层与层之间的作用力是范德华力,这导致它跟石墨一样具有润滑性。自然界中二硫化钼以辉钼矿的形式存在,它在很久以前就被当做石墨使用。现在二硫化钼常用作固体润滑剂和高压高温(HPHT)润滑油脂的添加剂。它能形成绝不粘结的胶体状态,增加油脂的润滑性和极压性。也适用于高温、高压、高转速高负荷的机械工作状态,延长设备寿命。二硫化钼在金属表面形成坚固的薄膜——在发生灾难性油脂失效的情况下,薄薄的二硫化钼层可防止润滑部件接触。因此它被誉为“高级固体润滑油王”。
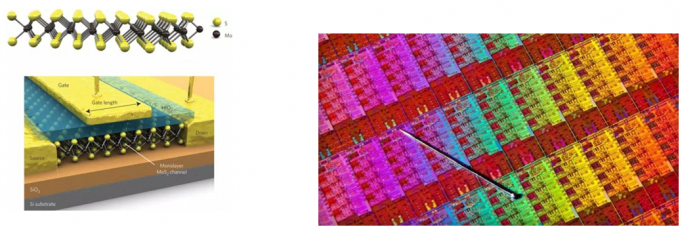
此外,二硫化钼还有望成为制作晶体管的新型材料。二维材料是目前研究的一个热门领域,所谓二维材料是指厚度在几个纳米到几十个纳米的薄层纳米材料,其中的代表如石墨烯是由单层的碳原子构成的。单层的二硫化钼也是一种重要的二维材料,是过渡金属硫化物二维材料家族的代表。相较于零带隙的石墨烯,二硫化钼则拥有1.8eV的带隙,这使得二硫化钼可能在纳米晶体管领域拥有很广阔的应用空间。而且单层二硫化钼晶体管的电子迁移率最高可达约500 cm2/(V·s),制备大面积的二维二硫化钼材料相关技术也接近成熟。这使得二维二硫化钼材料有望取代硅材料,成为下一代集成电路所广泛使用的材料。[8-9]
二维二硫化钼结构及晶体管 集成电路
参考文献
- [1] Lide, David R., ed. (1994). “Molybdenum”. CRC Handbook of Chemistry and Physics. 4. Chemical Rubber Publishing Company. p. 18. ISBN 0-8493-0474-1.
- [2] “It’s Elemental – The Element Molybdenum”. education.jlab.org. Retrieved 2018-07-03.
- [3]Considine, Glenn D., ed. (2005). “Molybdenum”. Van Nostrand’s Encyclopedia of Chemistry. New York: Wiley-Interscience. pp. 1038–1040. ISBN 978-0-471-61525-5.
- [4] “Molybdenum Statistics and Information”. U.S. Geological Survey. 2007-05-10. Retrieved 2007-05-10.
- [5]Smallwood, Robert E. (1984). “TZM Moly Alloy”. ASTM special technical publication 849: Refractory metals and their industrial applications: a symposium. ASTM International. p. 9. ISBN 9780803102033.
- [6]Emsley, John (2001). Nature’s Building Blocks. Oxford: Oxford University Press. pp. 262–266. ISBN 0-19-850341-5.
- [7]Mendel, Ralf R. (2013). “Chapter 15 Metabolism of Molybdenum”. In Banci, Lucia. Metallomics and the Cell. Metal Ions in Life Sciences. 12. Springer. doi:10.1007/978-94-007-5561-10_15. ISBN 978-94-007-5560-4. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402
- [8]Winer, W. (1967). “Molybdenum disulfide as a lubricant: A review of the fundamental knowledge”. Wear. 10 (6): 422–452. doi:10.1016/0043-1648(67)90187-1
- [9] “New transistors: An alternative to silicon and better than graphene”. Physorg.com. January 30, 2011. Retrieved 2011-01-30.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

























No comments yet.