作者:石油醚
导读:
近日,美国UIUC的David Sarlah团队在J. Am. Chem. Soc上,以 “Total Syntheses of Scabrolide A and Yonarolide” 为题,报道了分别通过10步和11步完成了Norcembranoid二萜类天然产物Scabrolide A和Yonarolide的简明全合成路线设计。其中,关键步骤主要涉及 [5,5]-双环内酯由两个手性片段通过偶联高效构建、Liebeskind-Srogl偶联 (Liebeskind–Srogl coupling) 、LDA/ZnI2 体系促进的环化/消除串联反应 (cyclization/elimination cascade by a zinc-amido base)以及通过后期γ-氧化引入敏感的烯二酮部分 (enedione motif by late-stage γ-oxidatio) 等。
“Total Syntheses of Scabrolide A and Yonarolide
Roberto Serrano, Yaroslav D. Boyko, Lucas W. Hernandez, Aleksandras Lotuzas, and David Sarlah*
J. Am. Chem. Soc., 2023,145,8805-8809. doi: 10.1021/jacs.3c02317”
正文:
天然产物(−)-Yonarolide(1)和(−)-Scaprolide A(2)是由日本科学家Yasuji Yamada及其同事于1995年首次从短指软珊瑚Sinularia中分离出Norcembranoid类二萜类化合物家族的代表性成员 (Figure 1a)[1],并且初步研究表明(−)-Scaprolide A(2)具有抗癌和抗炎症的特性。近日,美国UIUC的David Sarlah教授课题组报道了分别通过10步和11步完成了Norcembranoid类二萜类天然产物Scabrolide A (2) 和Yonarolide (1) 的简明全合成。并发表于J. Am. Chem. Soc上。
很明显(−)-Yonarolide(1)和(−)-Scaprolide A(2)具有极其相似的骨架,并且(1)脱水即可获得 (2)。基于上述以及 (1) 和(2)骨架结构,作者对进行了Scaprolide A相关的逆合成分析(Figure 1b),进而推测出全合成路线设计中的关键砌块分别为γ-oxidation of tetracycle (3)、[5,5]-双环内酯 (4)、环庚烯基砌块 (5)、Maimone’s 烯酮 (6)以及烯酮 (7)、亚甲基环丙烷(MCP)。其具体的逆合成路线是, Maimone’s 烯酮 (6)或烯酮(7)与亚甲基环丙烷(MCP)发生[3+2]环加成[2]即可获得[5,5]-双环内酯(4)和环庚烯基砌块 (5),砌块(4)与环庚烯基砌块 (5)偶联构建关键砌块 (3)。四环化合物(3)的γ-氧化即可获得天然产物(−)-Scaprolide A(2),而(2) 脱水获得(−)-Yonarolide(1)。
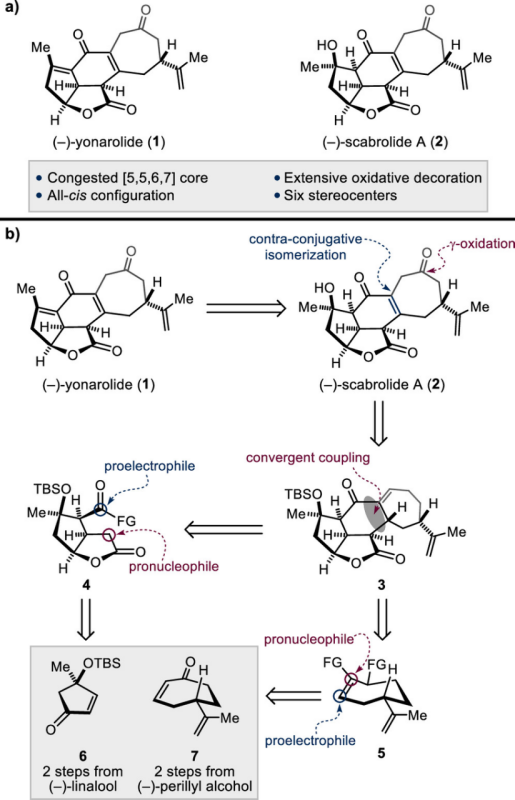
Figure 1. Structures of (−)-yonarolide (1) and (−)-scabrolide A (2). (b) Retrosynthetic analysis
首先,在温和条件下,以溴甲基环丙烷为原料,实现了>10 g级规模亚甲基环丙烷 (MCP) (9)合成(Figure 2c)。另外一方面,受到Noyori等人报道[3]以及Binger等人[4]进一步开发的环化方法启发,作者通过改良镍催化环戊烯酮 (8)与亚甲基环丙烷 (9) 构建环化产物 (10)的条件(Figure 2b),成功实现了官能团化的环戊烯酮(6)与亚甲基环丙烷 (9)反应构建关键的砌块 (11) (Figure 2b)。
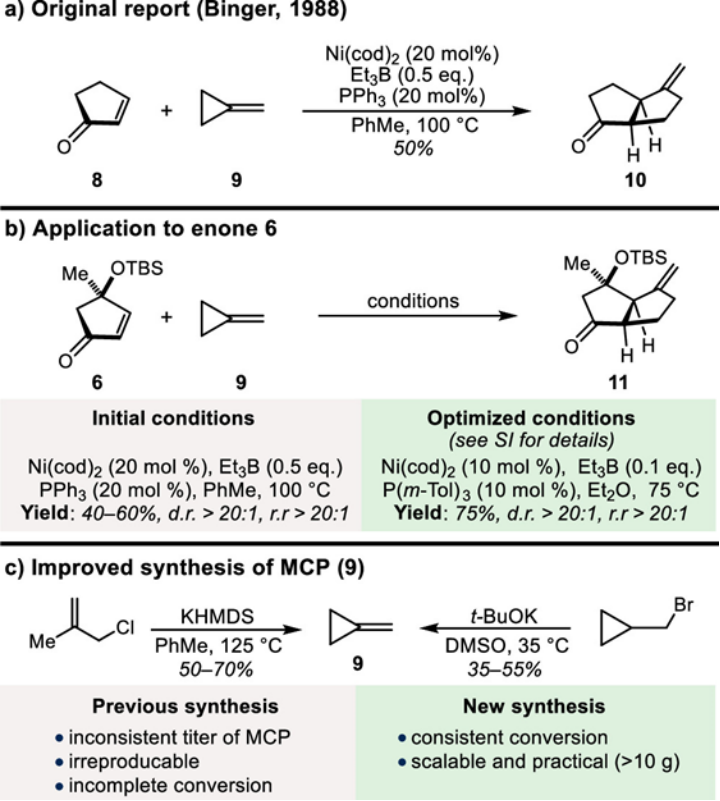
Figure 2. Optimization of Ni-Catalyzed Annulation
其次,该小组完成了(−)-Yonarolide(1)和(−)-Scaprolide A(2)全合成路线设计,如Figure 3。
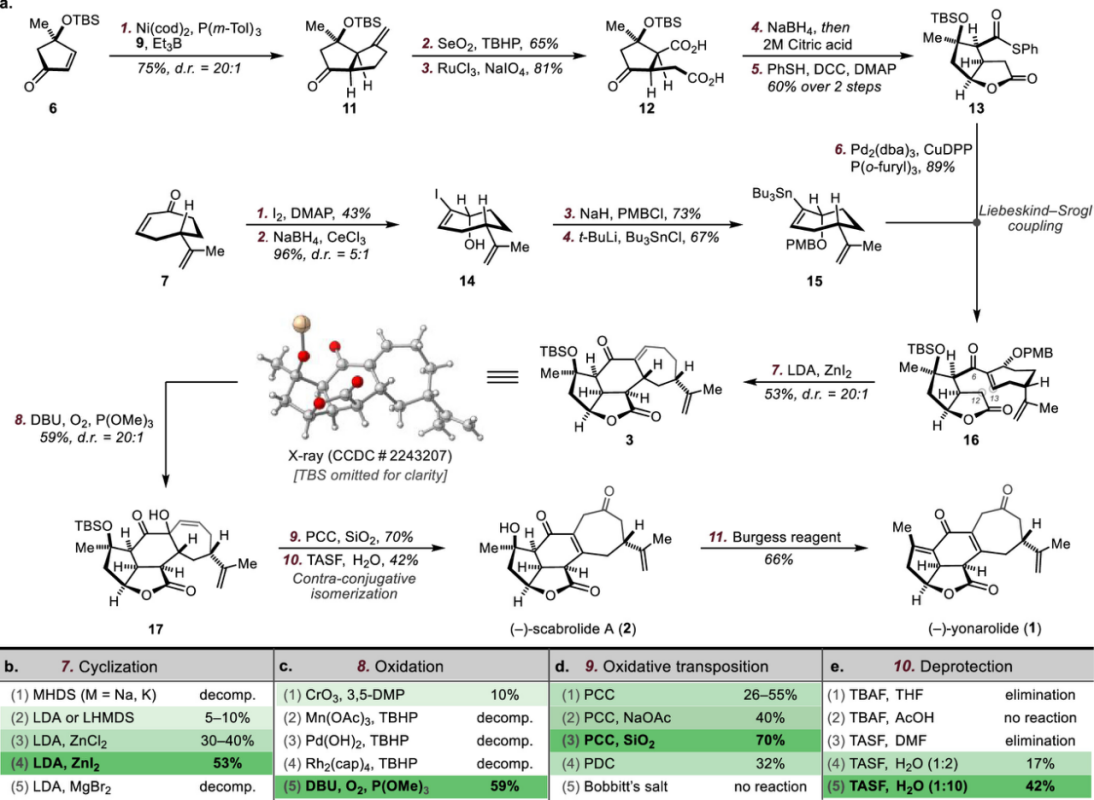
Figure 3. Syntheses of Yonarolide (1) and (−)-Scabrolide A (2)

总结,David Sarlah教授课题组报道了分别通过10步和11步完成了Norcembranoid类二萜类天然产物Scabrolide A (2) 和Yonarolide (1) 的简明全合成。其中,关键步骤主要涉及 [5,5]-双环内酯由两个手性片段通过偶联高效构建、Liebeskind-Srogl偶联 (Liebeskind–Srogl coupling) 、LDA/ZnI2 体系促进的环化/消除串联反应 (cyclization/elimination cascade by a zinc-amido base)以及通过后期γ-氧化引入敏感的烯二酮部分 (enedione motif by late-stage γ-oxidatio) 等。
参考文献:
- [1] (a) Iguchi, K.; Kajiyama, K.; Yamada, K. Tetrahedron Lett. 1995, 36, 8807−8808. doi: 10.1016/0040-4039(95)01867-H. (b) Sheu, J.; Ahmed, F.; Shiue, R.; Dai, C.; Kuo, Y. J. Nat. Prod. 2002, 65, 1904−1908.doi: 10.1021/np020280r. (c) Cui, W.-X.; Yang, M.; Li, H.; Li, S.-W.; Yao, L.-G.; Li, G.; Tang, W.; Wang, C.-H.; Liang, L.-F.; Guo, Y.-W. Bioorg. Chem. 2020, 94, 103350. doi: 10.1016/j.bioorg.2019.103350. (d) Du, Y.; Yao, L.; Li, X.; Guo, Y. Y. Chin. Chem. Lett. 2023, 34 , 107512.doi: 10.1016/j.cclet.2022.05.026.
- [2] Brill, Z.; Grover, H.; Maimone, T. Science 2016, 352, 1078−1082. doi: 10.1126/science.aaf6742.
- [3] Noyori, R.; Odagi, T.; Takaya, H. J. Am. Chem. Soc. 1970, 92, 5780−5781.doi: 10.1021/ja00722a064.
- [4] Binger, P.; Schafer, B. Tetrahedron Lett. 1988, 29,4539−4542. doi: 10.1016/S0040-4039(00)80541-9.
- [5] Umbreit, M.; Sharpless, K. B. J. Am. Chem. Soc. 1977, 99, 5526−5528. doi: 10.1021/ja00458a072.
- [6] Neises, B.; Steglich, W. Angew. Chem., Int. Ed. 1978,17, 522–524, doi: 10.1002/anie.197805221.
- [7] Ohshima, T.; Xu, Y.; Takita, R.; Shimizu, S.; Zhong, D.; Shibasaki, M. J. Am. Chem. Soc. 2002, 124, 14546–14547, doi: 10.1021/ja028457r.
- [8] Gemal, A. L.; Luche, J. L. J. Am. Chem. Soc. 1981, 103, 5454–5459,doi: 10.1021/ja00408a029.
- [9] (a) Li, H.; Yang, H.; Liebeskind, L. S., Org. Lett. 2008, 10, 4375– 4378. doi: 10.1021/ol8018456. (b) Ferrié, L.; Fenneteau, J.; Figadère, B. Org. Lett. 2018, 20, 3192– 3196. doi: 10.1021/acs.orglett.8b01020
- [10] (a) Hlavinka, M.; Hagadorn, J. Organometallics 2007, 26, 4105– 4108. doi: 10.1021/om700475t. (b) Rohbogner, C. J.; Wunderlich, S.; Clososki, G.; Knochel, P. Eur. J. Org. Chem. 2009, 2009, 1781– 1795. doi: 10.1002/ejoc.200801277
- [11] (a) Brooke, A. G.; Macrae, D. M. J. Organomet. Chem. 1974, 77, 19– 21.doi: 10.1016/S0022-328X(00)81332-7 . (b) Rubottom, G. M.; Gruber, J. M.; Boeckman, R. K., Jr; Ramaiah, M.; Medwid, J. B. Tetrahedron Lett. 1978, 19, 4603– 4606. doi: 10.1016/S0040-4039(01)85682-3.
- [12] Luzzio, F.; Fitch, R.; Moore, W.; Mudd, K. J. Chem. Educ. 1999, 76, 974. doi: 10.1021/ed076p974.
- [13] Scheidt, K.; Bannister, T.; Tasaka, A.; Wendt, M.; Savall, B.; Fegley, G.; Roush, W. R. J. Am. Chem. Soc. 2002, 124, 6981– 6990. doi: 10.1021/ja017885e.
- [14] Atkins, G. M., Jr.; Burgess, E. M. J. Am. Chem. Soc. 1968, 90, 4744– 4745. doi: 10.1021/ja01019a052.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载
















No comments yet.