作者:石油醚
导读:
近日,美国University of California−Berkeley的Thomas J. Maimone团队在J. Am. Chem. Soc上,以 “Enantioselective Total Synthesis of (−)-Caulamidine A” 为题,首次报道了天然产物(−)-Caulamidine A全合成路线设计,并确定了(−)-Caulamidine A的绝对构型。其中,关键步骤主要涉及glycol bistriflat促进非对映选择性酮-脒环化反应(diastereoselective ketone-amidine annulation reaction);高度非对映选择性氢原子转移(highly diastereoselective hydrogen atom transfe)构建关键的含氯的立体中心
“Enantioselective Total Synthesis of (−)-Caulamidine A.
Zhouyang Zhu and Thomas J. Maimone*
J. Am. Chem. Soc., 2023,ASAP. doi:10.1021/jacs.3c04493“
正文:
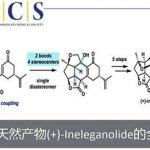
天然产物三卤化吲哚类生物碱Caulamidine A(1)和B(2)是由美国科学家Gustafson及其同事于2004年从海洋苔藓虫Caulibugula intermis的提取物中作为次要成分分离获得 (Figure 1A)[1],并对氯喹敏感和耐药的恶性疟原虫菌株具有活性,且对人体细胞几乎没有细胞毒性。近日,Thomas J. Maimone团队以11步首次报道了天然产物(−)-Caulamidine A全合成路线设计,并确定了(−)-Caulamidine A 结构绝对构型,并发表于J. Am. Chem. Soc上。
首先,天然产物(±)- Caulamidine A(1)和B(2)均含有六氢-2,6-naphthyridine以及二氢吲哚衍生的四氢喹啉相互稠合的并环系统[2]。基于上述结构Caulamidine A骨架的,作者对天然产物(−)-Caulamidine A (1)进行了相关的逆合成分析(Figure 1A 和1C),即中间体双阴离子(13)和双碳亲电试剂发生区域和立体选择性的环化反应来构建四环中间体(12)[3],再通过四环(12)和苄基卤化物(11)的立体选择性偶联来构建砌块(10),最后,烯胺中间体(10)发生非对映选择性钦点氯化反应即可合成天然产物(−)-Caulamidine A (1)。
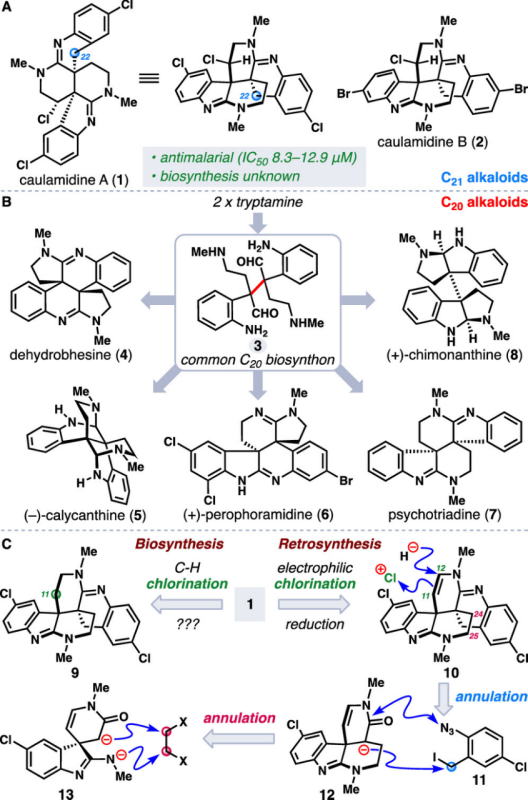
Figure 1. (A) Structures of caulamidines A and B. (B) Representative bis(cyclotryptamine) alkaloids. (C) Initial synthetic plan toward 1.
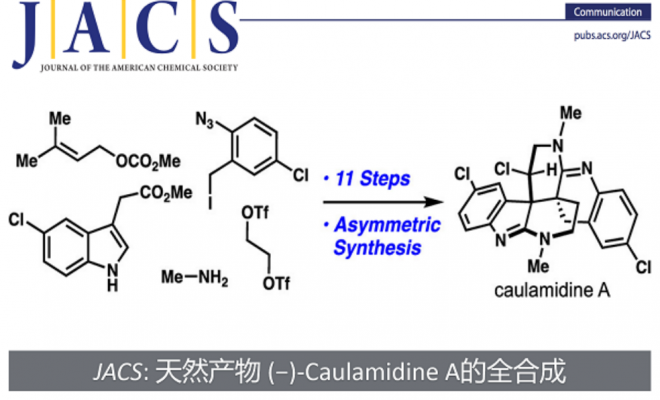
该小组完成了(-)- Caulamidine A(1) 的对映选择性全合成路线设计,如Figure 2。

Figure 2. Asymmetric Total Synthesis of Caulamidine A (1)
总结,Thomas J. Maimone教授以市售的甲基-5-氯吲哚-3-乙酸酯为起始原料,以11步最长线性步骤首次完成了天然产物(−)-Caulamidine A (1)全合成路线设计,并确定了(−)-Caulamidine A (1)的绝对构型。其中的关键步骤主要涉及glycol bistriflat促进非对映选择性酮-脒环化反应;高度非对映选择性氢原子转移构建关键的含氯的立体中心。
参考文献:
- [1] Milanowski, D. J.; Gustafson, K. R.; Kelley, J. A.; McMahon, J. B. J.Nat. Prod. 2004, 67, 70−73.doi: 10.1021/np030378l.
- [2] Milanowski, D. J.; Oku, N.; Cartner, L. K.; Bokesch, H. R.; Williamson, R. T.; Saurí, J.; Liu, Y.; Blinov, K. A.; Ding, Y.; Li, X.-C.; Ferreira, D.; Walker, L. A.; Khan, S.; Davies-Coleman, M. T.; Kelley, J. A.; McMahon, J. B.; Martin, G. E.; Gustafson, K. R. Chem. Sci. 2018, 9, 307−314.doi: 10.1039/C7SC01996C.
- [3] Shen, X.; Thach, D. Q.; Ting, C. P.; Maimone. T. J., Acc. Chem. Res.2021, 54, 583.doi: 10.1021/acs.accounts.0c00781.
- [4] Tu, H.-F.; Zhang, X.; Zheng, C.; Zhu, M.; You, S.-L. Nat. Catal. 2018, 1, 601−608. doi: 10.1038/s41929-018-0111-8.
- [5] Bundesmann, M. W.; Coffey, S. B.; Wright, S. W. Tetrahedron Lett. 2010, 51, 3879−3882.doi: 10.1016/j.tetlet.2010.05.075.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载






















No comments yet.