本文作者:晓晓
导读
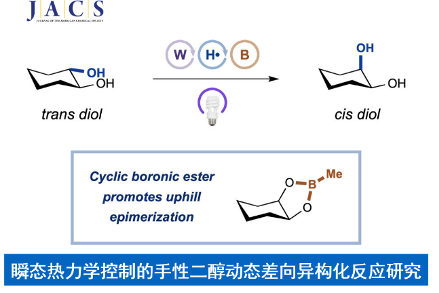
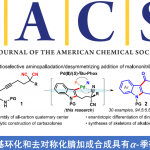
近期,美国Princeton大学的MacMillan研究团队成功设计出一种全新的通过光催化剂促进的采用手性二醇分子参与的经历瞬态热力学控制 (transient thermodynamic control)的选择性差向异构化反应方法学,进而成功完成一系列cis-二醇分子的构建。这一全新的选择性差向异构化策略表现出优良的非对映选择性控制。同时,反应过程中的关键步骤涉及HAT (hydrogen atom transfer)以及硼酸酯复分解 (boronic ester metathesis)反应。
Selective Isomerization via Transient Thermodynamic Control: Dynamic Epimerization of trans to cis-Diols
J. Oswood, D. W. C. MacMillan, J. Am. Chem. Soc. 2021, 144, 93. doi: 10.1021/jacs.1c11552.
正文
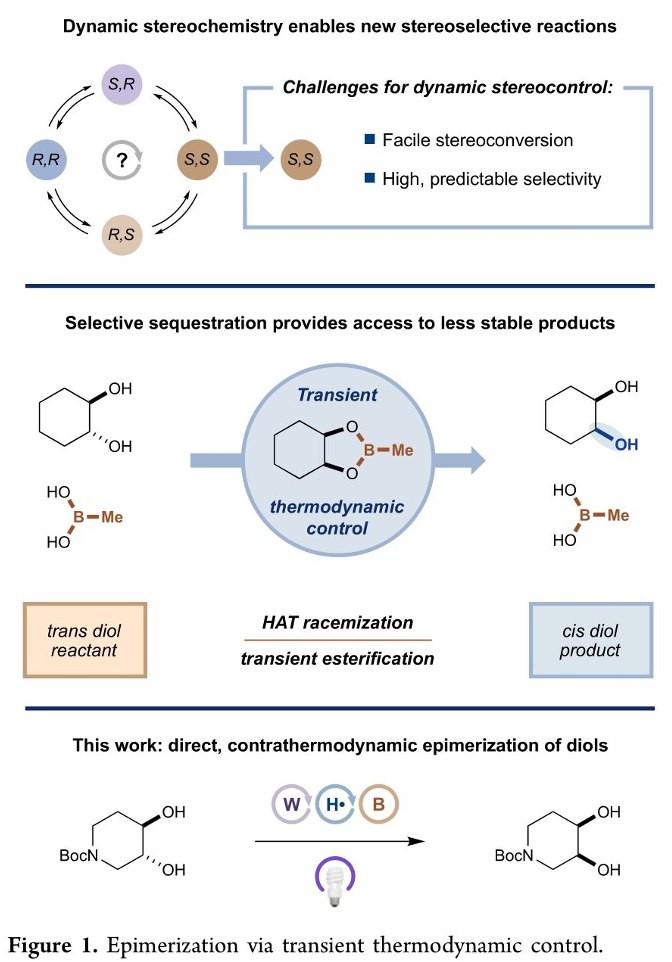
构建、维持以及操纵有机分子的立体化学长期以来一直备受有机合成化学家的广泛关注[1]。这里,受到前期本课题组对于动态立体控制 (dynamic stereocontrol)[2]策略与HAT反应方法学[3]以及通过硼酸的环螯合作用改变环二醇异构体相对稳定性[4]相关研究的启发,Princeton大学的MacMillan研究团队通过瞬态热力学控制 (transient thermodynamic control)策略,成功设计出一种全新的通过光催化剂促进的采用环二醇分子参与的选择性差向异构化反应方法学,进而成功完成一系列cis-二醇分子的构建 (Figure 1)。
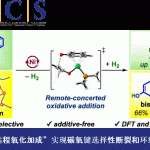
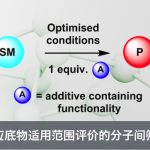
首先,该研究团队采用trans-1,2-环己二醇1作为模型底物,对于反应条件进行进一步的优化筛选 (Figure 2 and SI),进而确定最佳的反应条件为:采用MeB(OH)2 作为螯合添加剂,TBPDT (tetrabutylphosphonium decatungstate)作为HAT催化剂,PhSSPh作为HAT供体共催化剂 (HAT donor cocatalyst),乙腈作为反应溶剂,选择近紫外光辐射 (Kessil 34 W 390 nm LED),反应温度为20-30 oC,最终获得相应的cis-二醇产物3。
在获得上述的最佳反应条件之后,作者进一步对上述选择性差向异构化过程中trans-1,2-二醇的底物应用范围进行如下研究 (Table 1)。
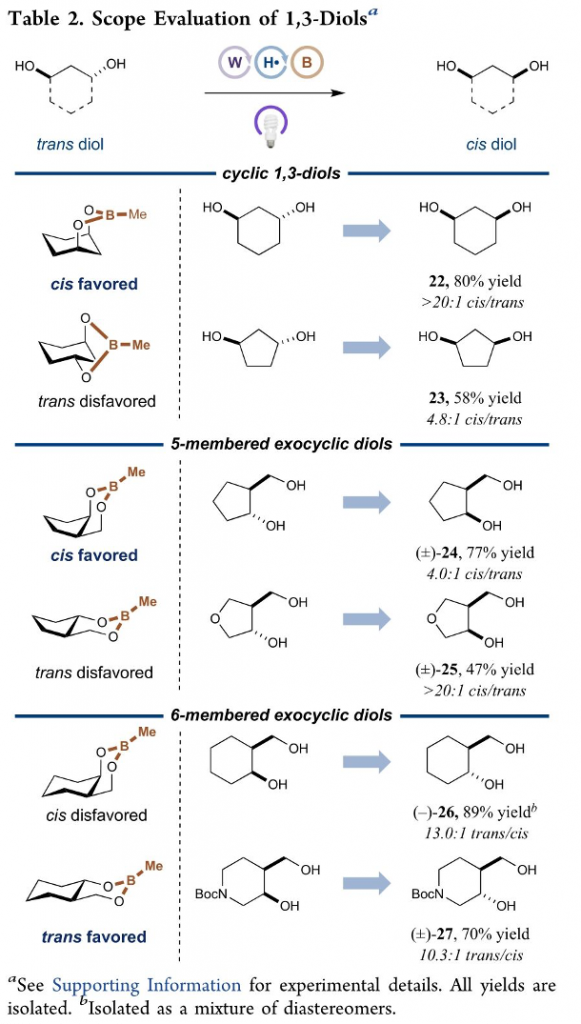
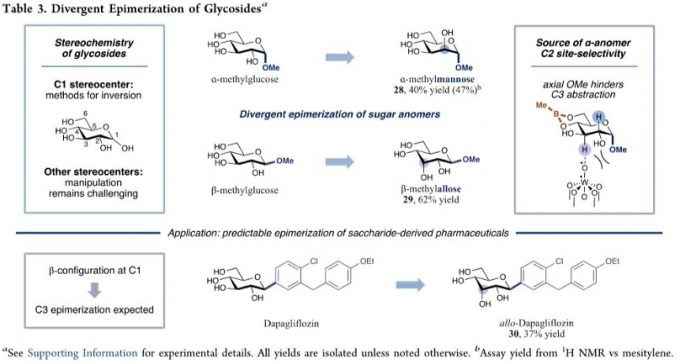
之后,该小组进一步研究发现,这一全新的差向异构化策略同样能够有效地应用于一系列1,3-二醇底物 (Table 2)以及一系列糖类分子及其衍生物 (Table 3)。
结论
美国Princeton大学的MacMillan研究团队成功设计出一种全新的通过光催化剂促进的采用手性二醇分子参与的选择性差向异构化反应方法学,进而成功完成一系列cis-二醇分子的构建。这一全新的选择性差向异构化策略具有优良的非对映选择性控制、广泛的底物应用范围以及良好的合成应用价值等优势。
参考文献
- [1] V. Bhat, E. R. Welin, X. Guo, B. M. Stoltz, Chem. Rev. 2017, 117, 4528. doi: 10.1021/acs.chemrev.6b00731.
- [2] J. S. De Hovitz, Y. Loh, J. A. Kautzky, K. Nagao, A. J. Meichan, M. Yamauchi, D. W. C. MacMillan, T. K. Hyster, Science 2020, 369, 1113. doi: 10.1126/science.abc9909.
- [3] (a) J. L. Jeffrey, J. A. Terrett, D. W. C. MacMillan, Science 2015, 349, 1532. doi: 10.1126/science.aac8555.
- (b) P. J. Sarver, V. Bacauanu, D. M. Schultz, D. A. Di Rocco, Y. Lam, E. C. Sherer, D. W. C. MacMillan, Nat. Chem.2020, 12, 459. doi: 10.1038/s41557-020-0436-1.
- (c) P. J. Sarver, N. B. Bissonnette, D. W. C. MacMillan, J. Am. Chem. Soc. 2021, 143, 9737. doi: 10.1021/jacs.1c04722.
- (d) D. Ravelli, M. Fagnoni, T. Fukuyama, T. Nishikawa, I. Ryu, ACS Catal. 2018, 8, 701. doi: 10.1021/acscatal.7b03354.
- [4] (a) R. S. Mancini, J. B. Lee, M. S. Taylor, Org. Biomol. Chem. 2017, 15, 132. doi: 10.1039/C6OB02278B.
- (b) V. Dimakos, H. Su, G. E. Garrett, M. S. Taylor, J. Am. Chem. Soc. 2019, 141, 5149. doi: 10.1021/jacs.9b01531.
- (c) V. Dimakos, D. Gorelik, H. Su, G. E. Garrett, G. Hughes, H. Shibayama, M. S. Taylor, Chem. Sci. 2020, 11, 1531. doi: 10.1039/C9SC05173B.
- (d) H. C. Brown, G. Zweifel, J. Org. Chem. 1962, 27, 4708. doi: 10.1021/jo01059a119.
- (e) C. D. Roy, H. C. Brown, Tetrahedron Lett. 2007, 48, 1959. doi: 10.1016/j.tetlet.2007.01.070.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载
















No comments yet.