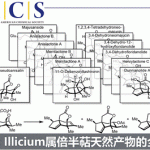
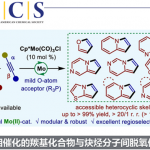
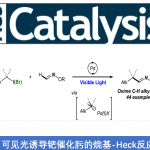
背景介绍
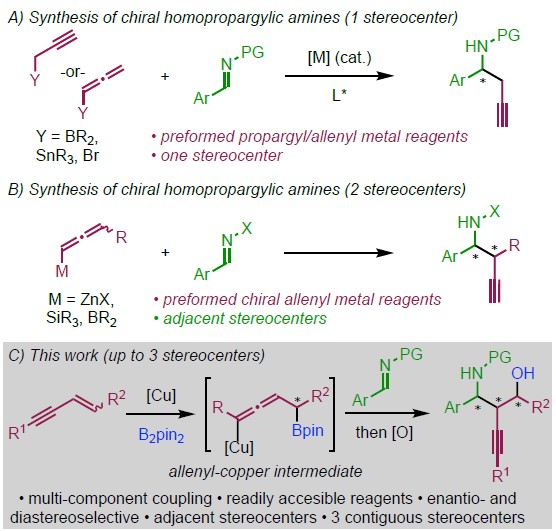
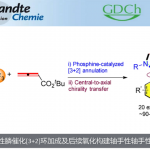
手性高炔丙胺类化合物广泛用于合成天然产物以及生物活性分子,因此高炔丙基胺的合成已经成为化学家们关注的焦点。合成手性高炔丙基胺类化合物一般是通过过渡金属催化炔或联烯与含手性辅基的亚胺反应,但该类反应仅适用于只有一个手性中心的高炔丙基胺的合成[1](Scheme 1A)。而很少有合成含多个手性中心的高炔丙胺的相关报道,并且,这些策略所需的底物合成较为繁琐同时,所用的亚胺也必须连接有手性辅基[2](Scheme 1B)。因此,合成含有多个手性中心的高炔丙基胺类化合物仍然面临巨大的挑战。为了解决这一难题,英国Manchester大学Procter课题组报道了Cu和手性膦配体催化的亚胺、1,3-烯炔和双硼烷的三组分不对称偶联反应,可以良好至优良的收率、优良的对映选择性以及良好至优良的非对映选择性得到一系列含两个或三个相邻手性中心的手性高炔丙基胺类化合物(Scheme 1C)。同时,通过简单的氧化途径,手性高炔丙基胺类化合物可转化为重要的1,3-氨基醇类化合物。相关研究成果发表于
“Enantio- and Diastereoselective Synthesis of Homopropargyl Amines by Copper-Catalyzed Coupling of Imines, 1,3-Enynesand Diborons”
S. Manna, Q. Dherbassy, G. J. P. Perry, D. J. Procter* Angew. Chem. Int. Ed. 2020, 59, 4879. DOI: 10.1002/anie.201915191
Scheme 1 背景研究
论文概要
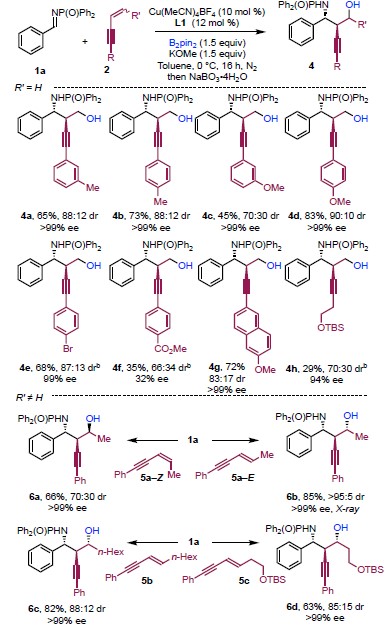
以亚胺1a、1,3-烯炔2a和双频那醇硼烷为模板底物,作者对催化剂、溶剂、碱等反应条件进行反复筛选,确定最佳反应条件(Table 1):10 mol% CuOAc和12mol%手性膦配体L1为催化剂,1.5equivKOMe为碱,THF为溶剂,在室温条件下反应16小时,能以76%的收率、>99%的对映选择性以及>95:5的非对映选择性获得相应高炔丙胺产物3a。
Table 1 优化反应条件
在最优反应条件下,作者首先考察了醛亚胺的底物范围。各种供电子基团或卤素、酯基、三氟甲基等吸电子基团取代对芳醛亚胺或杂环芳香醛亚胺均能较好的适应反应条件,能以良好至优良的收率、优秀的对映选择性和非对映选择性得到相应产物。紧接着,作者考察了1,3-烯炔的底物范围(Scheme 2)。各种供电子芳基取代的1,3-烯炔能较好的适应反应条件,能以良好的收率、优秀的对映选择性以及良好的非对映选择性得到相应产物。吸电子芳基取代的1,3-烯炔反应产物的收率和对映选择性均较高,但非对映选择性差别较大。烷基取代的1,3-烯炔也能反应,其产物的对映选择性较高,但收率较低。同时,作者同样考察了烯烃末端位置有取代基的1,3-烯炔底物的适用性。E-烯炔均能较好的适应反应条件,能以良好的收率、优秀的对映选择性以及良好的非对映选择性得到含三个连续立体中心的手性高炔丙胺类化合物。
Scheme 2 底物扩展
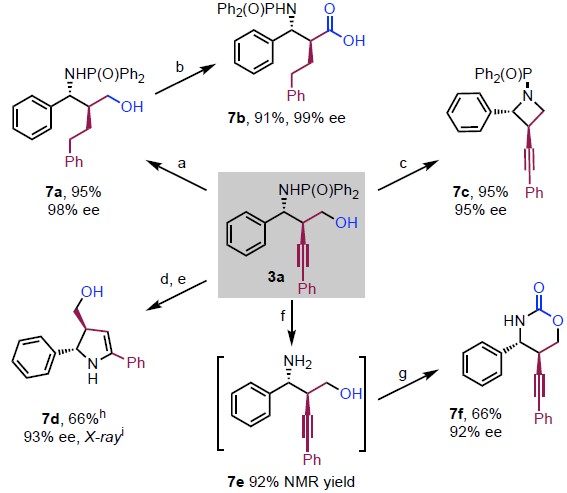
为了证明反应的应用潜力,作者又对相应高炔丙胺产物进行了一系列合成转化(Scheme 3)。3a易被还原为链状烷烃7a,7a又可以氧化为β-氨基酸衍生物7b。在Au/Ag催化剂体系下,3a可转化为氮杂环丁烷7c或2,3-二氢吡咯7d。同时,3a经历脱膦酰基、氨酯化过程可以转化为噁嗪酮7f。
Scheme 3 衍生反应
根据之前的报道以及实验结果,作者推测可能的反应机理(Scheme 4A):首先,LnCuBpin与2a发生硼铜过程化生成中间体A(i)。然后,中间体A经历1,3-金属迁移重排中间体B(ii)。最后,中间体B与亚胺1a发生配位生成手性高炔丙基胺D(iii)。同时,Scheme 4B的结果可以很好地解释反应发生反式立体选择性与对映选择性的原因,即烯基中间体B和亚胺之间的偶联反应只能从亚胺的re面进攻。
Scheme 4 反应机理
论文总结评价
英国Manchester大学Procter课题组报道了Cu和手性膦配体催化亚胺、1,3-烯炔和双硼烷的三组分不对称偶联反应,可以良好至优秀的收率、优秀的对映选择性以及良好至优秀的非对映选择性得到一系列含两个或三个相邻手性中心的手性高炔丙基胺类化合物。同时,通过一系列简单的合成转化,手性高炔丙基胺类化合物可转化为重要的β-氨基酸衍生物与N-杂环化合物。
参考文献
- [1] X. Y. Bai, Z. X. Wang, B. J. Li, Angew. Chem. Int. Ed. 2016, 55, 9007. DOI:10.1002/anie.201601792
- [2] S. J. T. Jonker, C. Diner, G. Schulz, H. Iwamoto, L. Eriksson, K. J. Szabó, Chem. Commun. 2018, 54, 12852. DOI:10.1039/C8CC07908K
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.