作者:石油醚
导语:
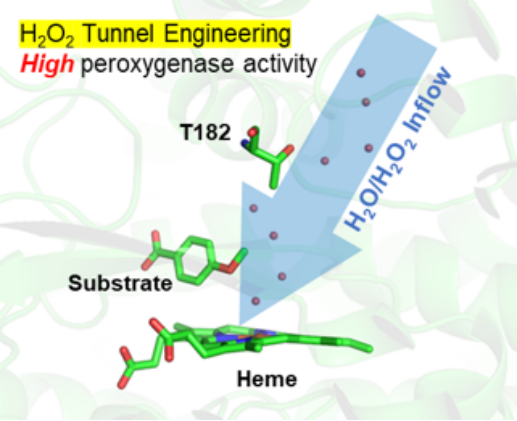
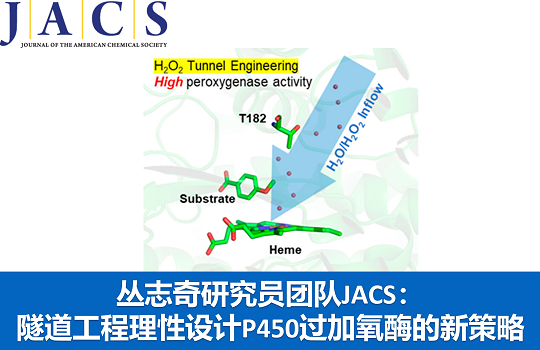
近日,中国科学院青岛生物能源与过程研究所丛志奇研究员团队通过理性设计P450酶的水分子隧道(water tunnel)来促进过氧化氢(H2O2)进入其内部血红素活性中心,成功将两种NADH依赖型P450单加氧酶(CYP199A4和CYP153AM.aq)改造为具有高催化活性的P450过加氧酶,并且成功应用到双功能小分子协同P450BM3过加氧酶体系。隧道工程有望成为一个将P450单加氧酶改造为过加氧酶的普适性新策略,该成果于近期发表于J. Am. Chem. Soc.上。
“Enabling Peroxygenase Activity in Cytochrome P450 Monooxygenases by Engineering Hydrogen Peroxide Tunnel.
Panxia Zhao,† Fanhui Kong,† Yiping Jiang,† Xiangquan Qin, Xiaoxia Tian, and Zhiqi Cong*.
J. Am. Chem. Soc.2023,ASAP.DOI 10.1021/jacs.3c00195.”
正文:
细胞色素P450单加氧酶是自然界中最重要的多功能生物氧化催化剂之一,广泛参与药物代谢、天然产物合成、异源物质降解和甾体激素的生物合成,并且其对极具挑战性的惰性碳-氢键选择氧化反应具有优异的催化能力。大多数P450单加氧酶要通过复杂的氧化还原体系实现其催化功能,导致其实际应用受到一定的限制。利用H2O2代替O2将P450单加氧酶改造为过加氧酶,被认为是开发简单实用型P450生物催化剂的有效途径,但是绝大多数P450单加氧酶利用H2O2进行催化反应仅有极弱、甚至没有催化活性。
近年来,青岛能源所丛志奇研究员团队致力于P450过加氧酶的分子设计和创制,在国际上首次提出双功能小分子协同P450酶催化概念,成功将P450单加氧酶改造为能高效利用H2O2的P450过加氧酶(Angew. Chem. Int. Ed. 2018, 7628 Very Important Paper),并通过合作阐明了双功能小分子协同P450过加氧酶的结构基础和催化机理(ACS Catal. 2021, 8774)。研究人员进而结合蛋白质工程技术,先后开发出了H2O2驱动的P450丙烷羟化酶(ACS Catal. 2019, 7350)、高度R-对映选择性的P450苯乙烯环氧化酶(Chem. Sci. 2021, 6307)、高效P450过氧化物酶(ACS Catal. 2021, 8449)、碳-氢键的区域和立体多样性羟化P450工程酶(Angew. Chem. Int. Ed. 2023, e202215088. Hot Paper)、不饱和烃直接硝化的P450硝化酶(Angew. Chem. Int. Ed. 2023, e202217678.)。但是研究人员发现需要高出底物浓度数倍的H2O2才能实现高催化活性,这对更具实用性P450酶催化剂的开发提出了新的挑战。
另外,研究人员利用定点突变、定向进化和双功能小分子策略(图1)将P450单加氧酶改造为过加氧酶,将过加氧酶与天然过氧化物酶的结构比对分析发现:天然过氧化物酶的血红素活性中心更多的暴露于蛋白表面,或者有较为开放的底物通道与蛋白表面相通,所以H2O2分子能够更容易到达活性中心。相反,烟酰胺辅因子NAD(P)H依赖型P450酶的活性中心大都深埋在蛋白内部,H2O2分子可能不容易通过疏水性底物通道进入活性中心,导致工程化P450过加氧酶在进行催化反应时通常需要高浓度的H2O2。
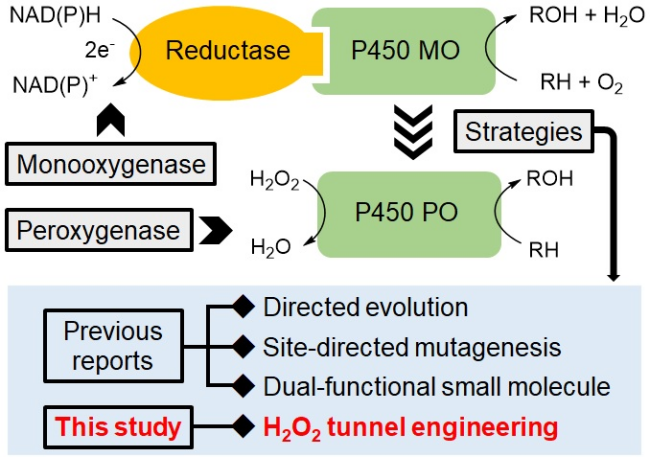
Figure 1. Schematic diagram of NAD(P)H-dependent P450 monooxygenases and H2O2-driven P450 peroxygenases and strategies for modifying P450 monooxygenase into its peroxygenase mode.
鉴于P450酶结构中存在连接蛋白表面与活性中心的H2O分子隧道(water tunnel),研究人员提出通过P450酶的水隧道设计来促进H2O2进入其内部血红素活性中心,增强P450过加氧酶的催化活性。研究人员利用Caver web 1.0预测出P450酶血红素活性中心与溶剂环境之间的水隧道,通过计算分析鉴定出可能影响H2O2流入活性中心的隧道入口或瓶颈处的关键氨基酸,结合定点突变和多轮反应筛选,成功将P450单加氧酶改造为工程化的P450过加氧酶。
首先,研究人员利用隧道工程对来自Rhodopseudomonas palustris HaA2 NADH依赖的CYP199A4进行研究。结果表明H2O分子隧道瓶颈或入口的关键氨基酸P90、F298和F182的突变有较优催化性能(图2A),F182A催化4-甲氧基苯甲酸O-脱甲基化活性相比野生型提升了163倍(图2B),其催化转化数(TON)为980µM(µM P450)-1。随后,研究人员将有益突变体进行组合突变,发现双突变F182A/P90A的TON达到1100µM(µM P450)-1(增加183倍)(图2B)。
在上述基础上,研究人员为了进一步验证该策略的普适性,将上述策略应用于来自Marinobacter aquaeolei 的NADH依赖的CYP153AM.aq。结果表明:与野生型相比,相同隧道内的关键氨基酸D226、D310和V456催化月桂酸的羟化活性提升至13倍以上(图2D-2E),将上述关键氨基酸进行组合突变,发现双突变体D266A/V456A和D266T/V456G的TON分别提高至161µM和167µM(µM P450)-1,比WT提高15倍(图2E)。
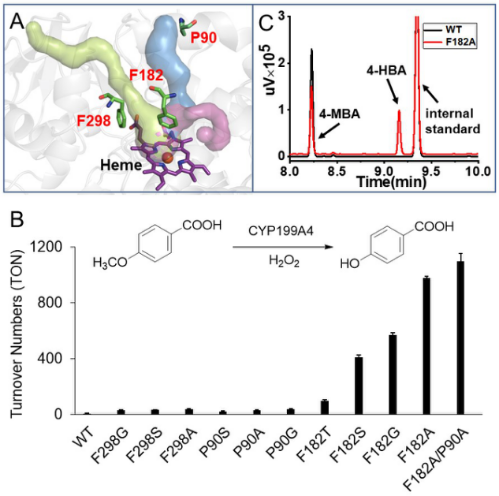
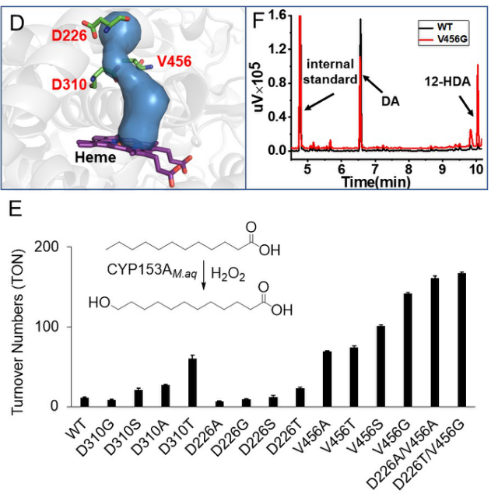
Figure 2. Engineering the peroxygenase activity of CYP199A4 and CYP153AM.aq.
后续,为了探究隧道工程提高P450过加氧酶活性的催化机制,研究人员分别解析了高分辨率的CYP199A4 F182T 和与4-甲氧基苯甲酸的晶体结构(图3A)。与早期研究的CYP199A4突变体如244D、D251N和T252A (PDB: 7N60、5KYD和5KDZ)相比,在CYP199A4 F182T活性口袋内观察到四个新的水分子(w1-w4),并与F182T周围的水分子(w5-w8)形成一条通往血红素活性中心的隧道,并且F182T导致D251侧链向血红素活性中心发生翻转,与活性中心的水分子形成氢键网络,促进H2O2的活化。另外,对于CYP153AM.aq V456A与月桂酸的晶体结构,其对应水隧道的水分子比WT多了5个,进而再次证明了水隧道工程策略的确有利于水或过H2O2进入活性中心,有力支持了最初的假设。
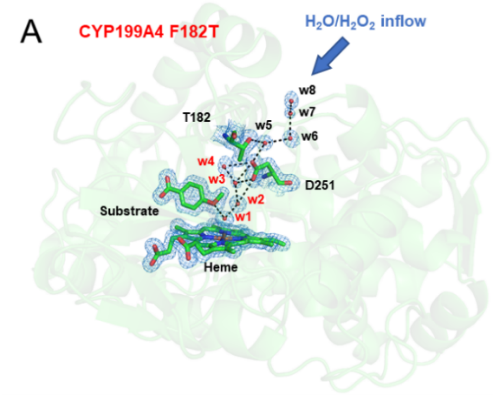
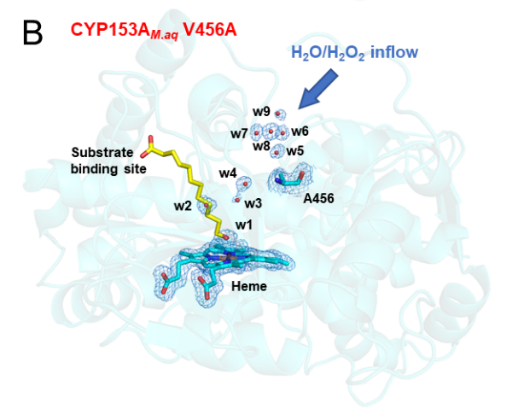
Figure 3. (A) Active site of CYP199A4 F182T and 4-MBA (PDB: 8HGC), where hydrogen bonds are drawn as black dashed lines; (B) Active site of CYP153AM.aq V456A (PDB: 8HGT), where the substrate binding site is indicated with a yellow stick model of the product molecule based on a solved structure containing the product 12-HDA (PDB: 5FYG).
最后,研究人员将隧道工程策略与双功能小分子协同P450BM3过加氧酶体系相结合,选用吲哚为模式反应,以F87G/T268V (GV) 为父本酶,筛选获得关键氨基酸D182G和L272S(图4A)。结果显示:相比GV,GV/D182G和GV/L272S的催化活性分别提高了114%和153%,两个优势突变体同样对苯乙烯环氧化、乙苯羟化和苯甲硫醚亚磺化底的催化活性显著提高(图4C)。其中GV/L272S将H2O2浓度降低至接近天然过加氧酶水平,其催化吲哚生成产物所需H2O2浓度被降低了95%以上,H2O2与产物的耦合效率达到95%。此外,研究人员利用Caver分析了21B3的父本酶P450BM3 F87A的水隧道,结果发现21B3中4个突变位点位于水隧道的瓶颈处(图4B)。进而再次证明了水隧道工程策略可促进P450过加氧酶活性。
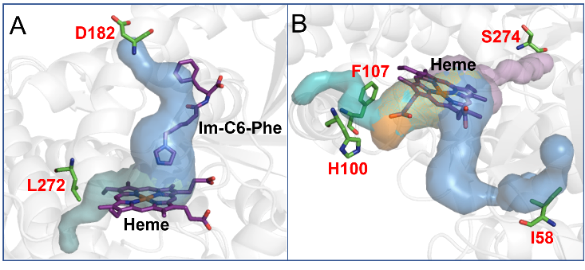
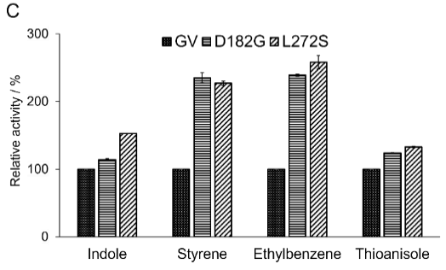
Figure 4. Engineered water tunnels improve the catalytic activity of DFSM-facilitated P450BM3 peroxygenase.
总结:
本研究提出了基于隧道工程将P450单加氧酶改造为过加氧酶的新策略,该策略成功应用于NADH依赖的天然P450单加氧酶(CYP199A4和CYP153AM.aq)和双功能小分子促进的P450BM3过加氧酶,并且进一步增强其过加氧酶活性。有望为人工P450过加氧酶高效利用H2O2提供一种有前景、可推广的策略,进一步拓展了P450在合成化学和合成生物学中的应用范围。
该工作由青岛能源所博士生赵盼霞、孔繁慧和姜谊平博士共同完成,为论文共同第一作者,青岛能源所丛志奇研究员为通讯作者。本研究得到国家自然科学基金和国家重点研发计划项目的大力支持。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载




















No comments yet.