本文作者:有机小白
导读
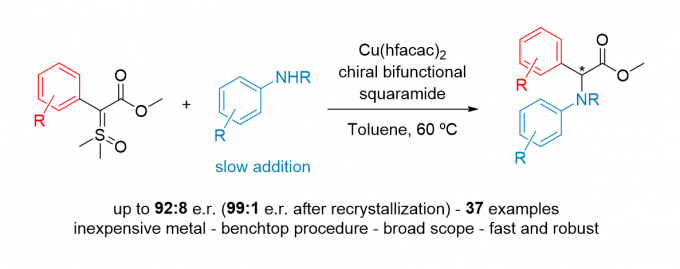
近日,巴西圣保罗大学Burtoloso课题组在Chemical Science上发表文章,报道了首例硫叶立德高对映选择性卡宾介导的插入反应。利用铜-双功能方酰胺协同催化羰基亚砜叶立德与苯胺的不对称N-H插入反应,以49-96%的产率、对映体比例高达92:8(一次重结晶后提高到99:1)合成了37种α-芳基甘氨酸酯。此外,该反应具有快速、直接等优点。
Cooperative copper-squaramide catalysis for the enantioselective N-H insertion reaction with sulfoxonium ylides
Lucas G. Furniel, Radell Echemendía and Antonio C. B. Burtoloso*
Chem. Sci. 2021, ASAP. DOI: 10.1039/d1sc00979f.
正文
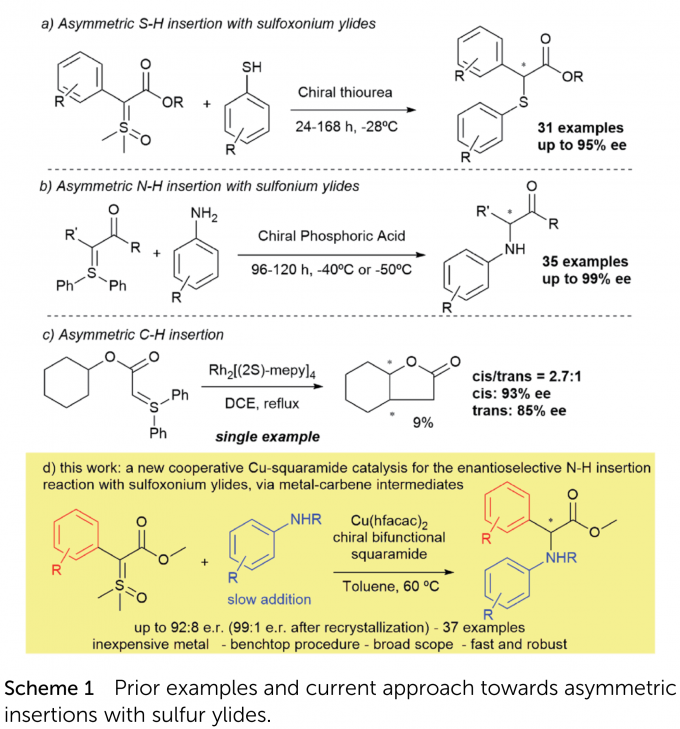
非天然氨基酸是一类特别重要的分子,因其具有多样的生物活性,广泛存在于药物中。此外,非天然氨基酸还被用作通用的合成子来制备各种含氮化合物特别是用于肽的合成。其中,芳基甘氨酸是一类特殊的构筑砌块,存在于多种生物活性分子中,如抗生素、农药、蛋白激酶C激活剂和登革热病毒抑制剂。如何高效构建非天然氨基酸,已经引起了化学家的广泛关注。重氮化合物的不对称N-H插入反应是合成对映体富集的非天然氨基酸最直接的方法之一。这一策略在过去的十五年中得到了发展和完善,各种重氮化合物和氮亲核试剂可以高对映选择性地组合反应。如2019年,周其林院士课题组报道了这一领域的一项最新研究(Science 2019, 366, 990-994),即在铜(I)-蝎型配合物与光学活性硫脲的组合催化下,重氮酯与强配位的脂肪胺发生高对映选择性反应。尽管取得了巨大进步,但是到目前为止所描述的每种催化体系仍然只对特定的底物组合有效。例如,获得高对映选择性α-芳氨基苯甘氨酸衍生物的不对称反应尚未报道。此外,尽管多功能的重氮化合物在学术界有着广泛的用途,但因其热稳定性差、氮气的释放以及重氮甲烷(合成某些重氮化合物所必需的一种试剂)的毒性,导致重氮化合物在工业上的利用率仍然较低。因此,寻找可行的、更安全的试剂来替代这些十分普遍的合成底物,特别是在大规模制备中,是迫切需要的。在过去几年中,硫叶立德由于其强的热稳定性和类似的反应性(例如作为卡宾前体)而成为重氮羰基化合物的潜在替代物。虽然这些研究已经实现,但与重氮化合物相比,特别是在卡宾介导的N-H插入反应,它们在对映选择性催化转化中的应用还处于起步阶段。
1993年,Baldwin报道了铑催化的亚砜叶立德的X-H插入反应的开创性研究,之后21世纪初,默克公司的Mangion报道了铱或金催化的此类反应。Mangion的贡献在于发展了第一个使用亚砜叶立德进行卡宾反应的通用催化剂,并且可以在工业上进行放大。优先使用亚砜叶立德替代锍叶立德,是因为在大多数情况下,亚砜叶立德的稳定性更好,制备更简单,并且释放出亚砜(通常是二甲基亚砜)而不是硫醚(二甲基或二苯硫醚)。最近,巴西圣保罗大学Burtoloso课题组报道了使用廉价易得的铜(II)也能有效地与硫叶立德进行N-H插入反应。
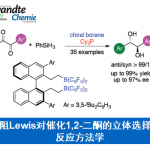
尽管做出了这些重要贡献,但是前两种对映选择性X-H插入反应是去年才报道的,且第一个是作者课题组与Mattson课题组合作发展的,即手性硫脲催化的亚砜叶立德和芳基硫酚的不对称S-H插入反应(Scheme 1a);第二个是孙建伟课题组报道的手性磷酸催化苯胺和锍叶立德的N-H插入反应(Scheme 1b)。这两种反应具有相同的机理:硫叶立德不对称质子化,然后发生亲核取代,并没有金属卡宾中间体介导。事实上,除了Müller课题组在1999年报道的工作(只有一例,且仅有9%的收率;Scheme 1c)外,还没有关于任何类型的硫叶立德发生卡宾介导对映选择性插入反应。
在此,巴西圣保罗大学Burtoloso课题组报道了首例使用硫叶立德作为金属卡宾前体,具有高产率和高达92:8对映选择性(重结晶后99:1)的反应(Scheme 1d)。利用手性方酰胺和六氟乙酰丙酮铜的组合催化体系,合成了37个α-芳氨基芳基甘氨酸衍生物,其中许多具有很高的对映选择性。此外,该方法操作简便,反应快速,非常容易得到这些有价值的化合物。
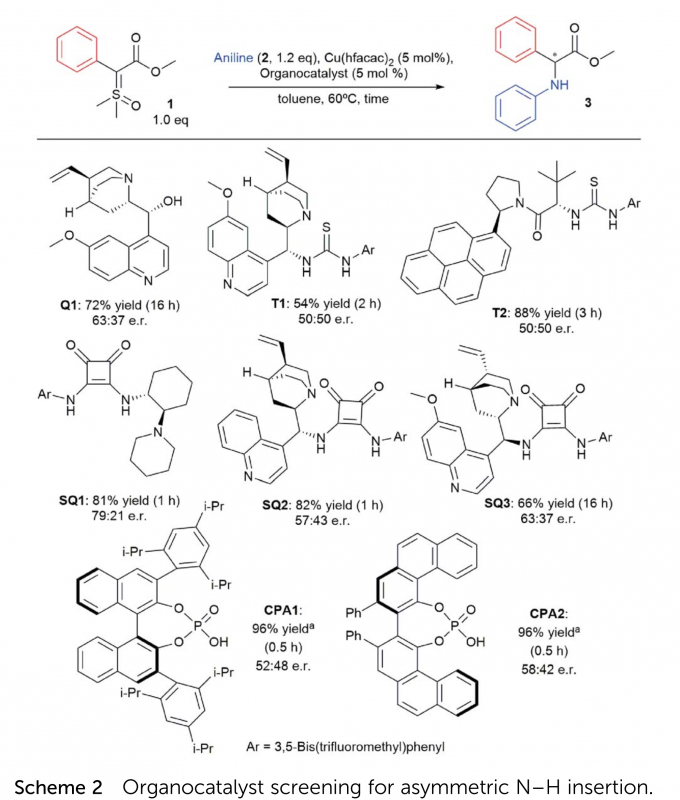
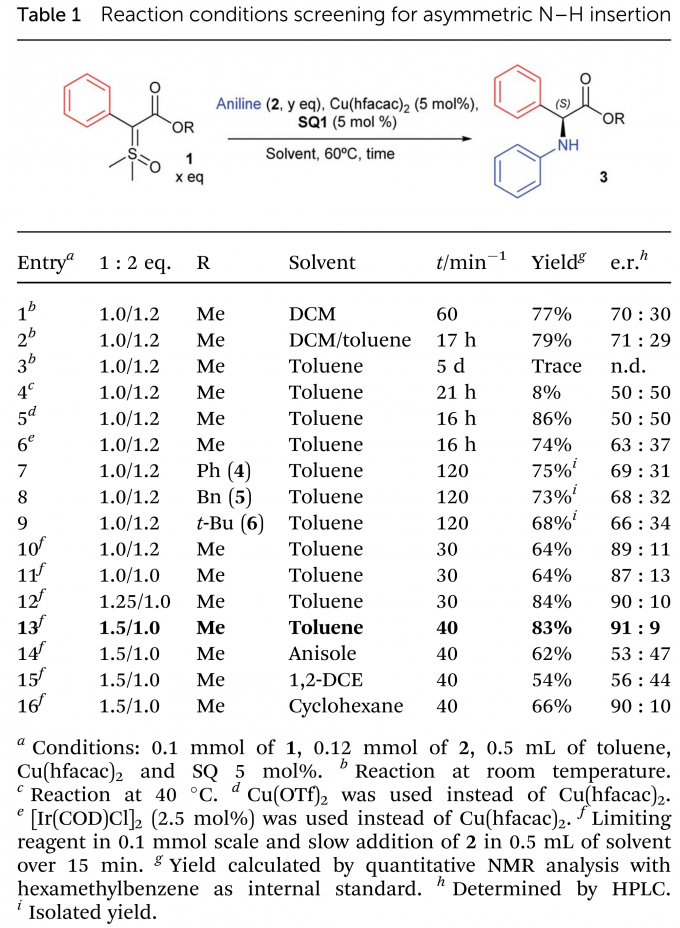
首先,作者将含苯基的亚砜叶立德1与苯胺2作为模板底物,进行了催化剂的筛选(Scheme 2)以及其他条件的优化(Table 1)。最终反应条件确定为:1:2 = 1.5:1.0,Cu(hfacac)2与SQ1作为催化剂,溶剂为toluene,加热60 °C反应40 min,以83% yield和91:9 e.r.得到了目标产物3。
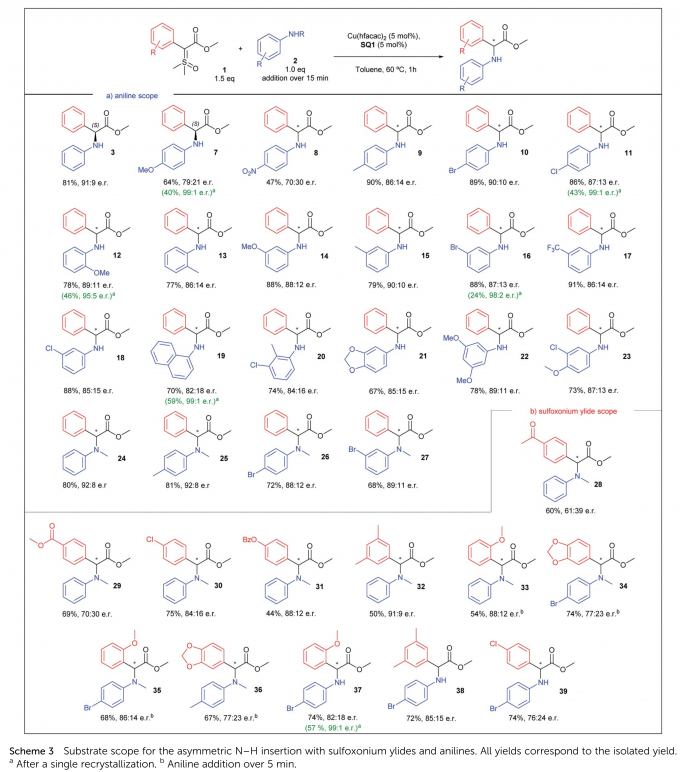
之后,作者在最优反应条件下进行了底物拓展(Scheme 3)。对于苯胺底物(Scheme 3a),中等至强给电子、吸电子对位取代基的产物对映选择性较低,其他取代基均在70% ee以上。邻位取代基取得了良好的收率与86:14 e.r.以上的对映选择性。同样地,间位取代基的产物e.r.均在85:15以上。1-萘胺与二取代、三取代的苯胺以及各种取代的N-甲基苯胺也没有发生e.r.的明显降低。
对于亚砜叶立德底物(Scheme 3b),中等至强吸电子取代基的产物对映选择性较低,p-Cl、p-OBz、3,5-二甲基与o-OMe取代的产物e.r.良好。叶立德与苯胺均有取代基的产物对映选择性没有进一步提高。当使用4-溴苯胺时,e.r.得到明显提升。
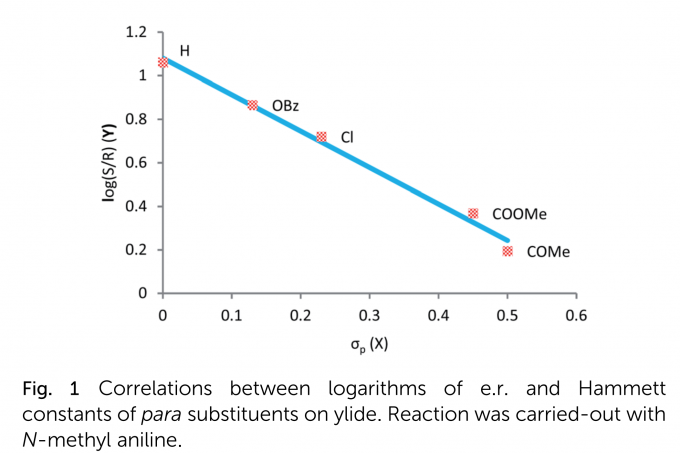
为了研究叶立德底物取代基性质与对映体比例(e.r.)的关系,作者绘制了Hammett线形图(Fig. 1)。该图表明,叶立德上取代基的性质与e.r.的对数呈线性相关。其中,吸电子基会导致较低的对映选择性,而给电子基倾向于产生更高的对映选择性。但是,含有中等至强给电子基的叶立德底物的合成与分离是非常具有挑战性的,作者课题组还有其他课题组均没有合成得到。
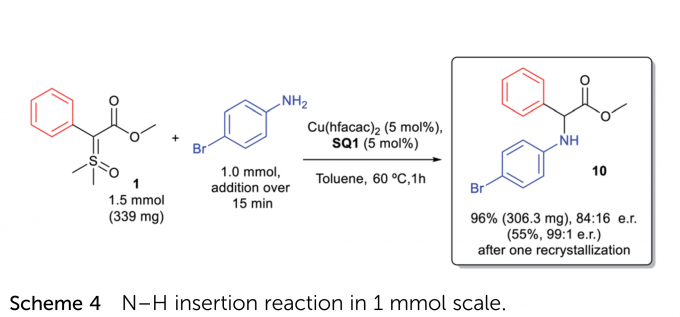
者进行了放大反应,以优异的收率(96%)与略微下降的对映选择性(84:16 e.r.)得到了目标产物10,但是重结晶后对映选择性可提高至99:1 e.r.。
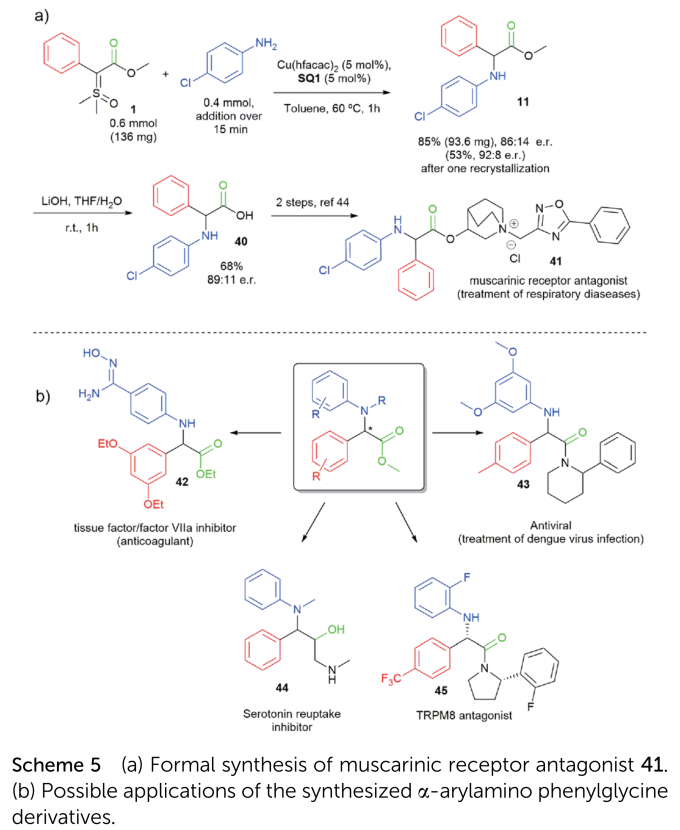
为了证明该反应的合成应用潜力以及合成α-芳氨基苯甘氨酸衍生物的重要性,作者进行了毒蕈碱受体拮抗剂41的简短形式合成(Scheme 5a)。此外,一系列生物活性分子可通过该反应产物转化得到(Scheme 5b)。
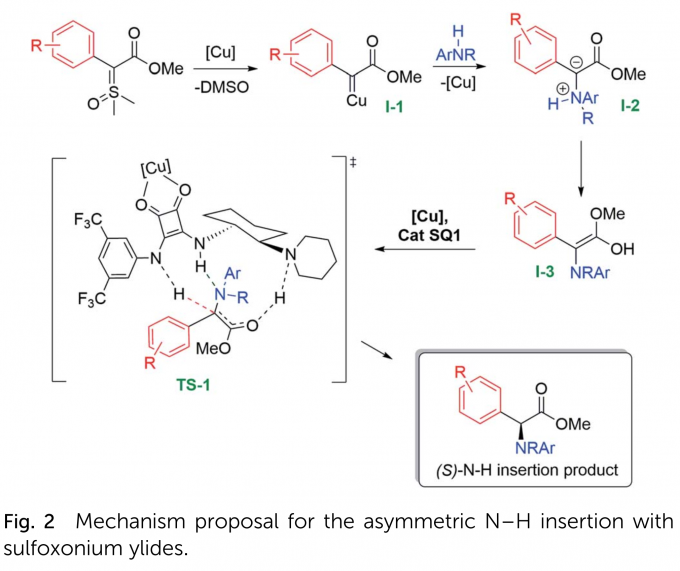
作者提出了可能的反应机理(Fig. 2)。首先,亲核性叶立德进攻铜配合物,在释放DMSO后形成铜卡宾中间体(I-1)。这种亲电性金属卡宾随后受到苯胺的进攻,形成铵叶立德中间体(I-2)。该中间体发生互变异构生成自由的烯醇(I-3),它易与铜-双功能方酰胺配合物发生作用经历过渡态TS-1。铜与方酰胺羰基配位后,有机催化剂N-H质子的酸性增强,然后烯醇中间体发生不对称质子化,生成对映体富集的(S)-N-H插入产物。
总结
巴西圣保罗大学Burtoloso课题组报道了首例硫叶立德作为金属卡宾前体的高对映选择性催化反应。通过简单直接的方法合成了37个芳基甘氨酸,其中铜盐和手性方酰胺协同催化该不对称N-H插入反应,具有很好的对映选择性。该方法也可应用于毒蕈碱受体拮抗剂的形式合成。





















No comments yet.