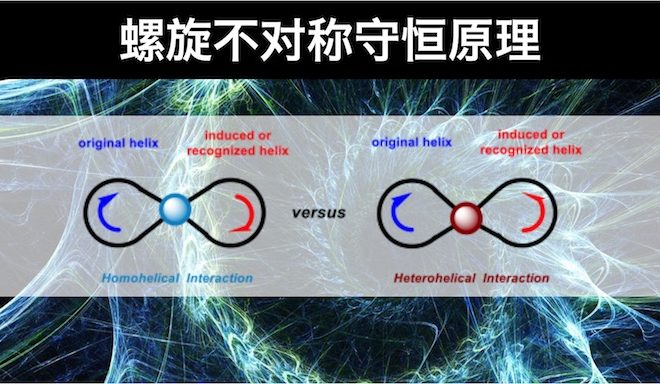
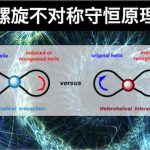
在 (一) 和 (二)文章中,小编着重介绍了螺旋不对称守恒的基本概念、理论与螺旋特性的判断。本篇文章中小编重点介绍如何应用螺旋不对称守恒原理解释对映选择性反应所得产物的绝对立体化学。
反应实例
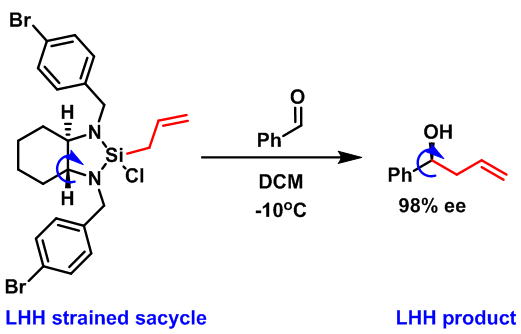
- Leighton 烯丙基化
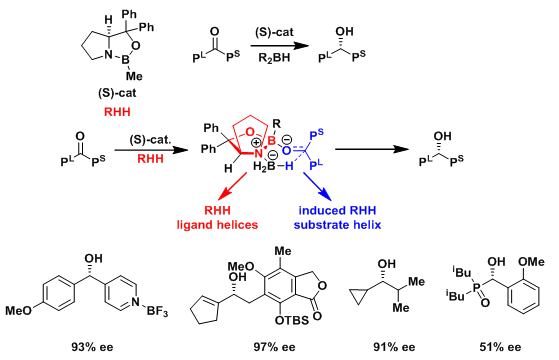
2.CBS还原
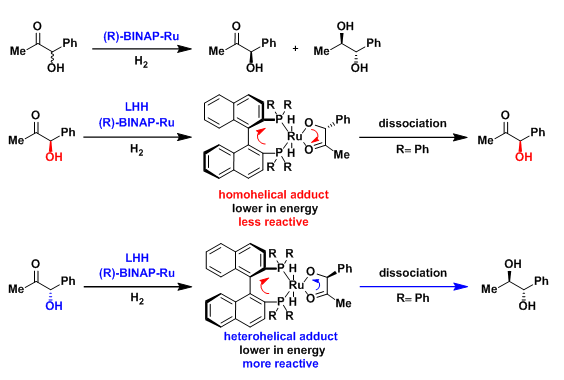
3.不对称共轭加成
在通过具有右手螺旋特性的手性Ru催化剂参与的α,β-不饱和酮与芳基硼酸间的Hayashi-Miyaura反应中,在关键的钌碳化步骤中,Ru催化剂由顶面靠近α,β-不饱和酮中的烯键,使底物满足与手性Ru催化剂之间的螺旋特性匹配。最终,通过Ru催化剂中心的还原消除,获得具有较高ee% 手性产物。
- 动力学拆分
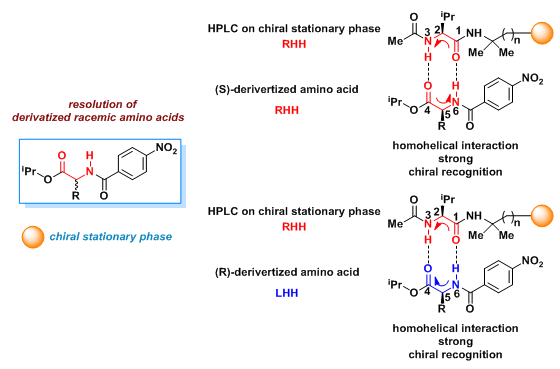
5.手性色谱
该理论将手性色谱中的手性识别归结为同螺旋相互作用。如下图所示,通过手性固定相对衍生化的外消旋氨基酸17进行拆分,如果分子间通过之前提出的双重氢键机理发生相互作用,手性固定相中涉及的螺旋O=C1-C2-N3H为RHH,因为围绕C2的基团的极化性顺序为: O=C1> N3,同时 i-Pr>H。(S)-17中的螺旋O=C4-C5-N6H同样为RHH,因为R1基团的极化性总是高于H,而(R)-17中的螺旋O=C4-C5-N6H则为LHH。由于(S)-17在手性固定相中的相互作用为有利的同螺旋相互作用,因此,具有更长的保留时间。
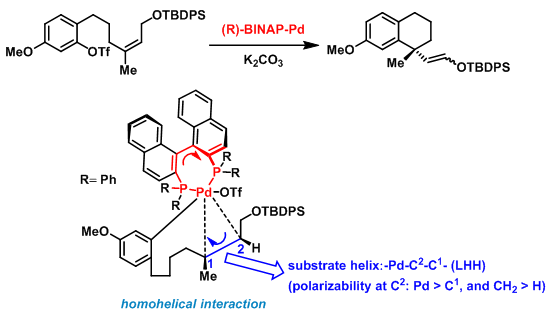
- 不对称Heck-Mizoroki 反应
双键的对映面通过与左手螺旋催化剂的同螺旋相互作用进行识别:只有在Pd催化剂由双键的底面进攻时,底物环的螺旋体系才可能实现同螺旋相互作用(底物环螺旋特性的产生很大程度上源自C2 的手性; 位于C1中心的取代基,即 CH2 与CH3间的极化性差异较小,对同螺旋不对称诱导的贡献较小)。
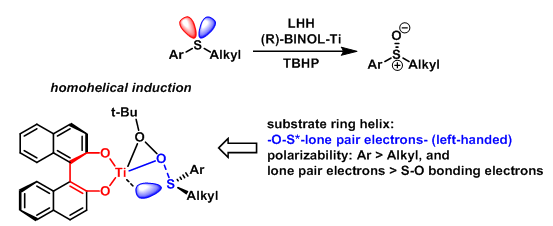
- 硫醚的不对称氧化
该反应的对映面选择性同样受到同螺旋诱导的控制。较为有趣的是,该反应通过亚砜的串联不对称诱导-动力学拆分过程进行:反应最初可获得的~50%ee的手性亚砜产物,最后通过动力学拆分获得较高ee的产物(>99%ee)。两步过程均通过同螺旋识别机理进行。
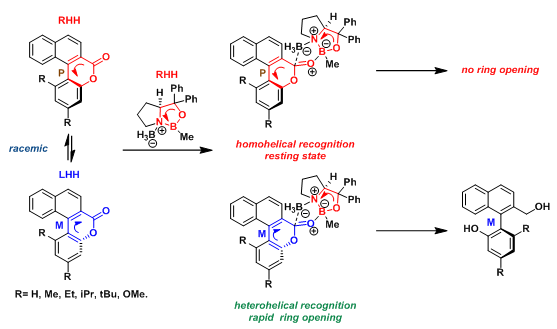
- 动态动力学拆分
构型活性的(S)-CBS催化剂参与的通过对映选择性开环反应进行的联芳内酯的动态动力学拆分同样通过同螺旋识别控制。采用的催化剂为右手螺旋,与其螺旋特性相反的对映体形成异螺旋识别,随后,迅速开环,获得具有较高ee%与产率的(M)-异构体。
- 立体效应无法解释的实例
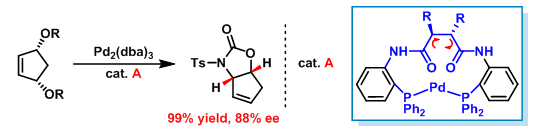
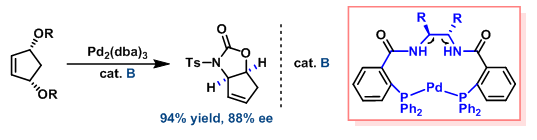
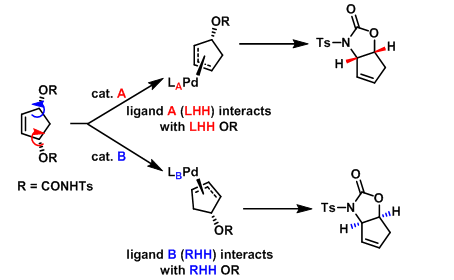
(1)在烯丙醇衍生物的催化不对称去对称化反应中,所用的两种环钯催化剂具有相同绝对构型。然而,获得产物的绝对构型却截然相反,立体效应的理论无法给出满意的解释。根据螺旋不对称守恒的原理,可以很容易地看出两种催化剂A与B具有不同的螺旋特性。由于催化剂与底物间的相互作用需要满足螺旋特性上的匹配,因而,所得产物的绝对构型相反。
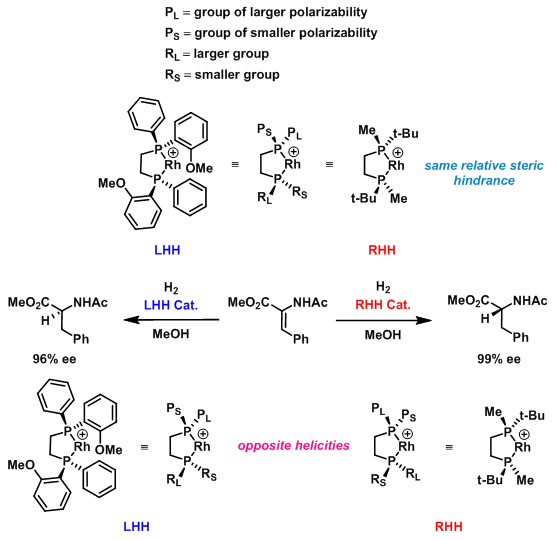
(2)下面的两种具有相同立体位阻的催化剂,根据立体效应模型的预测,在不对称氢化中应该获得相同的产物,然而,实际上却获得相反的不对称诱导结果, 立体效应模型难以给出合理的解释。而同螺旋相互用模型可以准确地预测上述反应结果(因为可极化性顺序为:Me>t-Bu>PhOMe>Ph)。
参考文献
- X. Xing, Y. Zhao, C. Xu, X. Zhao, D.Z. Wang, Tetrahedron, 2012, 68, 7288. doi: 10.1016/j.tet.2012.06.102.
- W. H. Pirkle, T. C. Pochapsky, Chem. Rev. 1989, 89, 347. doi: 10.1021/cr00092a006.
- S. Ahuja, Chiral Separations by Chromatography, Oxford University Press, New York, 2000.
- A. Kojima, T. Takemoto, M. Sodeoka, M. Shibasaki, J. Org. Chem. 1996, 61, 4876. doi: 10.1021/jo960773z.
- T. Hayashi, K. Yamasaki, Chem. Rev. 2003, 103, 2829. doi: 10.1021/cr020022z.
- G. Bringmann, T. Hartung, Angew. Chem. Int. Ed. 1992, 31, 761. doi: 10.1002/anie.199207611.
- N. Komatsu, M. Hashizume, T. Sugita, S. Uemura, J. Org. Chem. 1993, 58, 4529. doi: 10.1021/jo00069a009.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.