作者:杉杉
导读:
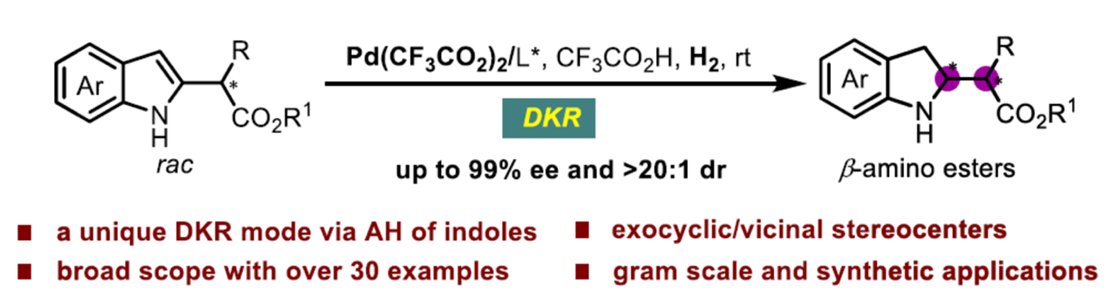
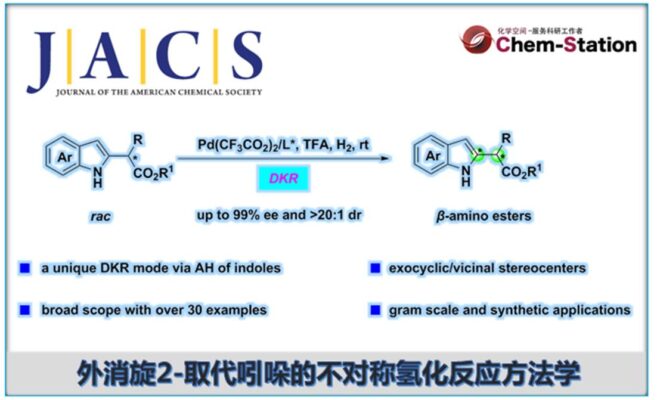
近期,中国科学院深圳先进技术研究院的殷勤课题组在J. Am. Chem. Soc.中发表论文,报道一种全新的钯催化外消旋α-烷基或芳基取代的indole-2-acetates的不对称氢化 (asymmetric hydrogenation,AH)反应方法学,进而成功完成一系列具有环外立体中心的手性吲哚啉分子的构建,涉及酸辅助动态动力学拆分(dynamic kinetic resolution,DKR)的过程。
Asymmetric Hydrogenation of Racemic 2‑Substituted Indoles via Dynamic Kinetic Resolution: An Easy Access to Chiral Indolines Bearing Vicinal Stereogenic Centers
N. Rong, A. Zhou, M. Liang, S. Wang, Q. Yin, J. Am. Chem. Soc. 2024, 146, 5081. doi: 10.1021/jacs.4c00298.
正文:
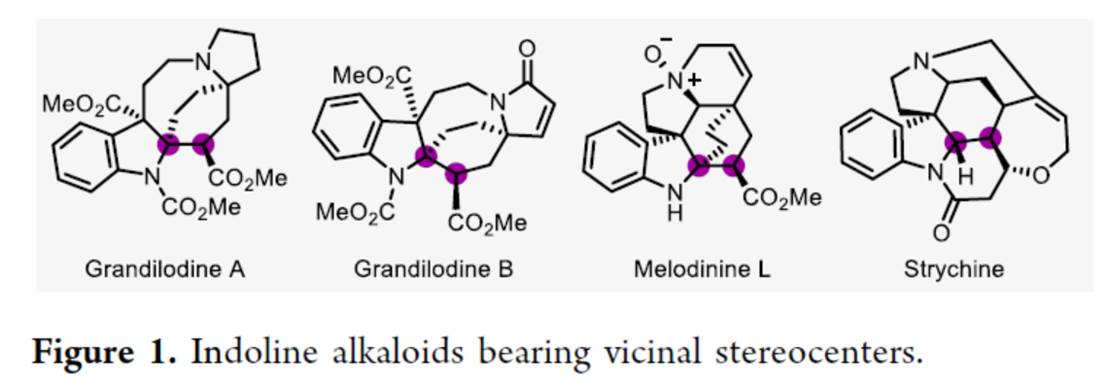
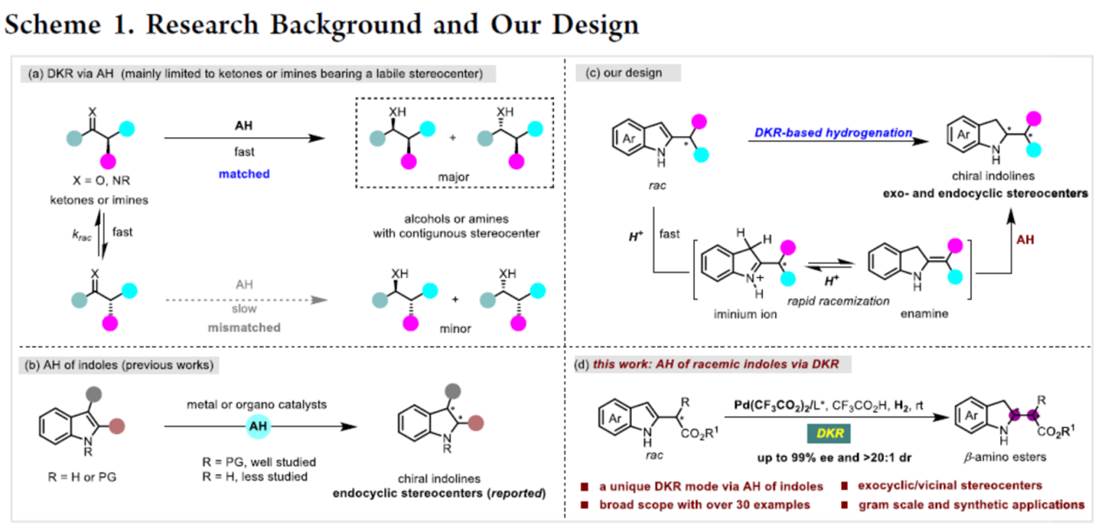
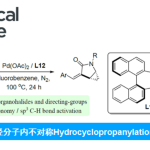
近年来,基于DKR的不对称氢化反应方法学是合成具有连续立体中心的手性醇或胺的重要方法[1](Scheme 1a)。然而,此类反应的底物范围主要局限于可烯醇化的酮或活化的亚胺。同时,与N-保护的吲哚相比,N-非保护吲哚的直接对映选择性氢化反应方法学,目前却较少有相关的研究报道[2],并且主要形成环内立体中心(Scheme 1b)。这里,中国科学院深圳先进技术研究院的殷勤课题组报道一种全新的钯催化外消旋α-烷基或芳基取代的indole-2-acetates的不对称氢化反应方法学,进而成功完成一系列具有环外立体中心的手性吲哚啉分子的构建 (Scheme 1d)。
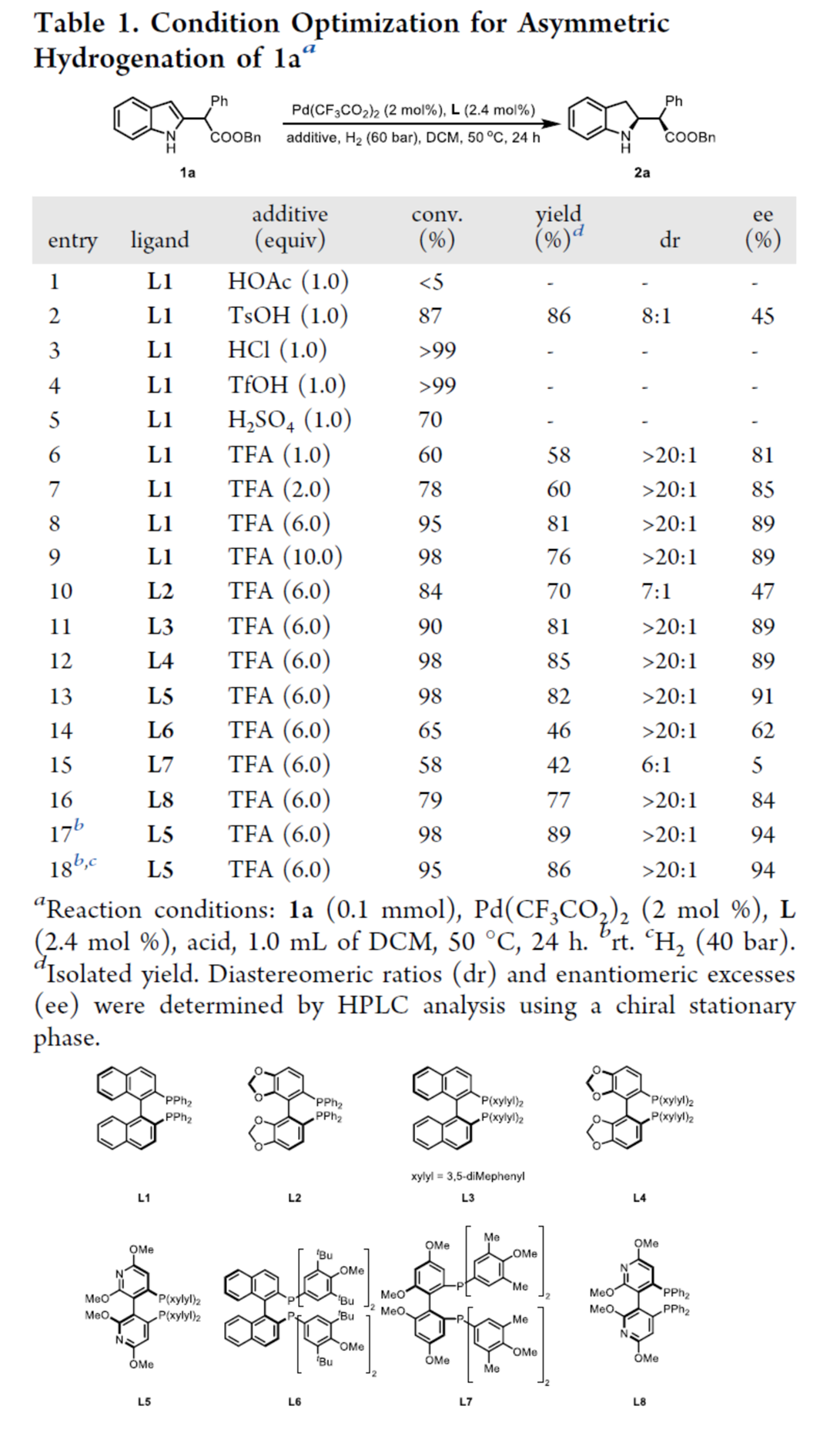
首先,作者采用吲哚衍生物1a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Pd(CF3CO2)2作为催化剂,L5作为配体,TFA作为添加剂,H2 (60 bar)作为还原剂,在DCM反应溶剂中,反应温度为室温,最终获得89%收率的产物2a (>20:1 dr以及94% ee)。
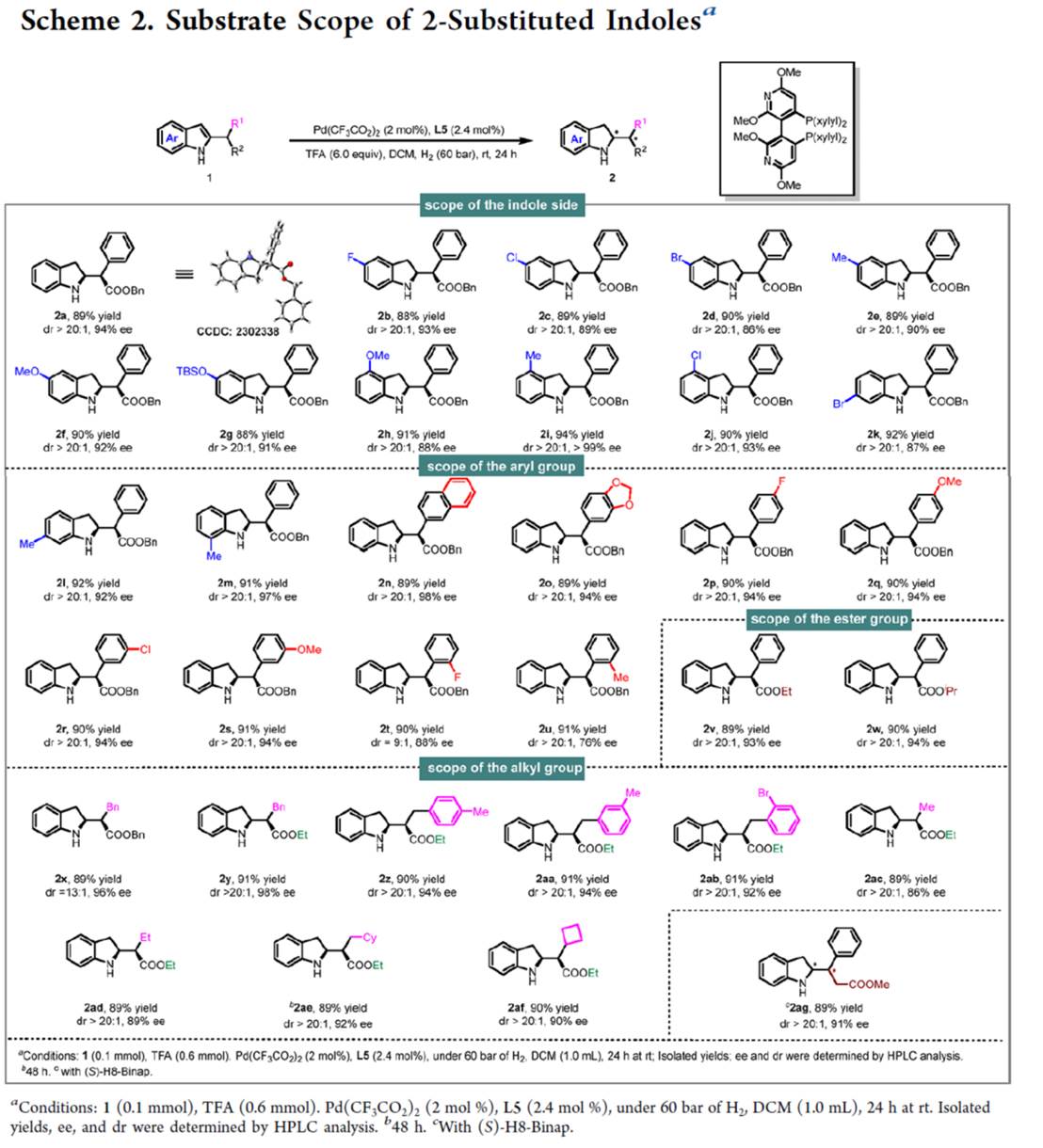
在上述的最佳反应条件下,作者对一系列外消旋2-取代吲哚底物 (Scheme 2)的应用范围进行深入研究。

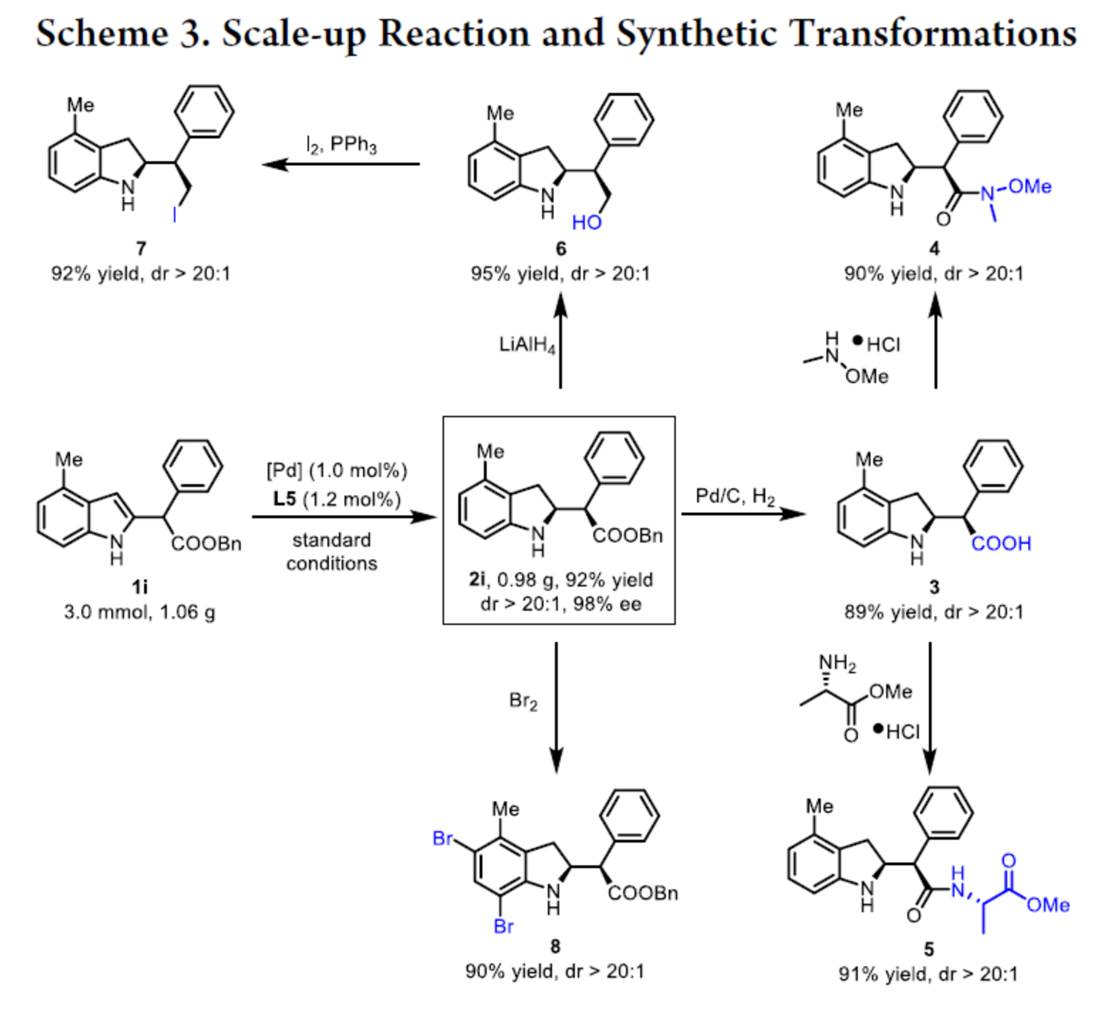
之后,该小组通过如下的一系列研究进一步表明,这一全新的不对称氢化策略具有潜在的合成应用价值 (Scheme 3)。
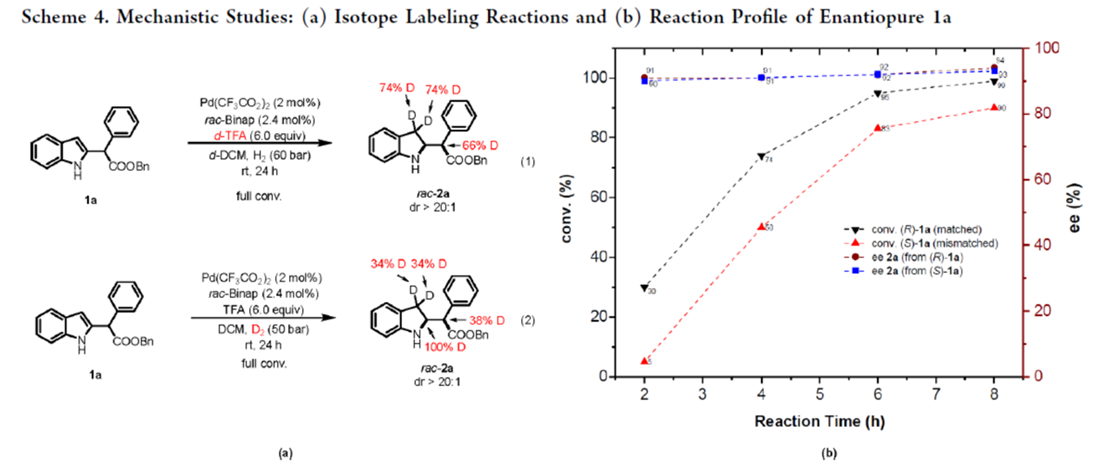
接下来,作者对上述不对称氢化过程的反应机理进行进一步研究 (Scheme 4)。

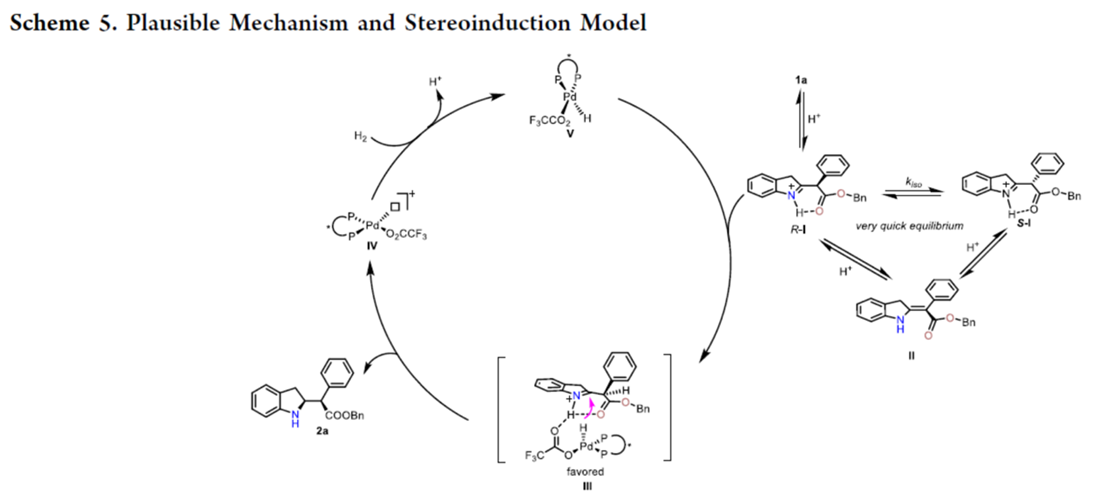
基于上述的实验研究以及前期相关的文献报道[2]-[3],作者提出如下合理的反应机理 (Scheme 5)。
总结:中国科学院深圳先进技术研究院的殷勤课题组报道一种全新的钯催化外消旋α-烷基或芳基取代的indole-2-acetates的不对称氢化反应方法学,进而成功完成一系列具有环外立体中心的手性吲哚啉分子的构建。这一全新的不对称氢化合成转化策略具有底物范围广泛、优良的官能团兼容性以及优异的产率、非对映与对映选择性等优势。
参考文献:
- [1] Z. Zhang, N. A. Butt, W. Zhang, Chem. Rev. 2016, 116, 14769. doi:10.1021/acs.chemrev.6b00564.
- [2] T. Touge, T. Arai, J. Am. Chem. Soc. 2016, 138, 11299. doi:10.1021/jacs.6b06295.
- [3] G. Liu, L. Zheng, K. Tian, H. Wang, L. Chung, X. Zhang, X. Dong, CCS Chem. 2023, 5, 1398. doi:10.31635/ccschem.022.202101643.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.


















No comments yet.