本文作者 孙苏赟
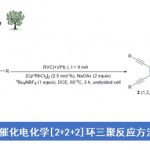
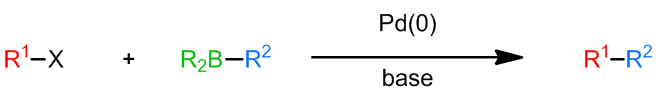 X为卤素,一般为溴或是碘,也可能是三氟甲基磺酸盐,但是也有一些例子中会使用氯代烃参与反应;R1通常是不饱和的芳基,烯基,但是苄基和烯丙基在某些例子中也可以;R2的选择性也很广,可以使烷基、烯基、芳基、苄基、烯丙基和炔基,而对于R’的选择,一般使用烷氧基(硼酸酯)或是羟基(硼酸),也有使用烷基的例子,例如:
X为卤素,一般为溴或是碘,也可能是三氟甲基磺酸盐,但是也有一些例子中会使用氯代烃参与反应;R1通常是不饱和的芳基,烯基,但是苄基和烯丙基在某些例子中也可以;R2的选择性也很广,可以使烷基、烯基、芳基、苄基、烯丙基和炔基,而对于R’的选择,一般使用烷氧基(硼酸酯)或是羟基(硼酸),也有使用烷基的例子,例如: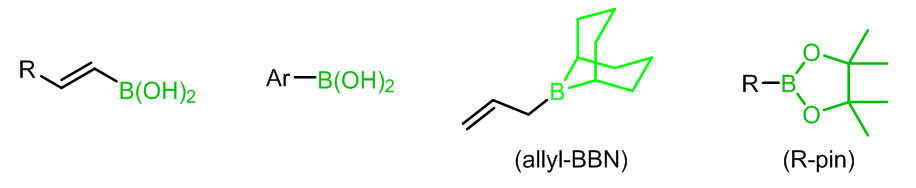
或者将以上的三个例子换成对应的硼酸酯或三氟硼酸钾 (-BF3K)。需要注意的是有一类不可参与Suzuki偶联的硼试剂的特殊例子: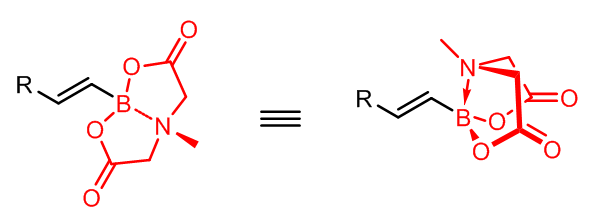
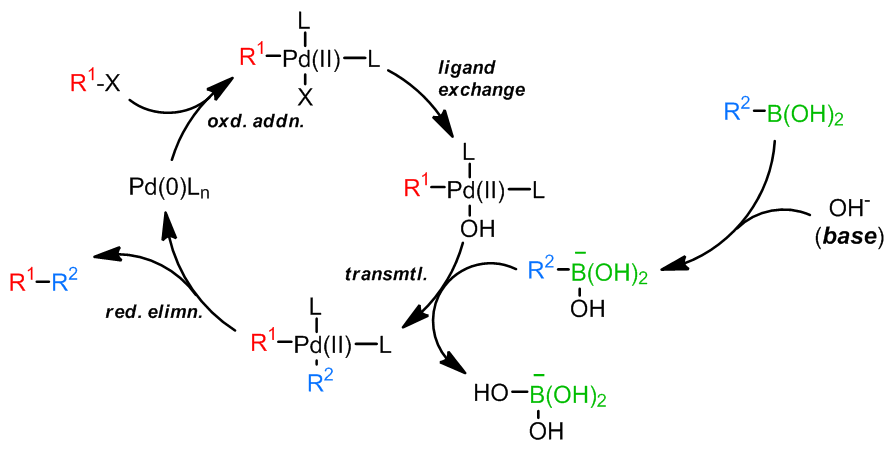
此外,反应中需要碱的参与,一促进发生还原消除反应,可使用的碱可以使碳酸盐,碱金属氢氧化物类,膦类,胺类,甚至是F–也可以作为碱使用;至于核心的催化剂方面,Pd(0)和Pd(II)都有很多可行的例子,Ni(0)也可以作为反应的催化剂。
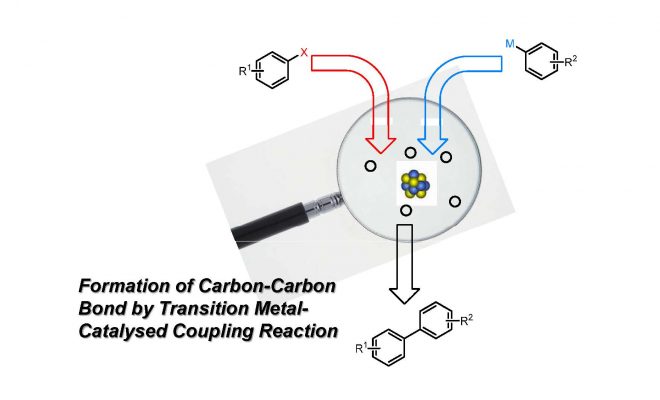
Suzuki反应是一个基于硼试剂的过渡金属催化偶联反应,和Stille反应非常相似。令人欣慰的是,和Stille反应中使用的锡试剂相比,例如硼酸类化合物的硼试剂的毒性大都很低,因而Suzuki反应在实际的合成过程中更加频繁的使用,用于形成新的碳碳键。同时,反应的条件大都十分温和,对于实际操作的要求不是非常高,反应的溶剂有很多种选择,甚至有一些在水中反应的例子。
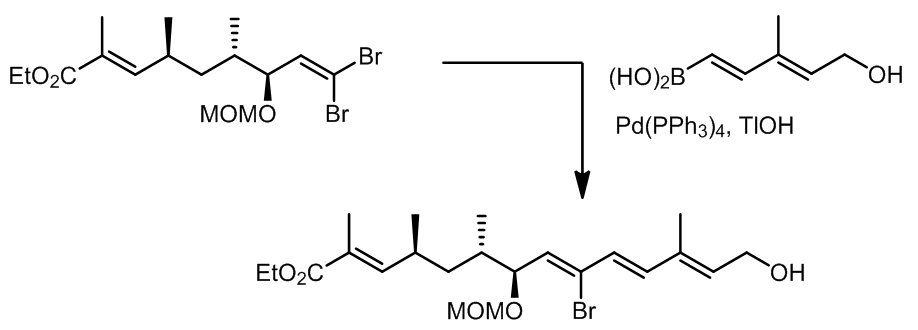
对于乙烯基类的硼试剂,反应中底物和产物的双键构型是一致的,并且Suzuki反应具有很好的官能团兼容性,碱和催化剂种类选择范围很广,因此在实际中的应用很多很广。
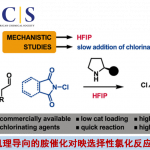
和Stille偶联一样,关于反应机理中转金属化的过程是否会产生 Pd(IV)还是一个具有争议的问题,因为 Pd(IV)对于Pd来说是一个非常不常见的氧化态;此外,在大多数过程中,会有一个四面体硼酸中间体产生,这个中间体的产生对于转金属化步骤是很有利的,可以加快转金属化;普遍认为氧化加成步骤是最慢的步骤,因此造成了它为Sukuzi偶联的决速步骤。烷基-BBN参与的反应中不会发生β-消除,因为还原消除太快了。另外一点,如果反应是Ni(0)催化,那么反应机理会产生自由基中间体。
- 硼试剂的制备
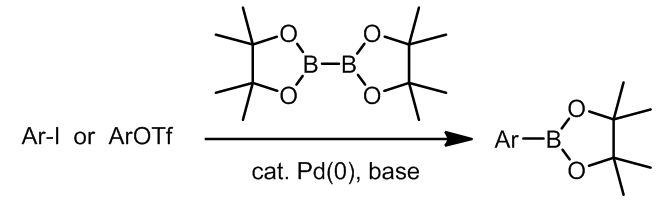
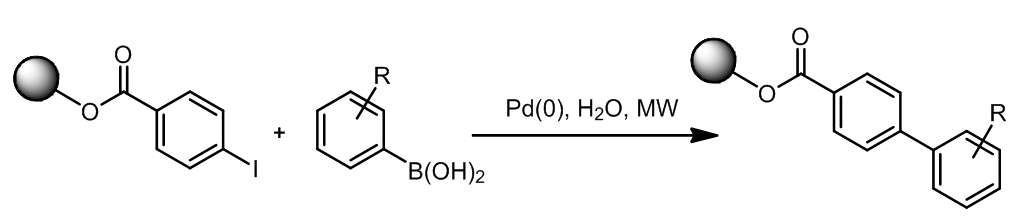
实际上这也是一种Suzuki偶联,许多种双硼试剂现在都是商业化的试剂,这个途径非常方便。这里有一个实际应用:ref. 2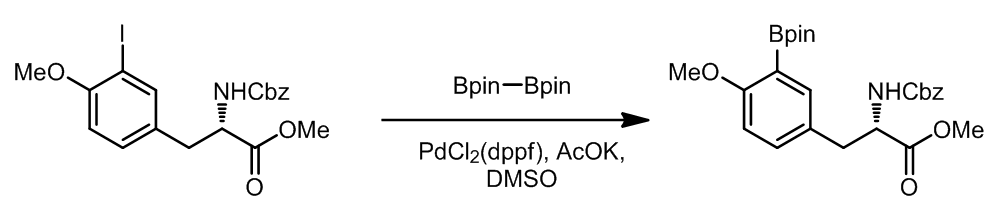
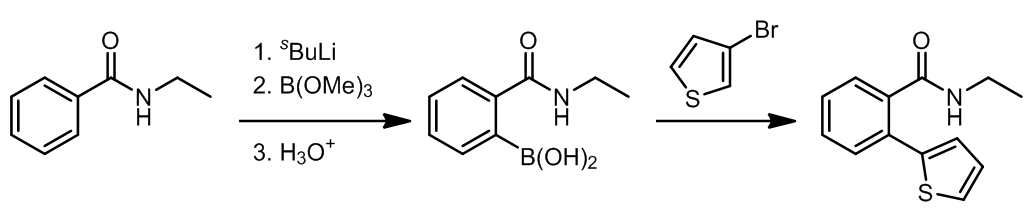
3. 芳基硼酸(酯)和烯基硼酸(酯)的交叉偶联
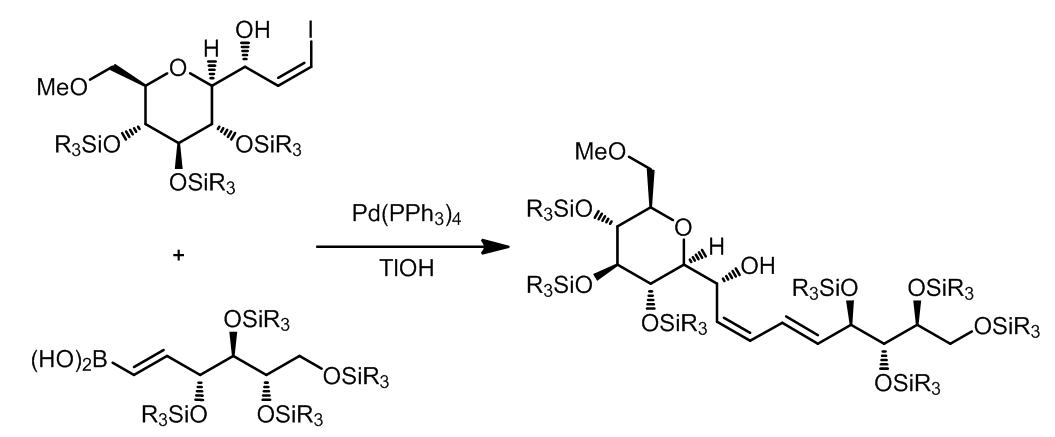
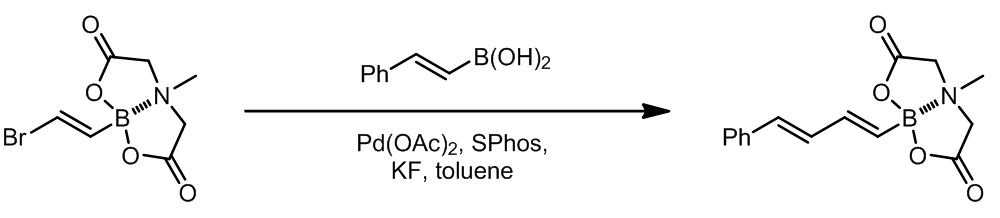
在所有这类偶联反应中,所有双键的构型是不会发生改变的。这个反应中使用了TlOH,这是一种非常高效的碱,可以极大的加速Suzuki偶联过程。
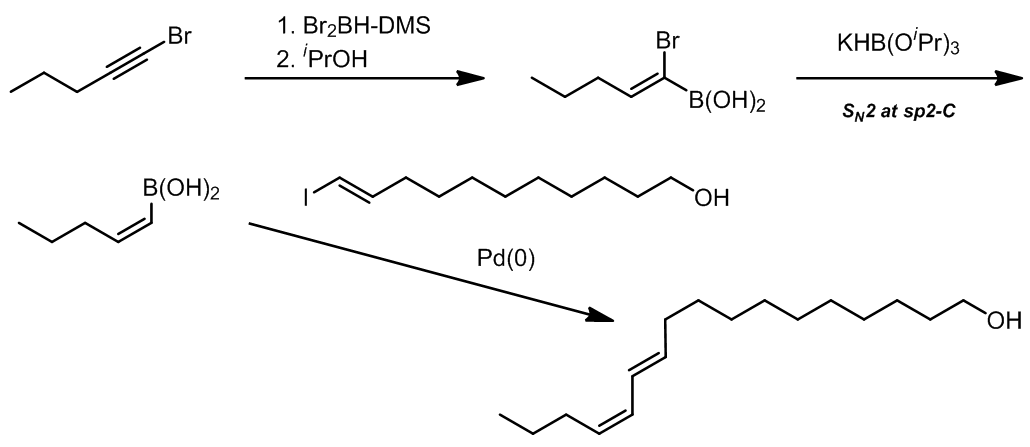
反应更加倾向于发生在位阻更小的卤原子上。
4.催化剂体系的发展
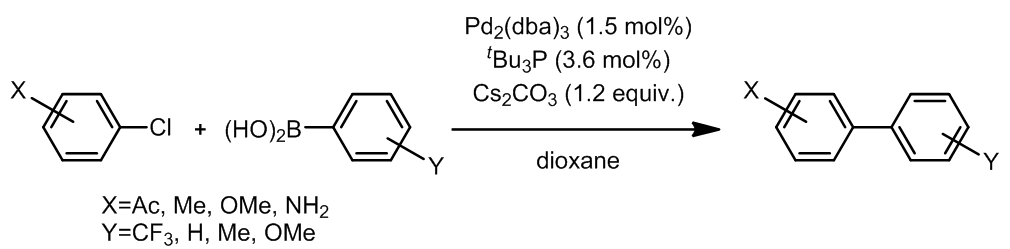
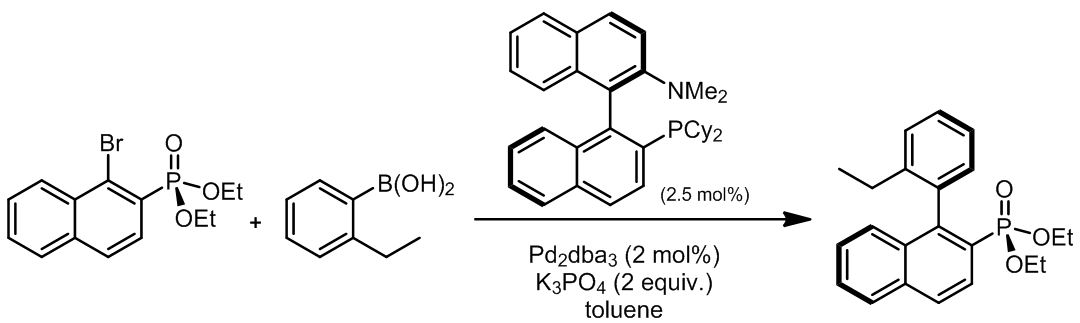
相对于溴和碘来说,芳基氯代烃更加受到青睐,但是大多时候它们在Suzuki反应表现出的是惰性的,因此有很多种含磷的配体被发明出来,以提高芳基氯在Suzuki欧联中的反应活性。这个反应的条件中使用的tBu3P是促使这个反应成功的关键,碰巧的是这个反应条件对于Stille偶联也是同样高效的。Ref. 10
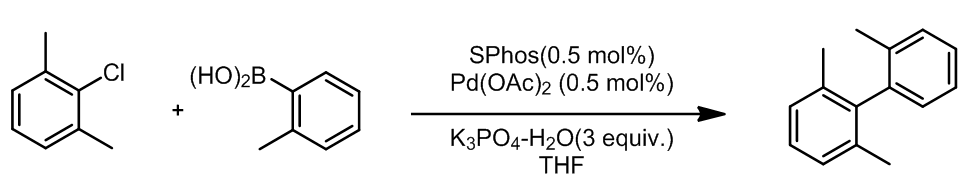
ii. 联苯二烷基磷类配体
这一类配体是由Buchwald最早开发出来的,他们可以催化一些Suzuki偶联。这些配体是二联苯类衍生物,这些配体的位阻大都很大,他们在空气中很稳定,两个苯环中间的单键是不可以自由旋转的,他们的作用认为是加速了氧化加成的步骤,此外他们的大位阻非常高效的促进了单络合物种Pd(0)-PR3的形成:
烷基R1使得磷元素上电子密度很高,有利于氧化加成步骤的发生,也有利于中心金属 Pd(II)的稳定性;大体积的R2/3可以加速还原消除反应,并且提高了Pd元素的使用频率,可以使得活性中心为LPd(0)而不是L2Pd(0),并且使催化剂性质稳定。
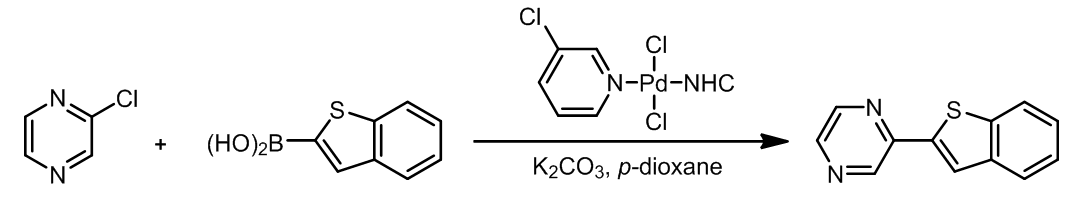
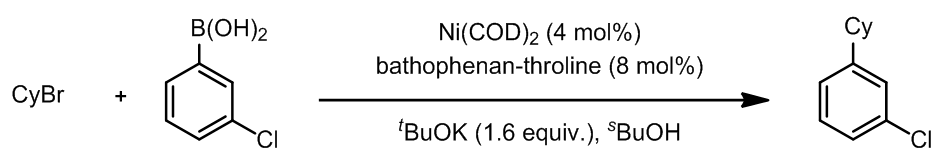
这里是几个例子:
这样的反应条件可以遏制Pd(II)的β-消除步骤。
REFERENCES
- J. Org. Chem., 1995, 60 (23), pp 7508–7510, DOI: 10.1021/jo00128a024
- Angew Chem Int Ed., 2001, 40, 1967, DOI: 10.1002/1521-3773(20010518)40:10<1967::AID-ANIE1967>3.0.CO;2-Q
- Chem. Rev., 2010, 110 (2), pp 890–931, DOI: 10.1021/cr900206p
- J. Am. Chem. Soc., 2002, 124 (3), pp 390–391, DOI: 10.1021/ja0173019
- Tetrahedron Lett., 1985, 26, 5997, DOI: 1016/S0040-4039(00)95108-6
- J. Am. Chem. Soc., 1987, 109 (15), pp 4756–4758, DOI: 10.1021/ja00249a069
- J. Org. Chem., 1997, 62 (25), pp 8708–8721, DOI: 10.1021/jo970960c
- J. Org. Chem., 1999, 64 (11), pp 3885–3890, DOI: 10.1021/jo982135h
- Angew Chem Int Ed., 1998 37 3387, DOI:10.1002/(SICI)1521-3773(19981231)37:24<3387::AID-ANIE3387>3.0.CO;2-P
- Angew Chem Int Ed., 2002 41 4176,DOI:10.1002/1521-3773(20021115)41:22<4176::AID-ANIE4176>3.0.CO;2-U
- Angew Chem Int Ed., 2004 43 1871 1002/anie.200353615
- Chem. Eur. Chem., 2006, 12, 4743, DOI: 10.1002/chem.200600251
- J. Am. Chem. Soc., 2004, 126 (5), pp 1340–1341, DOI: 10.1021/ja039889k
- Tetrahedron 1983, 39, 3271, DOI: 1016/S0040-4020(01)91575-3
- J. Am. Chem. Soc., 2008, 130 (2), pp 466–468, DOI: 10.1021/ja078129x
- J. Am. Chem. Soc., 2002, 124 (40), pp 12042–12053, DOI: 10.1021/ja020788g
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



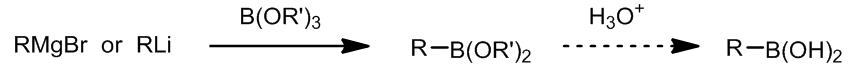




















No comments yet.