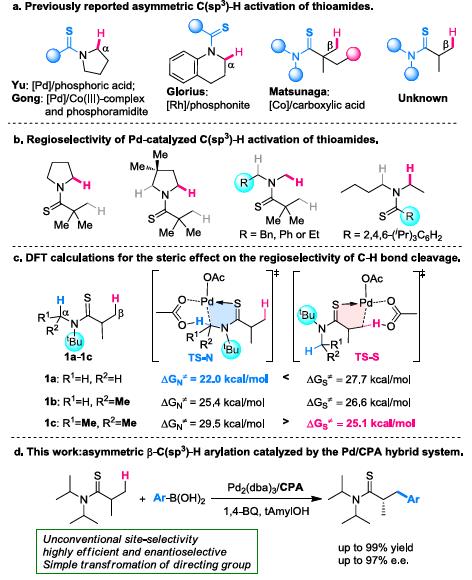
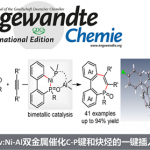
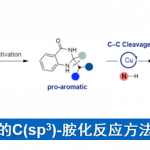
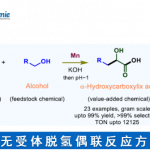
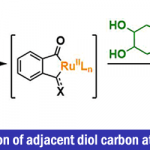
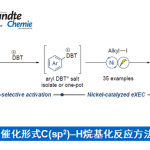
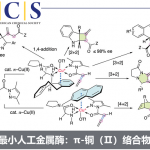
脂肪族C(sp3)-H官能团化一直存在C‒H键能力高、酸度低、以及分子轨道不活泼等问题,因此实现脂肪族C(sp3)-H官能团化一直是化学家们关注的重点。随着时代的发展,应用过渡金属催化硫酰胺、叔丁基硫代酰胺取代的1,2,3,4-四氢喹啉以及二恶唑酮发生对映选择性胺α-C(sp3)‒H芳基化反应的策略得到了一定的发展[1]。丁硫代酰胺的去对称化反应可以有效的合成具有重要作用的手性β-芳基异丁酰胺及其衍生物,但到目前为止,还没有相关报道(Scheme 1a)。为了实现丁硫代酰胺的C(sp3)‒H芳基化过程,中国科学技术大学龚流柱团队进行了系统的文献调研并发现硫酰胺中N-取代基的位阻大小可以调控C(sp3)-H的活化位点[2](Scheme 1b)。为了证实这个猜想,北京大学张欣豪课题组通过密度泛函理论(DFT)计算显示N取代基变大,C–H键断裂的位点越接近硫代酰胺(Scheme 1c)。在上述背景研究的基础上,中国科学技术大学龚流柱团队成功报道了首例Pd(II)催化N,N-二异丙基胺基异丁硫代酰胺的不对称β-C(sp3)-H官能团化反应,能以优秀的收率和对映选择性得到一系列手性β-芳基异丁酰胺。相关成果发表于
“Hybrid Palladium Catalyst Assembled from Chiral Phosphoric Acid and Thioamide for Enantioselective β-C(sp3)‒H Arylation”
Jiang, H.-J.; Zhong, X.-M.; Liu, Z.-Y.; Geng, R.-L.; Li, Y.-Y.; Wu, Y.-D.; Zhang, X.* Gong, L.-Z.* Angew. Chem. Int. Ed. 2020, Accepted Article. DOI: 10.1002/anie.202004485
Scheme 1. 研究背景
论文作者介绍
龚流柱教授
研究经历
- 1989.09-1993.07,河南师范大学化学系,化学教育专业,理学学士;
- 1993.09-1996.07,中国科学院成都有机化学研究所,有机合成,理学硕士;
- 1996.09-1998.06,中国科学院化学研究所,有机合成,博士生;
- 1998.06-2000.06,美国弗吉尼亚大学 (University of Virginia)化学系,访问学者(联合培养博士生);
- 2000.07,获中国科学院化学研究所理学博士学位。
主要经历
- 2000.12-2001.11,中国科学院成都有机化学研究所,助理研究员;
- 2000.12-2001.11,中国科学院成都有机化学研究所,副研究员
- 2001.12-2005.12,中国科学院成都有机化学研究所,研究员,博士生导师,先后任不对称合成和手性技术四川省重点实验室常务副主任,主任;
- 2003.10-2004.09,德国慕尼黑大学(Ludwig-Maximilians-Universität München) 有机化学研究所, 洪堡学者,访问教授;
- 2006.01-至今,中国科学技术大学化学系,合肥微尺度物质科学国家研究中心,教授;
- 2011.01-至今,合肥微尺度物质科学国家研究中心低维物理与化学研究部主任。
研究领域
- 有机小分子和金属“协同”或“接力”催化的反应,发展构建复杂结构手性分子的步骤经济性反应,研究影响协同和接力催化的规律
- 发展串联反应、环加成反应以及不对称多组分反应等,探索快速构建结构多样性的手性生理活性分子的合成方法
- 惰性碳氢键的不对称官能团化
- 催化不对称合成复杂天然生物碱和生理活性分子
论文概要
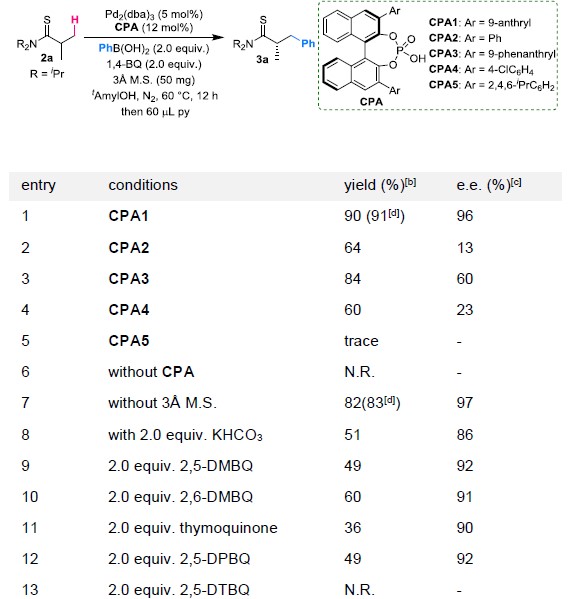
以N,N-二异丙基胺基异丁硫代酰胺2a和苯硼酸为模板底物,作者对各种反应条件进行反复筛选,确定最佳条件为(Table 1):N2保护条件下,5 mol%Pd2(dba)3和12 mol%CPA1为催化剂,2 equiv 1,4-BQ为氧化剂, 3 Å分子筛为添加物,tAmylOH为溶剂,在60 oC条件下反应12 h,能以91%的收率和97%的对映选择性得到相应产物3a。
Table 1. 条件筛选
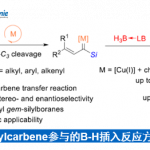
在最优反应条件下,作者对芳基硼酸的底物范围进行了考察。各种吸电子或给电子取代的苯硼酸均能较好的适应反应条件,能以良好至优秀的收率及优秀的对映选择性得到相应产物,但甲基硼酸只能以18%的收率和56%的对映选择性得到相应产物。紧接着,作者对异丁硫代酰胺进行了动力学拆分过程。通过简单的条件优化确定CPA6为最优催化剂。在该反应条件下,各种取代的异丁硫代酰胺都能以中等的收率和良好的对映选择性得到相应的二芳基产物,同时,可以回收重要的手性异丁硫代酰胺化合物。
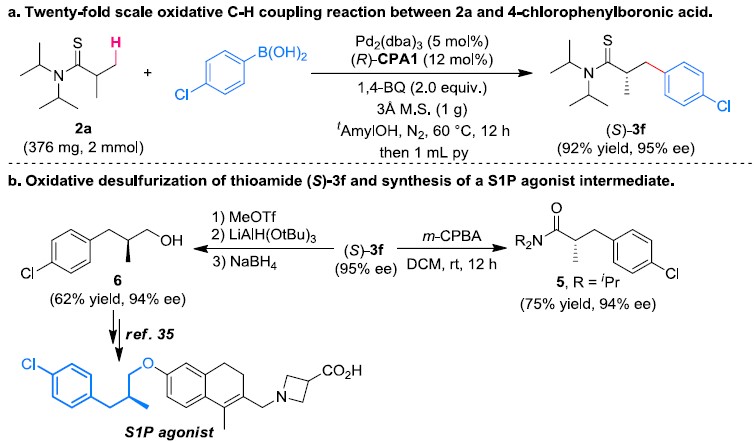
为了证明反应的应用潜力,作者进行了一系列衍生反应(Scheme 2)。在最优反应条件下,2a可与4-氯苯硼酸发生氧化C‒H偶联反应,能以92%的收率和95%的对映选择性得到(S)-3f。(S)-3f通过简单的化学修饰即可S1P拮抗剂。同时,作者通过MS分析和DFT计算分析证实了大位阻取代的手性磷酸是反应产物的高对映选择性的必要条件。
Scheme 2. 衍生反应
论文总结评价
中国科学技术大学龚流柱团队成功报道了首例Pd(II)催化N,N-二异丙基胺基异丁硫代酰胺的不对称β-C(sp3)-H官能团化反应,能以优秀的收率和对映选择性得到一系列手性β-芳基异丁酰胺。密度泛函理论(DFT)计算显示N取代基变大,C–H键断裂的位点越接近硫代酰胺。
参考文献
- [1] (a) Jain, P.; Verma, P.; Xia, G.; Yu, J.-Q. Chem. 2017, 9, 140-144; DOI: 10.1038/nchem.2619 (b) Jiang, H.-J.; Zhong, X.-M.; Yu, J.; Zhang, Y.; Zhang, X.; Wu, Y.-D.; Gong, L.-Z. Angew. Chem. Int. Ed. 2019, 58, 1803-1807; DOI: 10.1002/anie.201812426
- [2] Greßies, S.; Klauck, F. J. R.; Kim, J. H.; Daniliuc, C. G.; Glorius, F. Chem. Int. Ed. 2018, 57, 9950-9954. DOI: 10.1002/anie.201805680
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















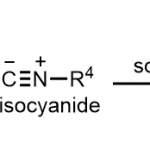



No comments yet.