本文作者:杉杉
导读
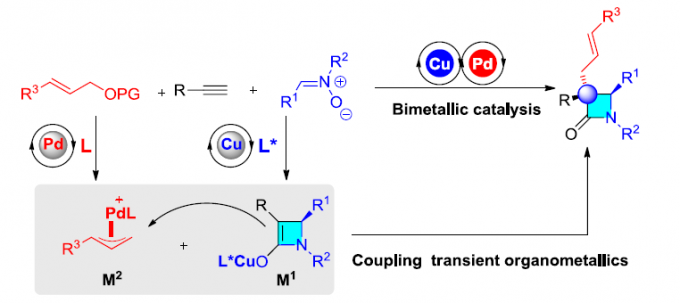
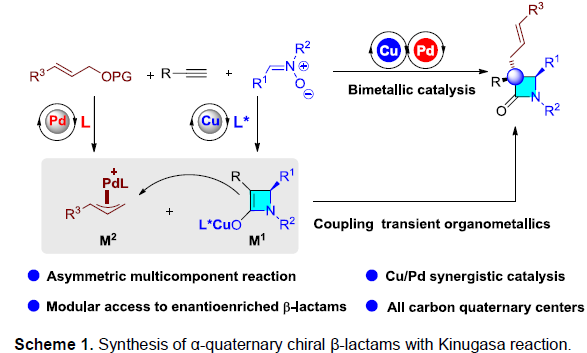
近日,山东大学徐政虎教授课题组在Angew. Chem. Int. Ed.上发表论文,报道了一种不对称多组分反应,即中断Kinugasa烯丙基烷基化(IKAA)反应,涉及Cu催化Kinugasa反应和Pd催化烯丙基烷基化反应。通过此策略可合成一系列高收率和高对映选择性的α-季碳手性β-内酰胺衍生物。值得注意的是,原位形成的两个催化量的瞬态有机金属中间体对于立体选择性偶联至关重要。
Modular Synthesis of α-Quaternary Chiral β-Lactams by a Synergistic Cu/Pd-Catalyzed Multicomponent Reaction
Jialin Qi, Fang Wei, Chen-Ho Tung, and Zhenghu Xu*
Angew. Chem. Int. Ed. ASAP DOI:10.1002/ange.202100601
正文
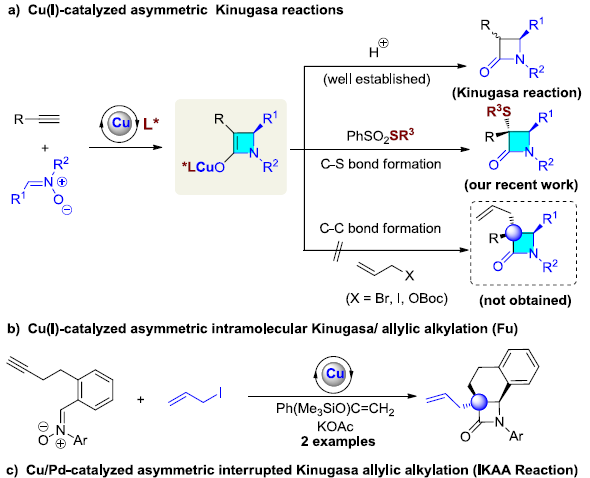
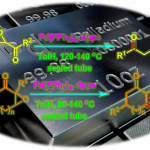
多组分反应(MCRs)可实现多个简单化合物直接合成结构复杂的分子,具有步骤简便、原子经济性高、成键效率高、产物多样性等优点。同时,催化不对称MCRs可合成对映体富集的复杂分子,但相对研究较少。其中,双金属催化是不对称MCRs的有效策略之一。β-内酰胺是临床药物(如青霉素,头孢菌素)以及单环抗生素(例如氨曲南)的核心骨架,虽然已开发出多种β-内酰胺的合成方法,但具有α-季碳立体中心的手性β-内酰胺的合成仍具挑战。手性Lewis碱催化双取代烯酮与亚胺的不对称Staudinger反应[1],可获得此类骨架,但高反应性乙烯酮中间体的制备和处理限制了它们的实际使用。此外,铜(I)催化炔烃与硝酮的不对称偶联反应(Kinugasa反应),可合成α,β-二取代β-内酰胺,但无法合成α-季碳中心的手性β-内酰胺。2003年,Fu等[2]报道了铜(I)催化不对称双组分的Kinugasa反应和烯丙基烷基化反应(Scheme 1b)。然而,对于三组分反应却没有被研究。近期,该课题组[3]也报道了一种铜(I)催化的三组分中断Kinugasa反应,使用硫亲电体来拦截关键的四元烯醇铜(I)中间体,从而合成α-硫代官能团的手性β-内酰胺。然而,该策略未能实现与烯丙基亲电试剂顺利反应,未能获得具有全碳四元中心的α,α-二取代手性β-内酰胺(Scheme 1a)。在此,本文将报道一种Cu/Pd催化的中断Kinugasa烯丙基烷基化(IKAA)反应,通过易得的炔烃、硝酮和烯丙基碳酸酯直接合成α-季碳手性β-内酰胺衍生物(Scheme 1c)。
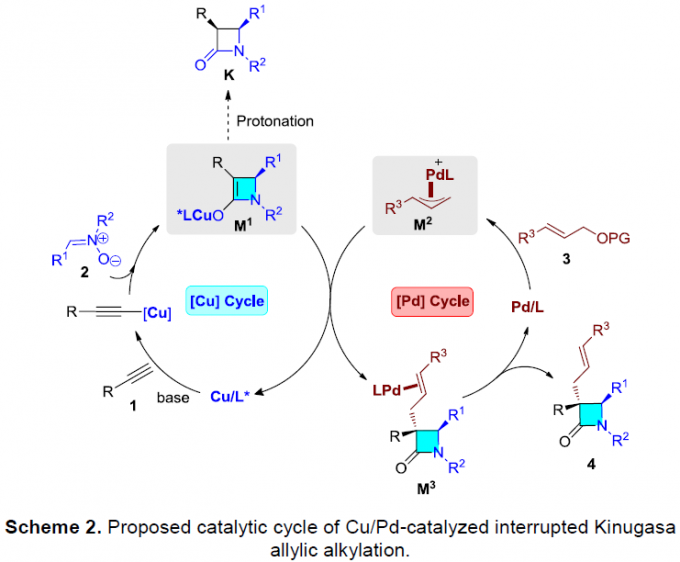
同时,作者提出了一个可能的反应机理(Scheme 2)。首先,在铜催化循环体系中,炔基铜(I)与硝酮2经环加成反应,生成了关键的手性四元烯醇化铜(I)中间体M1。其次,在钯催化循环体系中,钯催化剂与烯丙基亲电子试剂3反应,形成烯丙基钯中间体M2。随后,M1和M2之间进行立体选择性烯丙基取代,生成α-季碳手性β-内酰胺,同时再生铜(I)和钯(0)催化剂。
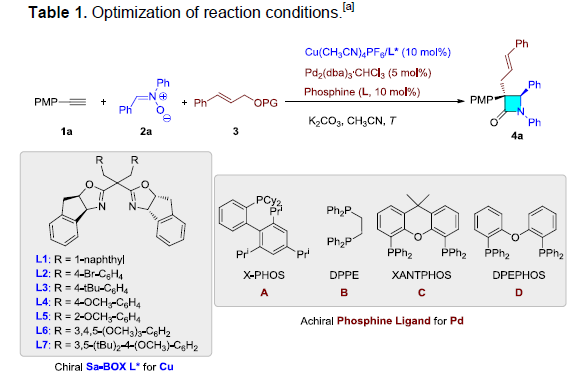
首先,作者以1a、2a和3作为模型底物,进行了相关环化反应条件的筛选(Table 1)。反应最佳条件为:以Cu(CH3CN)4PF6/L6为铜催化体系, Pd2dba3·CHCl3/膦配体D为钯催化体系,K2CO3为碱,可在CH3CN溶剂中室温反应30 h,即可获得75%收率和96:4 er的目标产物4a。
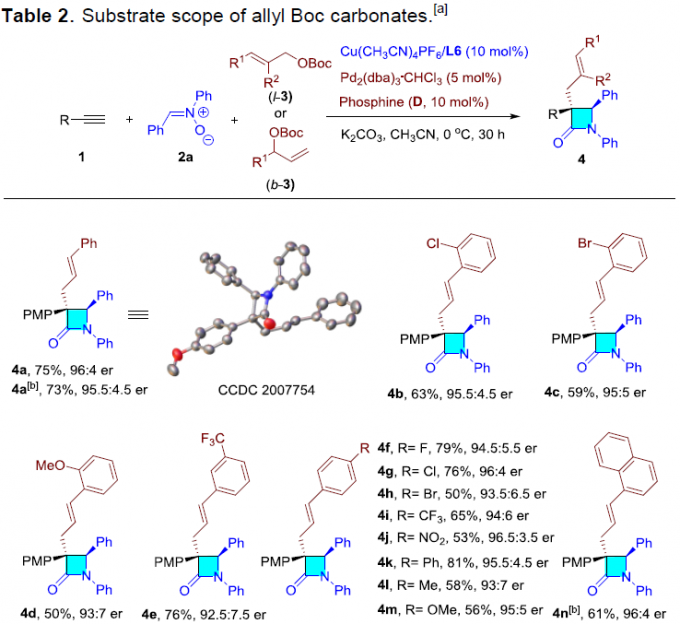
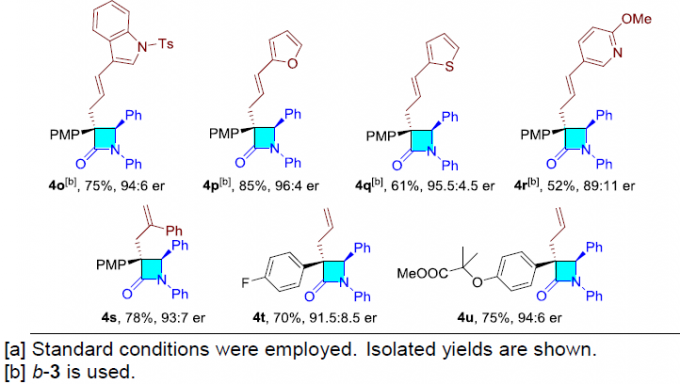
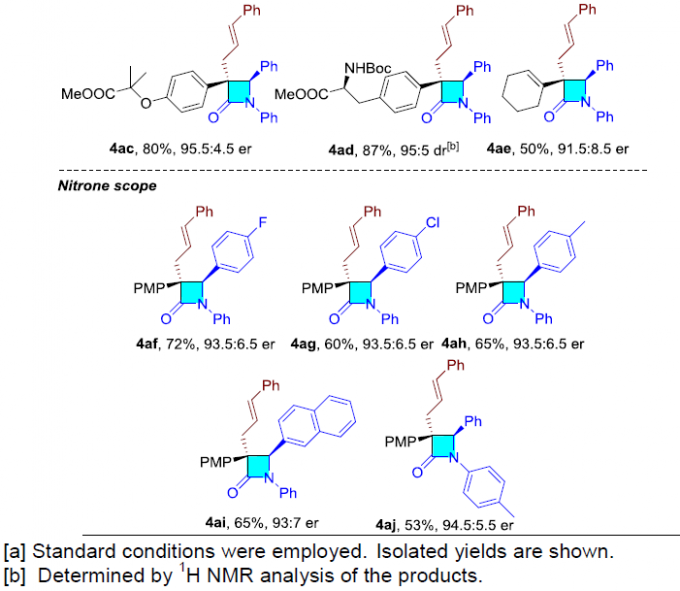
在获得上述最佳反应条件后,作者首先对烯丙基亲电子试剂的范围进行了扩展(Table 2)。具有不同芳基取代的直链(l–3)或支链(b–3)烯丙基亲电子试剂,均可顺利反应,获得产物4a–4m。同时,具有萘基、吲哚基、呋喃基、噻吩基、吡啶基等烯丙基亲电子试剂,也与体系兼容,获得相应的产物4n–4r。此外,简单的碳酸烯丙酯和2-苯基烯丙基碳酸酯,以高收率和良好的对映选择性得到相应的产物4s–4u。
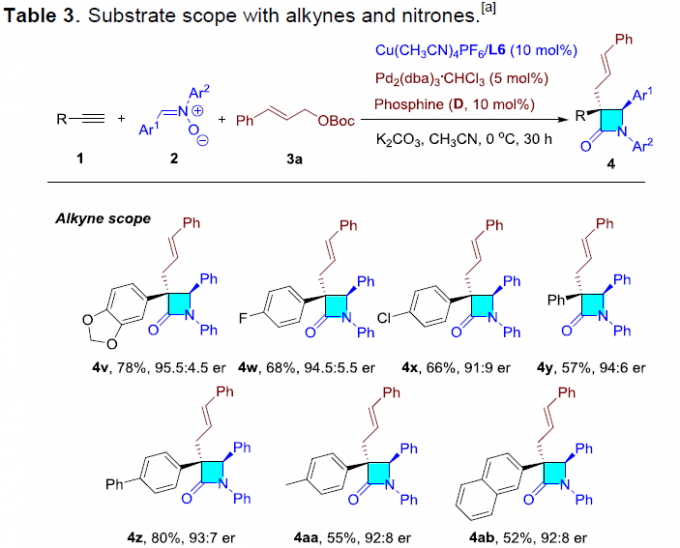
随后,作者对末端炔烃和硝酮的范围进行了扩展(Table 3)。不同芳基取代的苯乙炔底物,均能顺利反应,获得产物4v–4ad。其次,环己烯基炔底物也具有良好的反应性,获得内酰胺4ae。此外,芳基上具有不同供电子基或吸电子基的硝酮底物,均可转化,获得相应的产物4af–4aj。
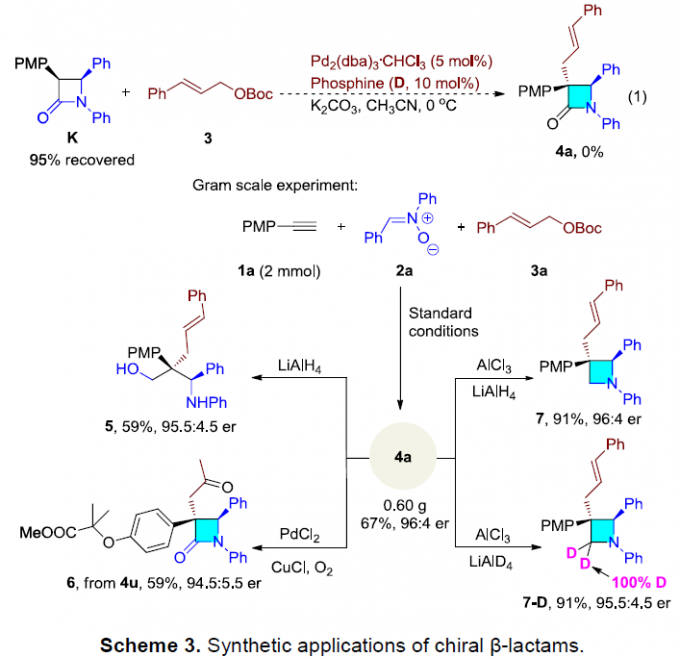
最后,作者对反应的实用性进行了研究(Scheme 3)。首先,β-内酰胺4a的克级实验,收率为67%,er为96:4。若4a通过LiAlH4还原可获得氨基醇(5)。若4a通过AlCl3和LiAlH4或LiAlD4处理,可获得手性氮杂环丁烷(7)或相应的氘代氮杂环丁烷(7-D),且对映体纯度没有损失。若4u通过Wacker氧化反应,可获得具有羰基的手性β-内酰胺(6)。此外,化合物K和3在标准条件下未发生反应,从而表明化合物K不是反应的中间体。
总结
山东大学徐政虎教授课题组报道了一种Cu催化Kinugasa反应和Pd催化烯丙基烷基化反应,可从三个易得的底物(炔烃、硝酮和烯丙基亲电试剂)直接合成一系列α-季碳手性β-内酰胺衍生物。同时,该反应具有底物范围广泛、收率高、对映选择性高等特点。

















No comments yet.