本文投稿作者 Asymmboy
概要
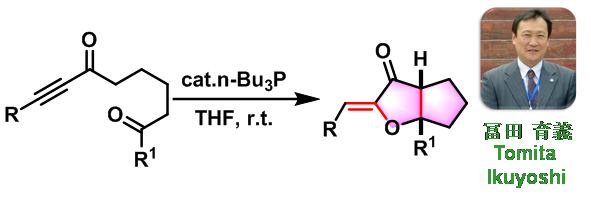
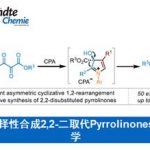
Tomita拉链环化反应是在三正丁基膦催化下,炔二酮进行的非对映选择性环化生成具有两个立体中心的双环呋喃酮的反应。2003年由日本Tokyo大学资源化学实验室物质电子化学系 (東京工業大学資源化学研究所物質電子化学専専攻,Chemical Resources Laboratory and Department of Electronic Chemistry, Tokyo Institute of Technology) 的Tomita (冨田 育義, Tomita Ikuyoshi)研究组提出。
基本文献
H., Kuroda, I., Tomita, T. Endo, Org.Lett. 2003, 5, 129. doi:10.1021/ol020198n
反应机理
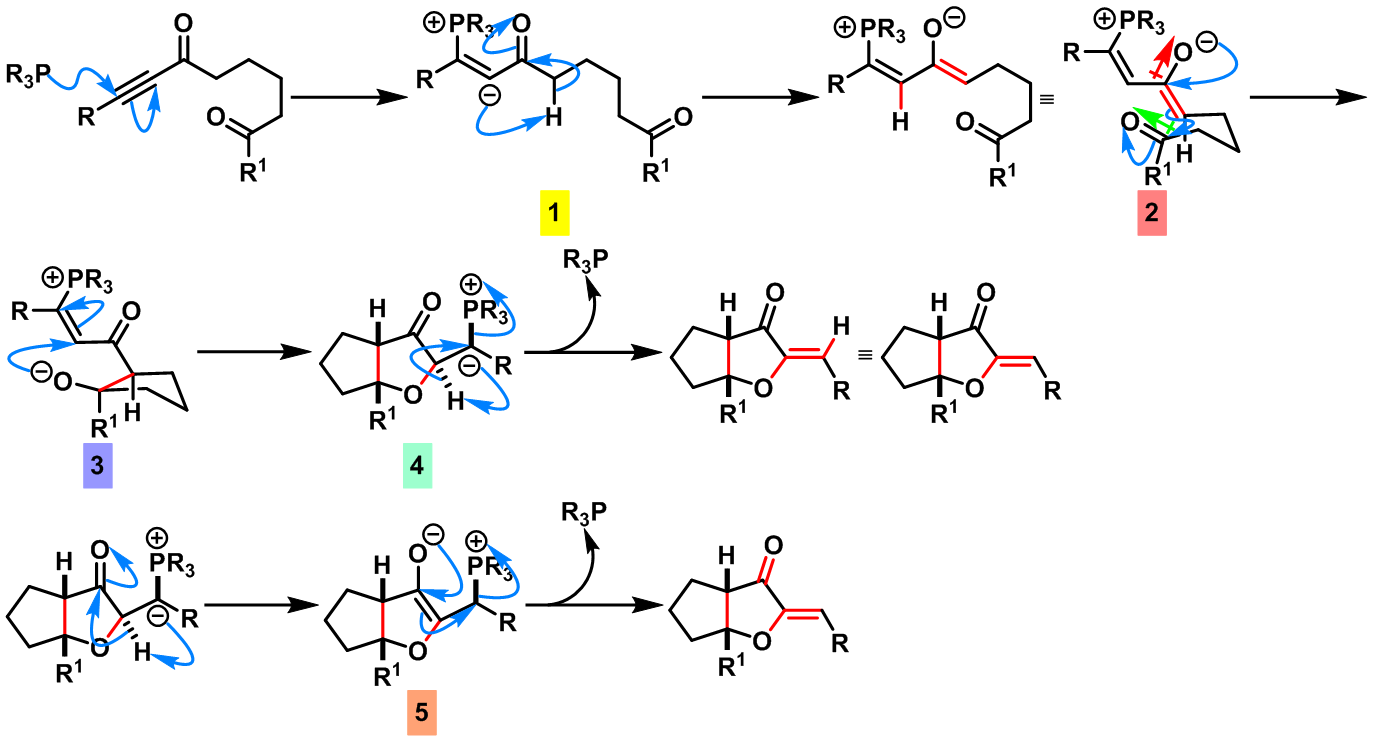
首先膦化合物与底物中的炔基发生亲核加成反应,形成1,2-偶极中间体1,接下来1通过交叉互变异构化(Cross-Tautomerization)过程产生中间体2,中间体2通过类信封式(Envelop-like)构象(这一点在Fu的文章中并未提及,纯属小编个人观点。本人认为采取这种构象排列将使极性基团之间的偶极相互作用最小,为合理的反应活性构象。如果大家有不同见解,欢迎提出宝贵意见)进行烯醇负离子的亲核加成,产生中间体3,此时,已构建起目标产物的两个手性中心。随后,新形成的烯醇负离子再对双键发生亲核加成,形成中间体4,最后,中间体4通过立体电子效应有利的反式共平面构象进行消除反应,获得最终产物。而文献中Tomita认为是分步过程,并通过烯醇负离子中间体5进行消除,这里小编认为通过烯醇负离子中间体的方式进行消除,会出现双键立体化学的置乱(Scrambling)。
反应实例
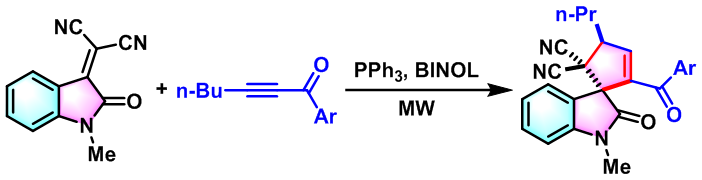
官能团化的螺羟吲哚(Spirooxindole)的合成[1]
环戊酮稠合的benzosultam的合成[2]
实验步骤
将底物溶于THF,配成0.5M 的溶液,并在室温下加入三正丁基膦 (0.20 equiv)。将上述溶液在室温下搅拌12小时。12小时过后,将反应液浓缩,获得粗产物。随后采用硅胶柱色谱(正己烷/乙酸乙酯 20/1 v/v)分离, 获得最终目标产物。
参考文献
[1] X.-Y., Zhang, Z., Shen, L.-L, Hua, L.-J., Wang, Y.-S., Lin, J.-W., Xie, H.-L., Cui, Tetrahedron Letters 2016, 57, 3790. doi: 10.1016/j.tetlet.2016.07.035. [2] R. B. Dhevalapally, M. K. Patoju , P. R. T., Org. Biomol. Chem., 2016, doi: 10.1039/C6OB01096B.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.