本文作者:石油醚
概述
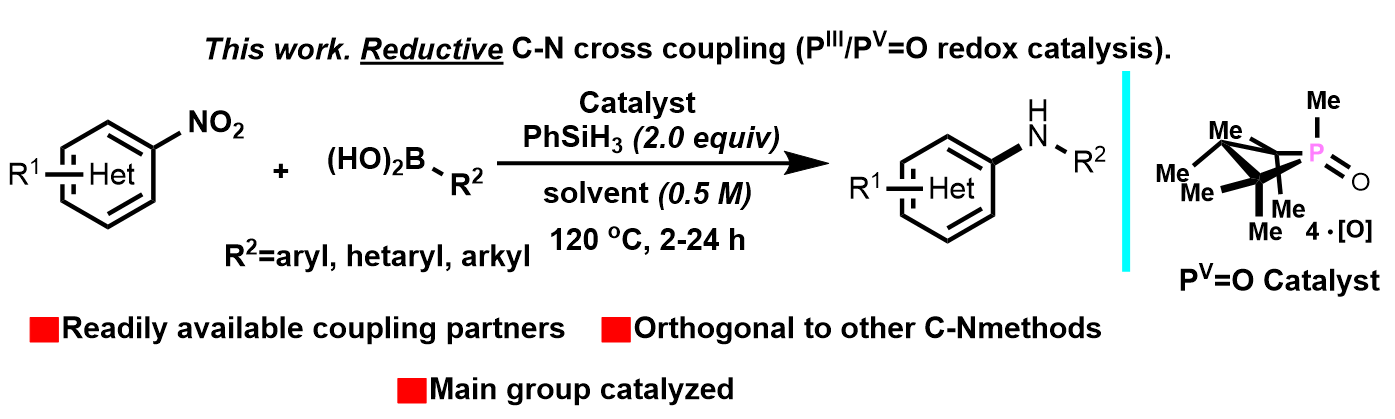
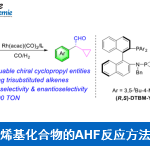
芳基和杂芳基胺广泛存在于有机化合物中,特别是重要的医药,农药,精细化学品和光电材料等多个方面。目前已知的策略是通过金属催化苯胺的N-芳基化来构建新的C-N键1-5。(Figure 1A, 1B, 1C)(如Buchwald-Hartwig, Ullmann-Ma, and Chan–Lam couplings)近日,麻省理工学院的A. T. Radosevich 课题组描述了另外一种不依赖过渡金属催化构建C-N键的方法,即通过有机磷PIII/PV=O催化硝基芳烃与硼酸的分子间还原C-N交叉偶联,从而获得芳基或者杂芳基的产物。
Intermolecular Reductive C-N Cross Coupling of Nitroarenes and Boronic Acids by PIII/PV=O Catalysis
Nykaza, T. V.; Cooper, J. C.; Li, G.; Mahieu, N.; Ramirez, A.; Luzung, M. R.; Radosevich, A. T.
J . Am. Chem. Soc. 2018, 140 (45), 15200-15205 DOI: 10.1021/jacs.8b10769
Figure 1 C-N键的构建方法
正文
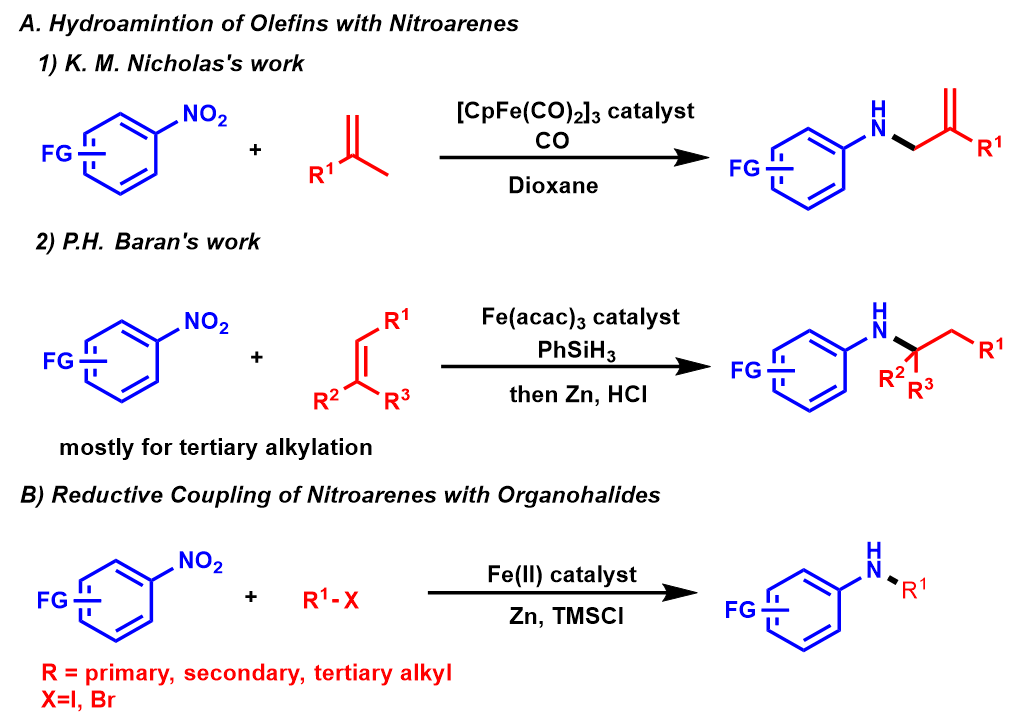
硝基芳烃是合成中的常见中间体(典型地苯胺前体),但是对于直接将硝基芳烃催化形成C-N键形成反应相对较少。A)Nicholas6和Baran7的工作,他们报道了铁催化的硝基芳烃与烯烃加氢胺化形成C-N键(Fig.2A);B)胡8报道了铁催化硝基芳烃与烷基亲电试剂还原偶联形成的的C-N键,(Fig.2B); C) Knochel9, Kürti10,和Niggemann11使用主族金属将硝基芳烃还原为N-芳基苯胺。A. T. Radosevich 课题组使用具有氧化还原活性的小环磷基化合物将硝基芳烃进行官能团化12,13。A. T. Radosevich小组在2017年曾报道过12,一个含有简单烷基四元环的氧膦和苯基硅烷作为末端还原剂的催化体系可以催化硝基芳族底物发生分子内Cadogan环化反应转化为氮杂杂环的产物,并构建新的C-N键。在这些化学反应中,磷环催化剂通过PIII /PV=O催化循环14-16来促进硝基芳烃底物还原O原子转移。因此,A. T. Radosevich考虑在PIII /PV=O催化条件下引入合适的反应条件是否可能催化硝基芳烃和另外的化合物来构建C-N键。
Figure 2 硝基芳烃形成C-N键的方法
条件筛选
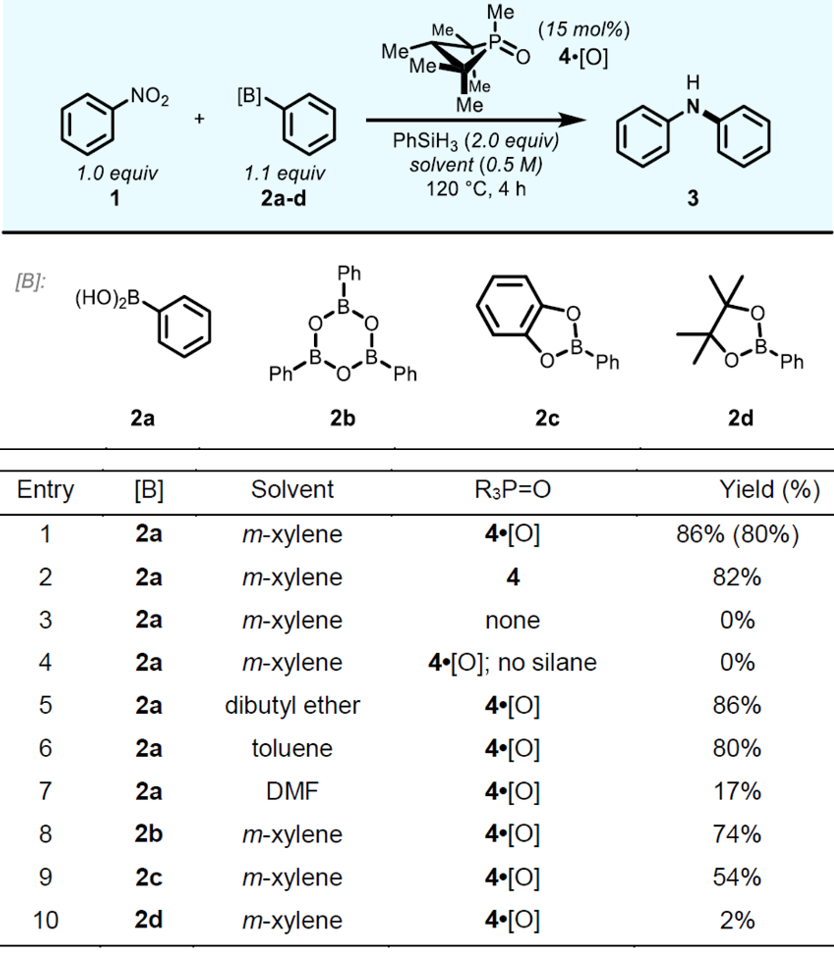
由于PIII /PV=O催化循环可以促进硝基芳烃在分子内反应构建 C-N键。作者使用最硝基苯(1)和苯硼酸(2a)为模型底物在实现 Cadogan 环化反应的条件下对进行初步尝试并获得了59 % 收率的二苯胺。基于上面的结果,对于反应的温度,浓度,试剂当量和 P催化剂的种类进行优化并获得最优的反应条件。(Table 1中Entry 1 1.1 equiv of 2a, 15 mol % of 4•[O], 0.5 M in m-xylene, 120 °C). 最优条件下,有机磷催化的硝基苯和苯基硼酸的还原偶合得到二苯胺产率为80 % (GC产率为86%)。通过对照实验发现: 1)不加磷催化剂(Entry 3)或末端硅烷还原剂(Entry 4)都不会获得产物;2)反应在非极性溶剂中可以进行的很好(Entry 1, 5, 6),在极性溶剂(Entry 7)中效率很低,只有17% “;3)不同的硼试剂对于反应的成功也有很大的影响。在最优催化条件下,苯基硼酸(2a)和苯基硼氧烷(2b,Entry 8)均可以成功地将硝基苯胺化,得到产物二苯胺 3。但是,当其他常用的苯基硼酸酯在 C-N 偶联中用作芳基供体时,其他常见的苯基硼酸酯要么效率较低(2c Entry 9),要么产率低下(2d Entry 10),这表明反应对发生硼烷基部分的化学选择性的不同导致。
Table 1 条件优化
底物拓展
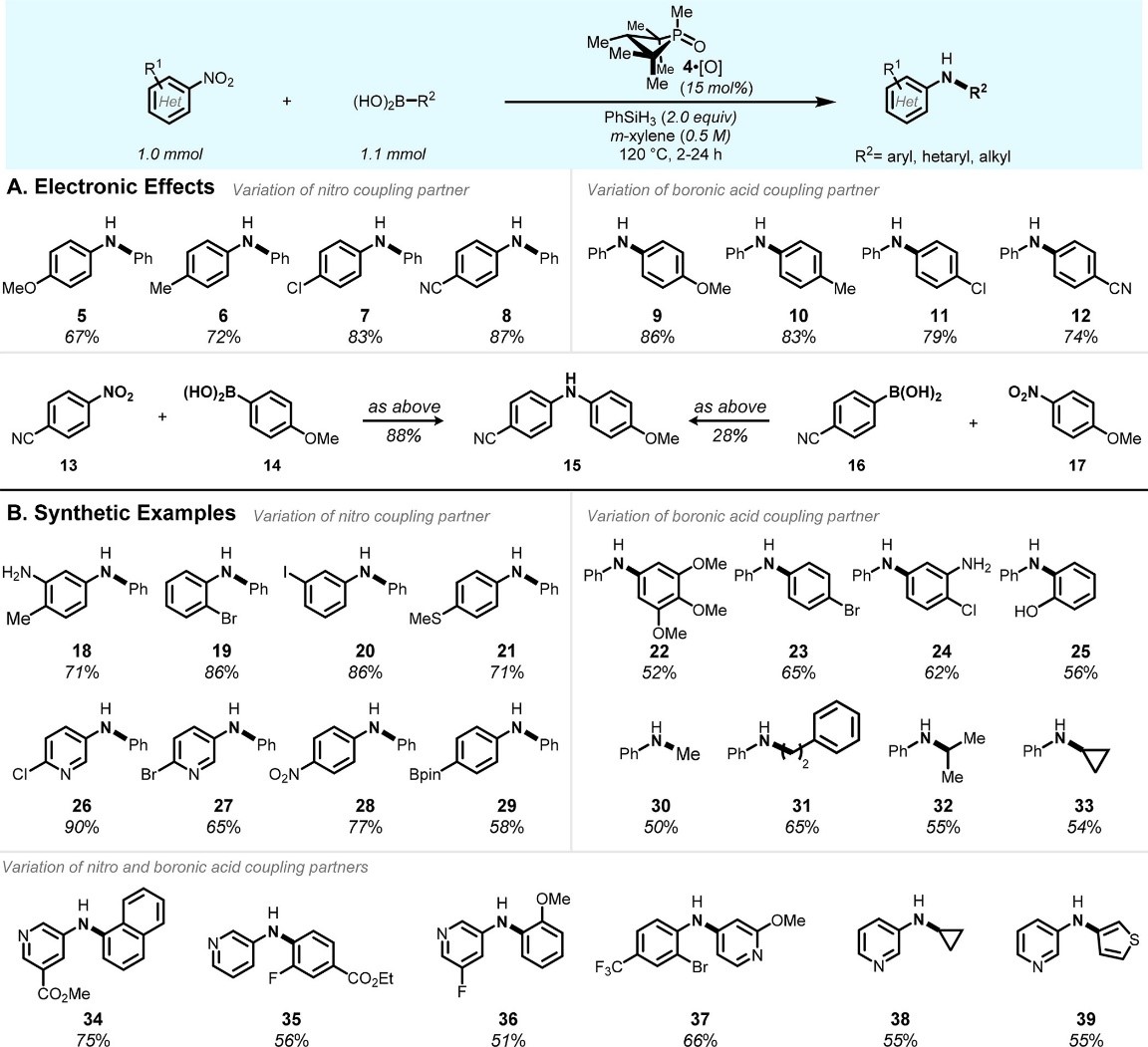
条件筛选出最优条件,作者在有最优反应条件下考察C-N偶联的电子效应(Fig. 3A)发现: 1)对位取代硝基芳烃的底物中,取代基的吸电子性越强反应的速率和
C-N偶联的产率越高(Cf. 5-8);2)不同取代的芳基硼酸的底物中,取代基的给电子性能导致的C-N偶联的产率越好(Cf. 9-12)。基于这两种不同趋势的结果,有机磷催化的C–N偶联反应对于缺电子的硝基芳烃与富电子的芳基硼酸的结合最有效。(Fig 3A中的15的合成)。与钯催化的C–N偶联相比,钯催化缺电子的芳基胺底物的芳基化一直是最具有挑战性。因此,当前的有机磷催化方法可能为这一挑战提供一条途径。
通过对于其他底物的实例(Fig. 3B)。由于膦不易发生Csp2-X键的氧化加成反应,因此硝基芳烃组分(7,19,20)和硼酸(11,23,24)组分均具有良好的卤素取代能力。即使是非常亲电的2-氯和2-溴吡啶基底物(26, 27),也被认为是SNAr和过渡金属催化取代的优秀亲电体,通过膦催化的还原C-N偶联也不会发生不希望的裂解 。质子官能团不需要保护(例如苯胺(18, 24)和苯酚(25))也可以很好的于硝基苯反应。值得注意的是4-频哪醇硼烷基硝基苯也可以很好的和苯硼酸反应的产物(29),(频哪醇硼烷基)硼烷基部分对主要基团催化的条件是惰性的。基于以上实验我们发现,磷催化的C–N偶联显示出了良好的官能团兼容性,相对于已建立的过渡金属偶联的化学选择性提供互补。反应对于
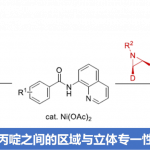
Csp2-N键的形成。同样使用Csp3硼酸试剂(包括甲基(30),伯烷基(31),仲烷基(32)和应变环烷基(33))对硝基苯进行胺化可提供所需Csp3-N交叉偶联产物。除了上面底物的探讨,作者还含有杂芳芳基结构进行了探讨。硝基芳烃或硼酸反应组分上的羧酸酯均具有良好的耐受性(34、35),并且π-deficient(37)和π-excessive(39)的杂环也可以的反应。由于有机磷催化剂弱路易斯酸性的,而具有路易斯碱性官能团(胺,吡啶,硫化物)的底物在主要反应位点偶联条件下不会被抑制。
Figure 3 P催化的C-N偶联反应的底物拓展
合成实例
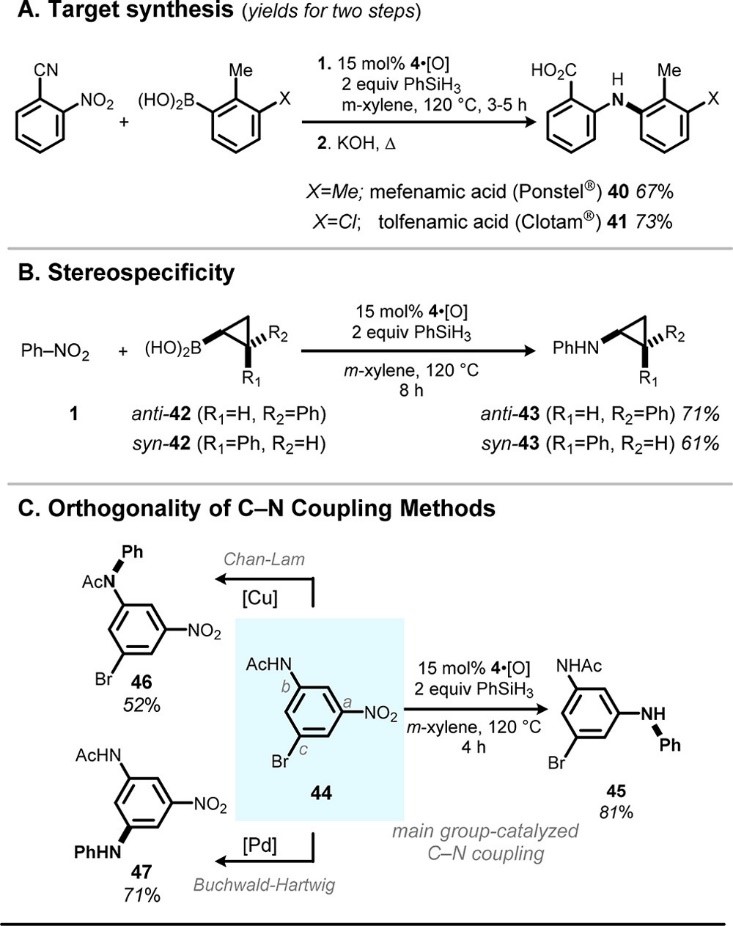
A.T. Radosevich课题组还做了一些合成实例的实验(Fig. 4)。1) 应用 P 催化的C-N 偶联合成了非甾体类抗炎药的芬奈特类药物的成员甲芬那酸(40)和甲苯磺酸(41),证明这种方法在药物化学领域的潜在合成实用性。(Fig.4A);2)通过立体化学探针分子的胺化来评估 P 催化的 C-N 偶联反应的立体特异性。在最优催化的条件下,将 anti-苯基环丙基硼酸(anti-42)与硝基苯还原偶联,可得到71 % NMR收率的N-苯基反式环丙胺衍生物 anti-43,且保留了构型;3)1,3,5-三取代芳烃44的多样化(Fig.4C)体现了 P 催化的 C-N 偶联现有过渡金属策略的互补性。A.T. Radosevich设想提供新的自由度来提高技术能力,从而可以从各种易于获得的反应切块中合成有价值的芳基胺产品。
Figure 4 合成实例的实验
反应机理17
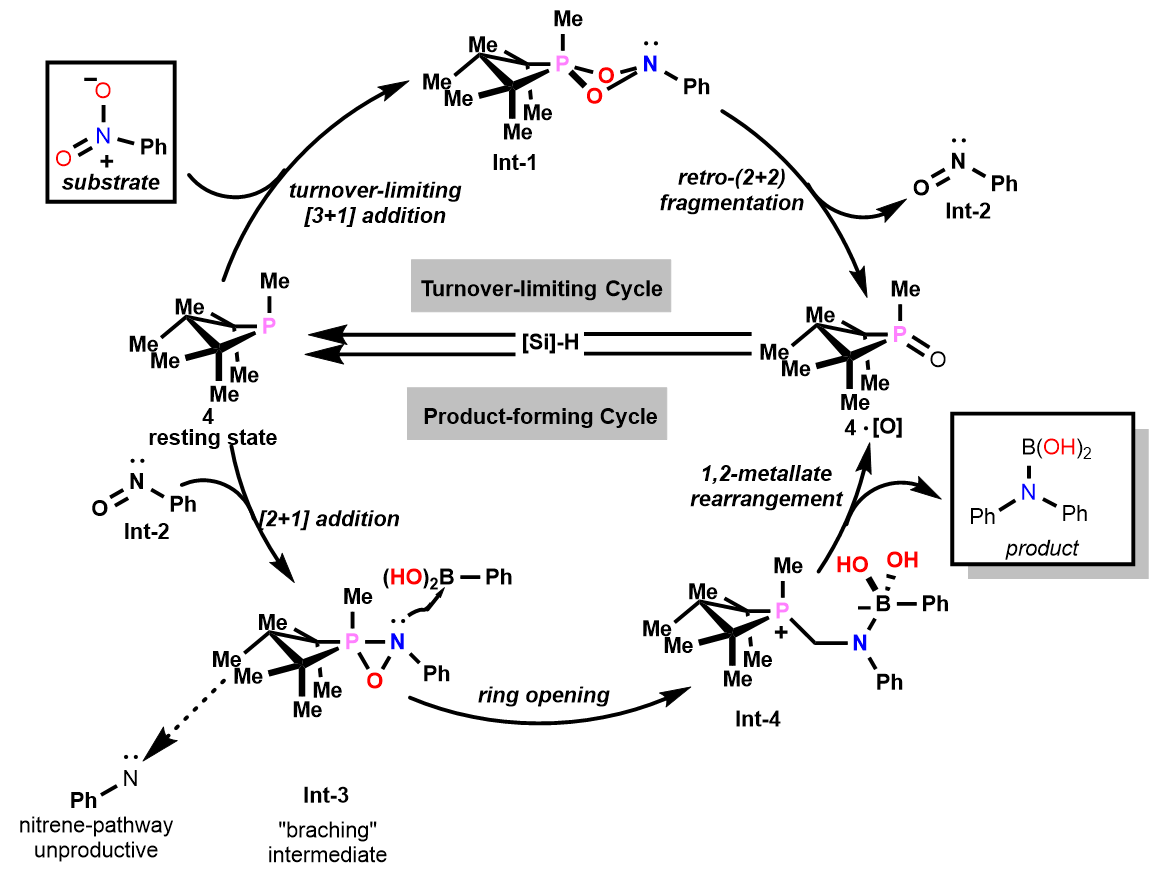
A.T. Radosevich课题组在本篇(J. Am. Chem. Soc. 2018, 140 (45), 15200)没有对机理的研究。而在近期的一篇报道(https://pubs.acs.org/doi/10.1021/jacs.0c01666)中做了详细的报道。首先。考察了反应条件(温度,浓度,催化剂种类等),底物竞争反应,原位光谱(Situ 31P NMR,Situ 15N NMR),催化动力学实验,计算
化学(DFT计算和EDA-NOCV分析)。基于以上的实验结果提出了可能的反应机理。(Figure 5) 通过实验确定了反应条件和P催化剂在反应中的作用及其影响。DFT计算发现了两中不同的脱氧序列(第一个是硝基芳烃和与催化剂(3 + 1)加成磷酯脱氧,体现了磷酯的双亲特性;第二个脱氧阶段却是关键的步骤,对于C-N键的形成很关键,其中假定的氧杂氮杂膦酸酯中间体(Int-3)从芳基亚硝基解离转移至芳基硼酸并发生杂化开环。偶极中间体(Int-4)是通过有机硼反平面1,2-迁移到氮上而产生的,从而导致1·[O]的置换并在原位水解时形成C-N偶联产物。因此,P催化构建C-N键的方法与目前过渡金属的催化分子间C-N偶联方法相辅相成。
Figure 5 P催化构建C-N键的反应机理
总结
A.T. Radosevich课题组基于PIII /PV=O催化循环实现了硝基芳烃与硼酸在分子内还原C-N交叉偶联。通过底物拓展,合成实例,机理研究发现,PIII /PV=O催化循环构建碳氮键与过渡金属催化构建C-N键相辅相成,互为补充。为反应提供新的自由度来提高技术能力,从而可以从各种易于获得的反应切块中合成有价值的芳基胺产品。
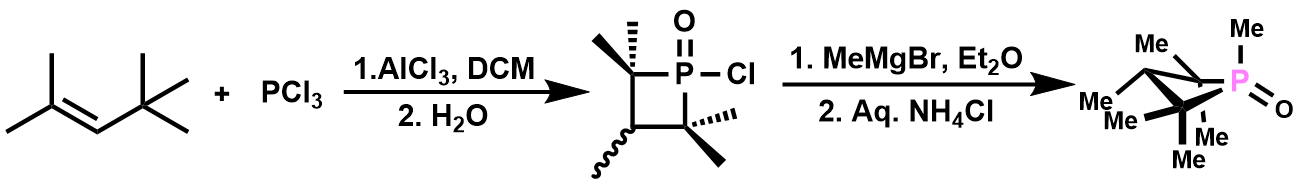
催化剂的合成方法
参考文献
- [1] Bariwal, J. & Van der Eycken, E. C–N bond forming cross-coupling reactions: an overview. Chem. Soc. Rev. (2013) 42, 9283-9303, doi:10.1039/C3CS60228A.
- [2] Dorel, R., Grugel, C. P. & Haydl, A. M. The Buchwald–Hartwig Amination After 25 Years. Angew. Chem. Int. Ed. (2019) 58, 17118-17129, doi:10.1002/anie.201904795.
- [3] Ruiz-Castillo, P. & Buchwald, S. L. Applications of Palladium-Catalyzed C–N Cross-Coupling Reactions. Chem. Rev. (2016) 116, 12564-12649, doi:10.1021/acs.chemrev.6b00512.
- [4] Fyfe, J. W. B. & Watson, A. J. B. Recent Developments in Organoboron Chemistry: Old Dogs, New Tricks. Chem (2017) 3, 31-55, doi:https://doi.org/10.1016/j.chempr.2017.05.008.
- [5] Schlummer, B. & Scholz, U. Palladium-Catalyzed C-N and C-O Coupling–A Practical Guide from an Industrial Vantage Point†. Adv. Synth. Catal., (2004) 346, 1599-1626, doi:10.1002/adsc.200404216.
- [6] Srivastava, R. S. & Nicholas, K. M. Kinetics of the Allylic Amination of Olefins by Nitroarenes Catalyzed by [CpFe(CO)2]2. Organometallics (2005) 24, 1563-1568, doi:10.1021/om049336y.
- [7] Gui, J. et al. Practical olefin hydroamination with nitroarenes. Science. (2015) 348, 886-891, doi:10.1126/science.aab0245
- [8] Cheung, C. W. & Hu, X. Amine synthesis via iron-catalysed reductive coupling of nitroarenes with alkyl halides. Nat. Commun. (2016) 7, 12494, doi:10.1038/ncomms12494.
- [9] Sapountzis, I. & Knochel, P. A New General Preparation of Polyfunctional Diarylamines by the Addition of Functionalized Arylmagnesium Compounds to Nitroarenes. J. Am. Chem. Soc. (2002) 124, 9390-9391, doi:10.1021/ja026718r.
- [10] Gao, H., Xu, Q.-L., Yousufuddin, M., Ess, D. H. & Kürti, L. Rapid Synthesis of Fused N-Heterocycles by Transition-Metal-Free Electrophilic Amination of Arene CH Bonds. Angew. Chem. Int. Ed. (2014) 53, 2701-2705, doi:10.1002/anie.201309973.
- [11] Rauser, M., Ascheberg, C. & Niggemann, M. Electrophilic Amination with Nitroarenes. Angew. Chem. Int. Ed. (2017) 56, 11570-11574, doi:10.1002/anie.201705356.
- [12] Nykaza, T. V., Harrison, T. S., Ghosh, A., Putnik, R. A. & Radosevich, A. T. A Biphilic Phosphetane Catalyzes N–N Bond-Forming Cadogan Heterocyclization via PIII/PV═O Redox Cycling. J. Am. Chem. Soc. (2017) 139, 6839-6842, doi:10.1021/jacs.7b03260.
- [13] Nykaza, T. V., Ramirez, A., Harrison, T. S., Luzung, M. R. & Radosevich, A. T. Biphilic Organophosphorus-Catalyzed Intramolecular Csp2–H Amination: Evidence for a Nitrenoid in Catalytic Cadogan Cyclizations. J. Am. Chem. Soc. (2018) 140, 3103-3113, doi:10.1021/jacs.7b13803.
- [14] Coyle, E. E. et al. Catalytic Wittig Reactions of Semi- and Nonstabilized Ylides Enabled by Ylide Tuning. Angew. Chem. Int. Ed. (2014) 53, 12907-12911, doi:10.1002/anie.201406103.
- [15] Bayne, J. M. & Stephan, D. W. Phosphorus Lewis acids: emerging reactivity and applications in catalysis. Chem. Soc. Rev. (2016) 45, 765-774, doi:10.1039/C5CS00516G.
- [16] Campbell, T. W. & Monagle, J. J. A New Synthesis of Mono- and Polycarbodiimides. J. Am. Chem. Soc. (1962) 84, 1493-1493, doi:10.1021/ja00867a033.
- [17] Li, G. et al. An Improved PIII/PV═O-Catalyzed Reductive C–N Coupling of Nitroaromatics and Boronic Acids by Mechanistic Differentiation of Rate- and Product-Determining Steps. J. Am. Chem. Soc. (2020), doi:10.1021/jacs.0c01666.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
























No comments yet.