本文作者:杉杉
导读
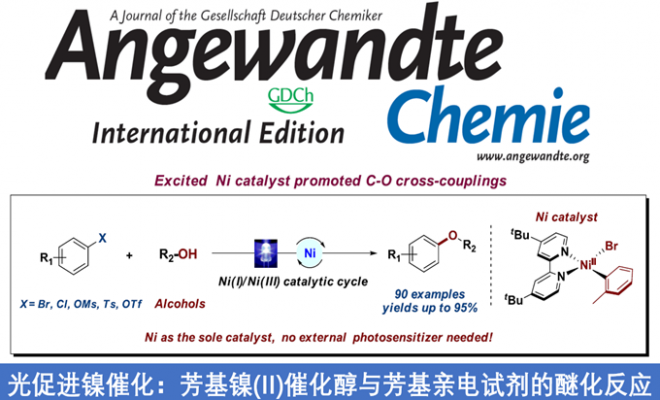
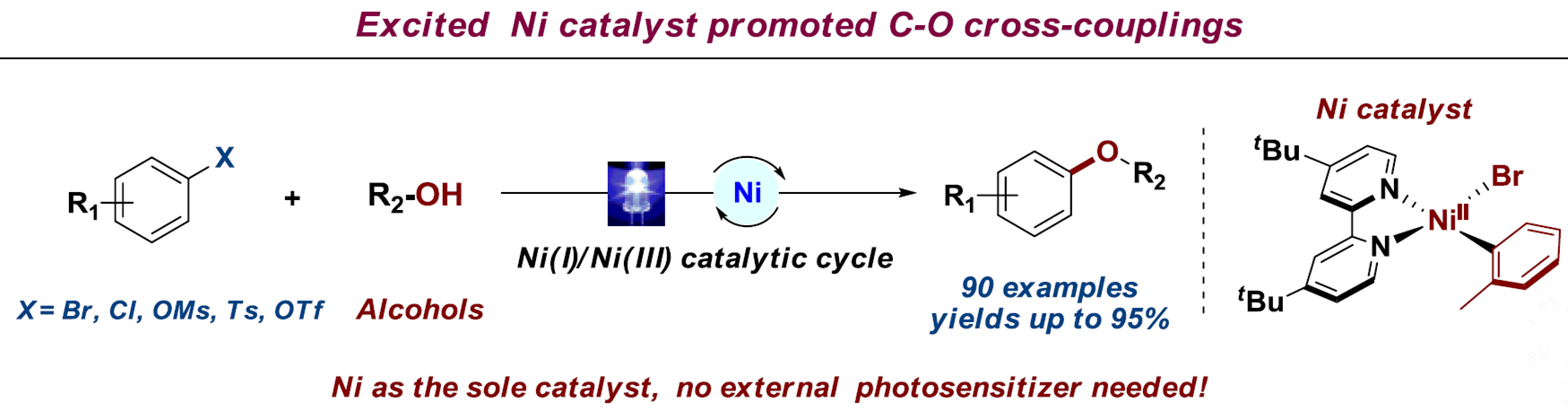
近日,陕西师范大学薛东教授课题组在德国应化杂志(Angewandte Chemie-International Edition)发表论文报道了,(杂)芳基亲电试剂与伯醇和仲醇的C-O偶联反应。在无其他光敏剂,使用可溶性的胺碱(DBU),并在长波紫外线(390-395 nm)辐射的条件下,可通过Ni(II)-芳基络合物进行催化,实现芳基溴(氯)化物、磺酸盐与多种伯(仲)脂族醇的醚化反应,获得多种醚衍生物。同时,分子内C-O偶联也能够实现。此外,该反应涉及Ni(I)-Ni(III)的催化循环过程。
Light-Promoted Nickel Catalysis: Etherification of Aryl Electrophiles with Alcohols Catalyzed by a Ni(II)/Aryl Complex
Liu Yang, Huan-Huan Lu, Chu-Hui Lai, Gang Li, Wei Zhang, Rui Cao, Fengyi Liu, Chao Wang, Jianliang Xiao, and Dong Xue
Angew. Chem. Int. Ed. ASAP DOI: 10.1002/anie.202003359
正文
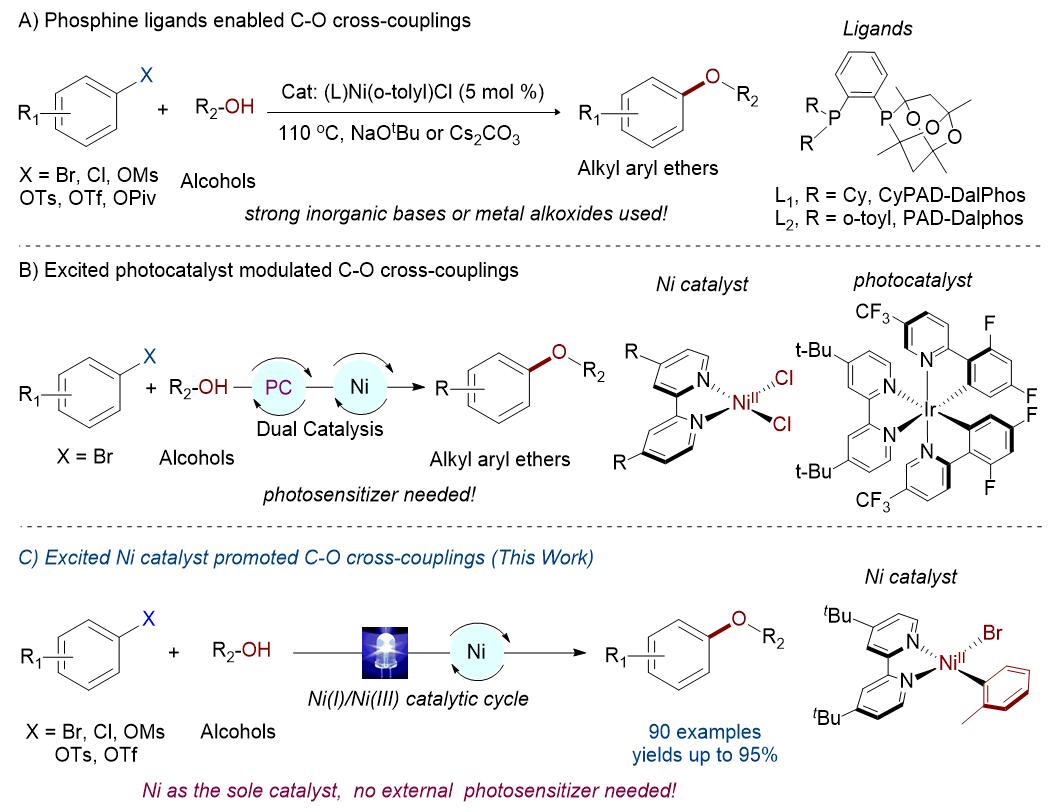
烷基芳基醚广泛存在于天然产物、农用化学品和药物中。通常,Williamson醚合成、Mitsunobu反应和亲核芳族取代反应等,作为合成烷基芳基醚化合物的常规方法。此外,由于各类亲电试剂和醇的种类繁多,如果能够以此为起始原料,并通过金属催化实现C-O交叉偶联,即可合成多种醚的衍生物。据文献报道,钯、铜已被最广泛地用于醚化反应,但镍催化研究相对较少。然而,此类C-O偶联反应常需使用强无机碱或金属醇盐,从而导致了溶解性、相容性、操作难度等问题。近期,Buchwald课题组发现使用胺碱,可克服上述的问题,并实现相关的C-N偶联反应。受此类文献的启发,作者设想,是否可以使用温和、可溶性的胺作为碱,使用较便宜的金属催化剂,实现醇类与亲电子试剂(廉价和丰富的(杂)芳基氯化物)偶联反应,从而获得多种烷基芳基醚衍生物。
Ni络合物很容易与Csp2-Cl之间发生氧化加成反应,从而使其成为(杂)芳基氯化物与醇的C-O交叉偶联反应中的经济型催化剂。最近,也有两篇文献报道了关于Ni催化芳基亲电试剂与醇的C-O偶联反应。使用带有富电子的二膦配体Ni(II)络合物作为催化剂,在加热的条件下,实现芳基亲电子试剂与醇的偶联过程,获得多种芳基醚衍生物(Scheme 1, A)。然而,此类反应需要使用高碱性的金属醇盐,同时一些对碱敏感的官能团均与体系不兼容。另一篇文献报道,通过光氧化还原和镍催化的结合,实现C-O偶联过程,其中光敏剂调节镍催化剂的氧化态(Scheme 1, B)。虽然此类反应具有一定的优势,但底物范围仅限于(杂)芳基溴化物,并且需要使用昂贵的铱光催化剂和不溶性无机碱。
最近,本课题组已报道了,使用有机光氧化还原和镍催化剂,并使用温和的N,N-二异丙基乙胺作为碱,实现芳基卤化物与水的羟基化反应。该反应结果表明,传统的强碱(如NaOtBu)和无机碱无法促进该反应,但当使用有机胺时,反应大幅提升。基于上述的总结,作者提出了一种以Ni(II)-芳基配合物作为催化剂,有机胺作为碱,无需使用光敏剂,可在光辐射的条件下,实现芳基亲电试剂与醇的C-O偶联反应(Scheme 1, C)。
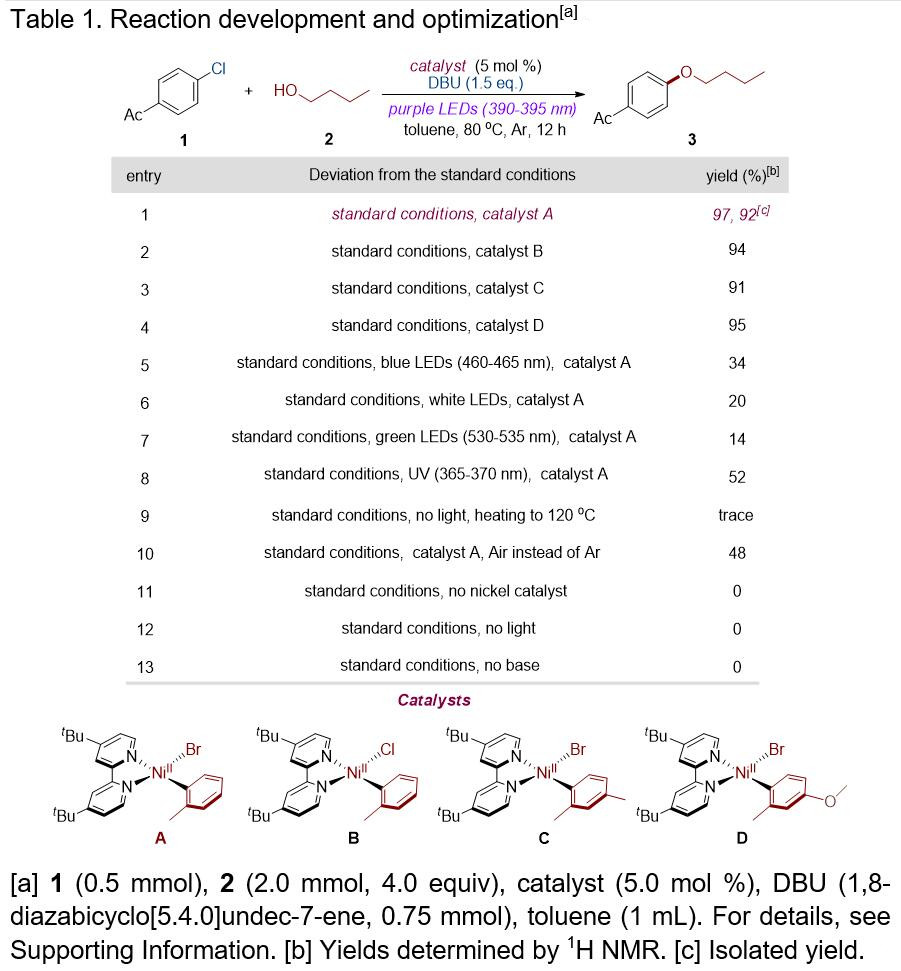
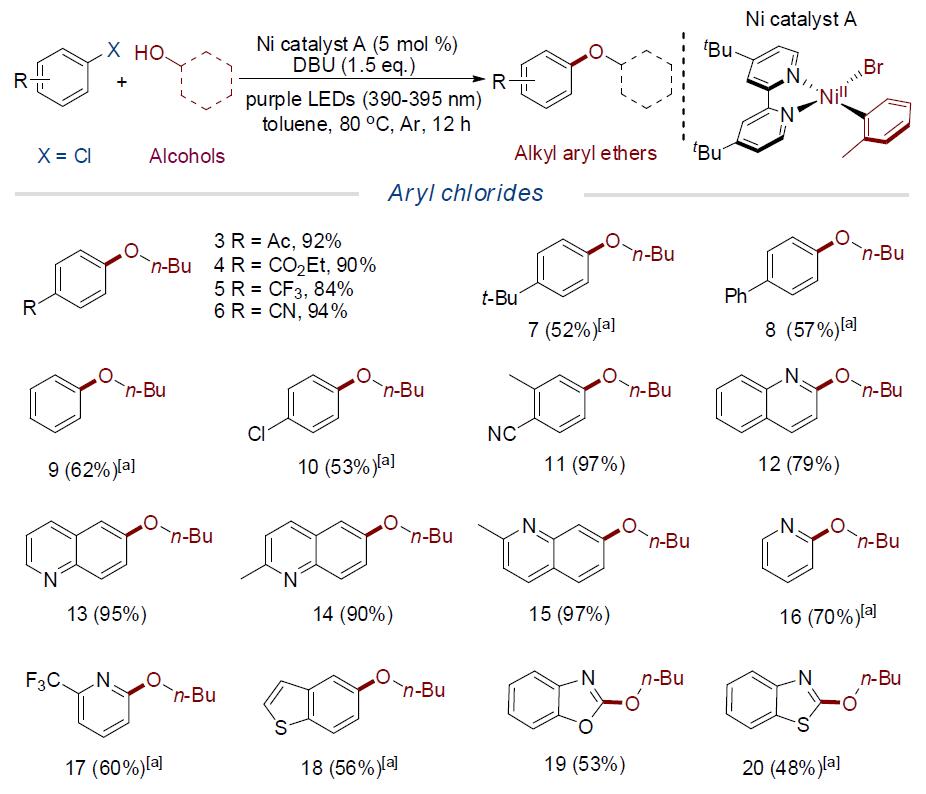
首先,作者以对乙酰氯苯1和正丁醇2作为模型底物,进行了相关偶联反应条件的筛选(Table 1)。在标准条件下,使用Ni(II)芳基卤化物络合物A–D时,均可获得高收率的偶联产物3(entries 1-4)。同时,光源对于该反应至关重要,只有长波紫外线(390-395 nm)才可以获得高收率的产物,虽然使用其他光源也可促进反应,但收率都偏低(entries 5-8),而在不使用光源的情况下,即使将反应温度升至120℃时,也不能促进反应(entry 9),进一步说明了长波紫外线的关键性作用。当反应体系中的氩气被氧气取代时,收率大幅降低(entry 10)。进一步的对照实验表明,在没有镍催化剂、光源或碱时,该反应不会进行(entries 11-13)。综上所述,在长波紫外光(390-395 nm)的氩气气体中照射,使用配合物A作为催化剂,DBU作为碱,在甲苯中80℃反应12 h,即可获得目标产物3(92%),作为此类反应的最佳条件。
在获得上述最佳反应条件后,作者开始对芳基亲电子试剂和醇的底物范围进行了扩展。首先,作者开始研究芳基氯化物的底物范围(Scheme 2)。反应结果表明,含酰基、酯、三氟甲基、氰基等吸电子基团的芳基氯化物,可与正丁醇反应,获得高收率的产物3–6。值得注意的是,一些在强碱性条件下,不易获得含有酯和氰基的官能团的产物,也能够通过此反应获得。更为重要的是,一些具有电子中性芳基氯化物,也能够在使用较高催化负载量(15 mol %),获得目标产物7–9。与文献中铜和镍催化体系对比,该反应可在较低的温度下实现。然而,具有富电子的芳基氯化物(如4-氯茴香醚),在该体系中没有活性。而对于带有氯取代基的芳基氯时,单醚化产物10作为主要产物,为后期转化提供了多种可能。此外,一系列(杂)芳基氯化物也与体系兼容,如喹啉、吡啶、苯并噻吩、苯并恶唑、苯并噻唑等,分别获得相应的产物12–20,这类结构作为药物分子的重要组成部分。
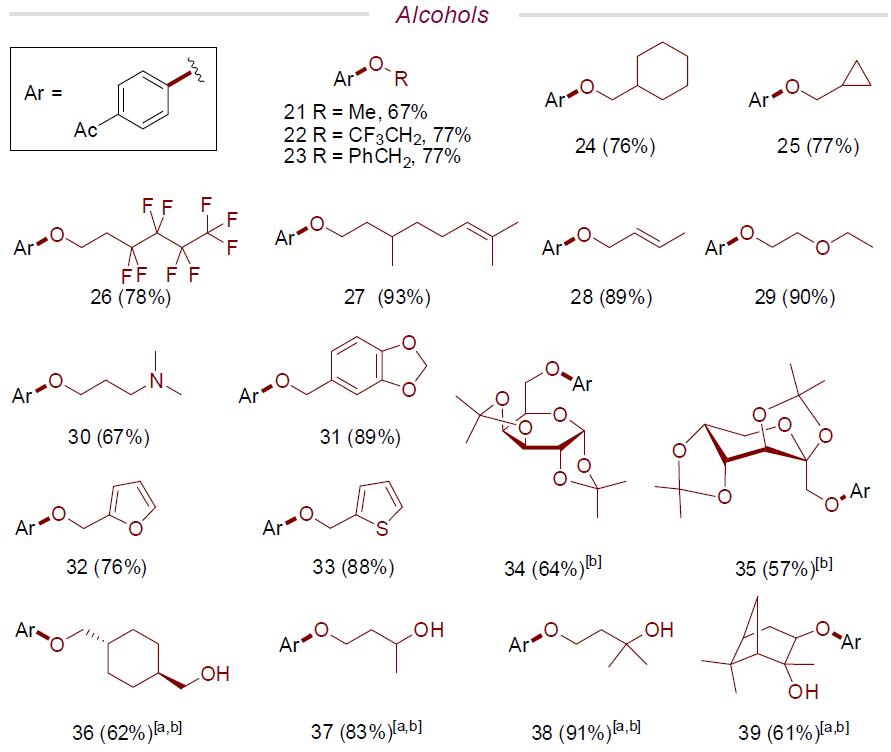
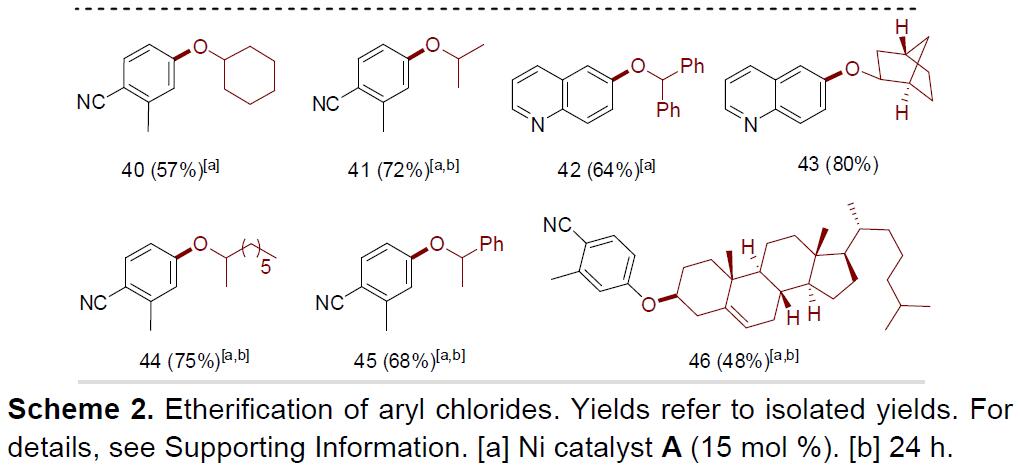
紧接着,作者开始对各类醇的底物范围进行了扩展(Scheme 2)。当使用最为常见的甲醇作为底物时,可获得良好收率的产物21,作为合成苯甲醚衍生物的新途径。同时,含有脂肪基、三氟乙醇、烯基、氨基、呋喃基、噻吩基等醇的底物,均可获得相应的苄基产物22–33。值得注意的是,含有取代氨基、噻吩基团的底物,并不会导致催化剂中毒。此外,D-吡喃半乳糖和果糖的碳水化合物中的醇也能够参与反应,获得产物34–35。同样,二醇底物也可取得较好的结果,获得产物36–39,值得注意的是,单取代的产物为主要产物,并且选择性主要发生在空间位阻较小的醇上。尽管仲醇与乙酰氯苯1的偶联反应性较低,但当使用较高的催化负载量(15mol%)和较长的反应时间(24h)时,可以获得良好的产率的醚化产物40–46。
随后,作者对芳基溴化物的底物范围进行了扩展(Scheme 3)。反应结果表明,具有多种官能团的芳基溴化物可与两当量的醇进行反应,从而获得较高收率的产物47–57。值得注意的是,对于同时带有氯和溴取代的芳基溴化物,可以以良好的收率获得相应的单取代产物49和50。带有给电子或吸电子基团的二取代的芳基溴化物也与体系兼容,获得高收率的产物53–57。同样,各种(杂)芳基溴化物(如喹啉、咔唑、苯并噻吩和吲哚)也与体系相容,从而获得良好收率的醚化杂芳烃产物58–60、13和18。然而,在标准反应条件下,带有甲氧基、羧酸、酰胺或邻位取代基的芳基溴化物,均没有取得较好的结果。
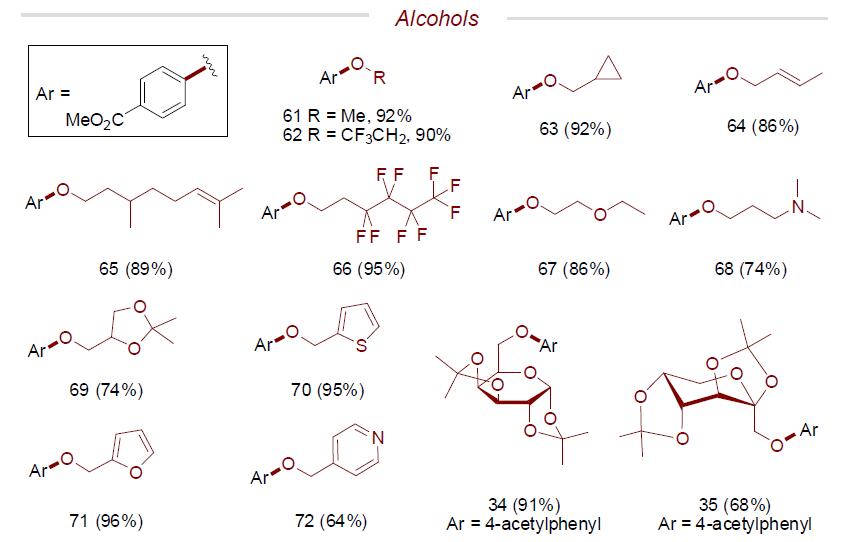
紧接着,作者也对各类醇的底物范围进行了扩展(Scheme 3)。反应结果与芳基氯化物一致,同样具有良好的官能团耐受性,获得相应的产物61–79。此外,为了进一步证明该醚化方案的实用性,作者开始研究分子内C-O键偶联反应,反应同样具有较好的结果,获得相应的五元和六元环产物80–90。同时,通过对化合物88的克级实验,进一步证明了该方案在合成复杂分子中的巨大潜力。
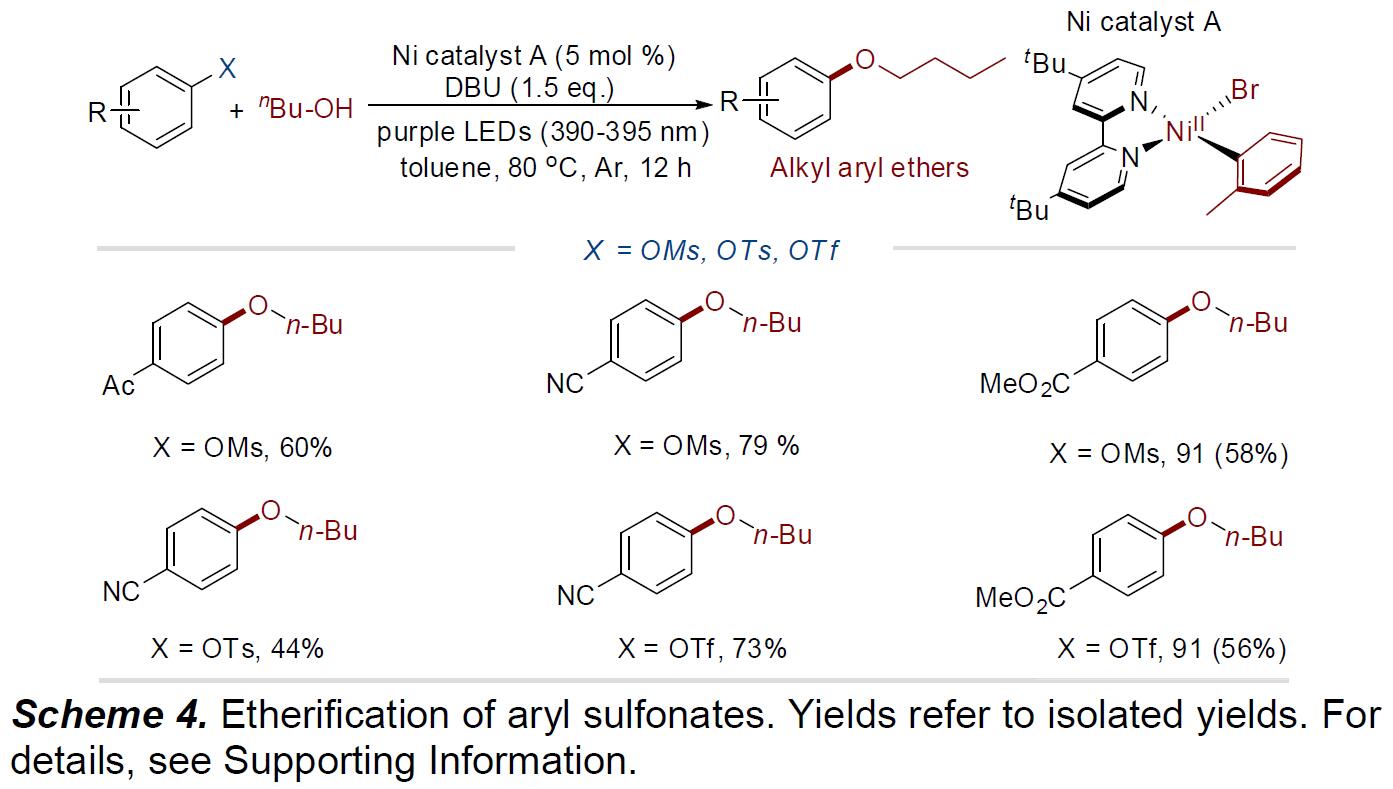
最后,作者将亲电试剂的范围扩大到了磺酸盐(Scheme 4)。反应结果表明,甲磺酸酯、甲苯磺酸酯和三氟甲磺酸酯均可与正丁醇进行偶联反应,从而获得相应的醚化产物。
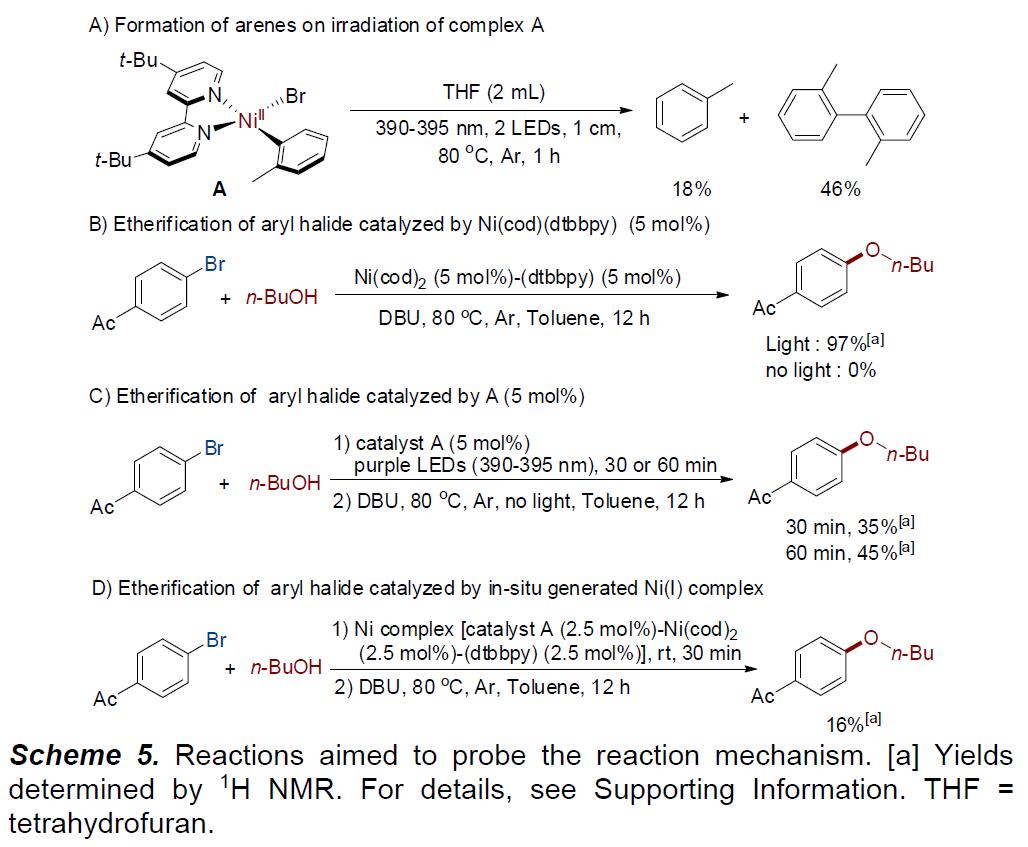
为了进一步了解反应的机理,作者进行了相关的对照实验(Scheme 5)。根据Doyle所报道的文献,配合物A可充当光催化剂,实现Ni(I)- Ni(III)的催化循环过程。首先,配合物A在390-395 nm下照射1h时,获得大量的芳烃,表明同时形成了Ni(I)配合物(Scheme 5, A)。当在标准条件下,使用Ni(0)配合物Ni(dtbbpy)(cod)作催化剂时,反应可获得高收率的产物。然而,在无光的条件下,并没有观察到所需的产物(Scheme 5, B),进一步说明了Ni(II)或Ni(0) 催化剂,都需要光来实现C-O偶联。随后,在长波紫外线下将Ni(II)配合物A照射30分钟,然后将其放入黑暗中反应12小时,以35%的低收率获得了相应的产物,而当初始辐照延长至60分钟时,产率有所增加(Scheme 5, C)。此外,使用催化剂A 和Ni(dtbbpy)(cod)制备的Ni(I)配合物用作催化剂时,仅在加热条件下获得16%产率的产物(Scheme 5, D)。
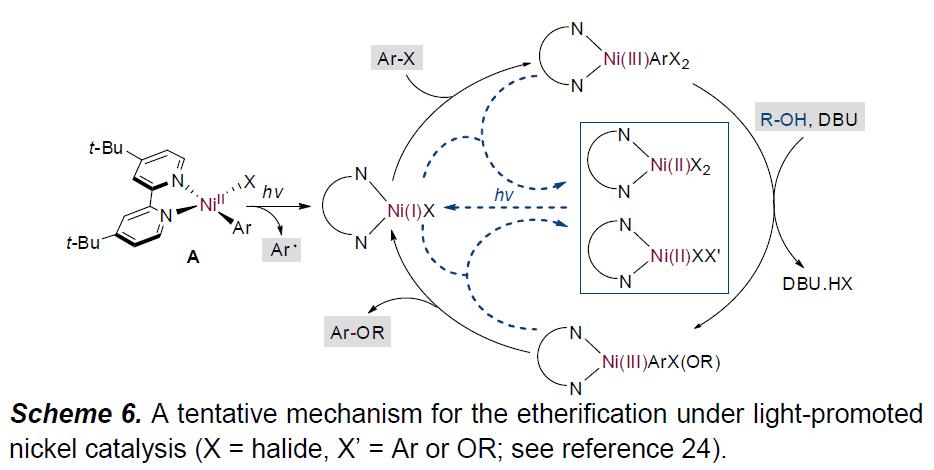
根据上述的实验和相关文献的查阅,作者提出了一种可能的反应机理(Scheme 6)。首先,在390-395 nm处照射A,经镍-碳键的均化作用,生成Ni(I) 和芳基自由基。紧接着,Ni(I)配合物与芳基卤化物进行氧化加成生成Ni(III)-Ar中间体,再与醇进行配体交换,最终经还原消除,从而生成Ni(I)配合物和目标偶联产物。此外,连续照射对于反应至关重要,可能是由于惰性的Ni(II) 催化剂需要在辐照的条件下才能转化为活性的Ni(I)配合物。
总结
陕西师范大学薛东教授课题组报道了一种高效的光促进的C-O偶联反应,该反应使用空气稳定的Ni(II)-芳基卤化物配合物作为催化剂,DBU作为碱,无需使用光敏剂。同时,该反应具有广阔的底物范围,脂肪族的伯、仲醇均可与各种具有不同官能团的(杂)芳基亲电试剂偶联,包括芳基溴(氯)化物、磺酸盐。此外,反应机理涉及Ni(I)-Ni(III)催化循环过程。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
















No comments yet.