本文作者:杉杉
导读
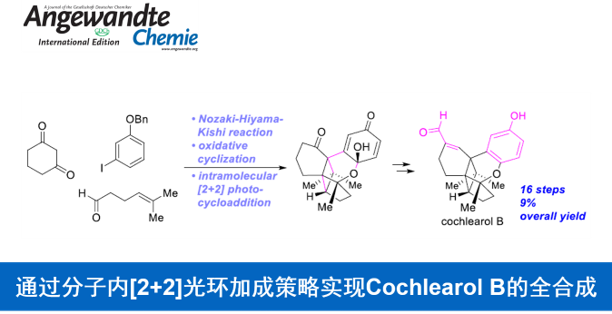
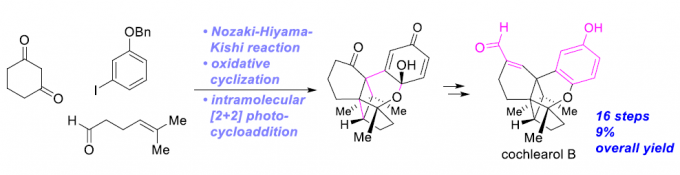
近日,日本Hoshi大学的Sugita Kazuyuki (杉田 和幸)课题组在Angew. Chem. Int. Ed.中发表论文,首次完成具有4/5/6/6/6稠合五环骨架的混源萜类 (meroterpenoid)天然产物Cochlearol B的全合成。其中,关键步骤主要涉及:氧化环化反应以及后续的分子内[2+2]光环加成反应,进而高度立体选择性地完成Cochlearols B分子中相应五环骨架的构建。最终,作者采用16步的反应步骤,以9%的总收率,获得天然产物Cochlearol B。同时,该小组通过X-射线晶体学分析,进一步确定Cochlearol B的立体构型。
Total Synthesis of Cochlearol B via Intramolecular [2+2] Photocycloaddition
T. Mashiko, Y. Shingai, J. Sakai, S. Kamo, S. Adachi, A. Matsuzawa, K. Sugita,
Angew. Chem. Int. Ed. ASAP doi: 10.1002/anie.202110556.
正文
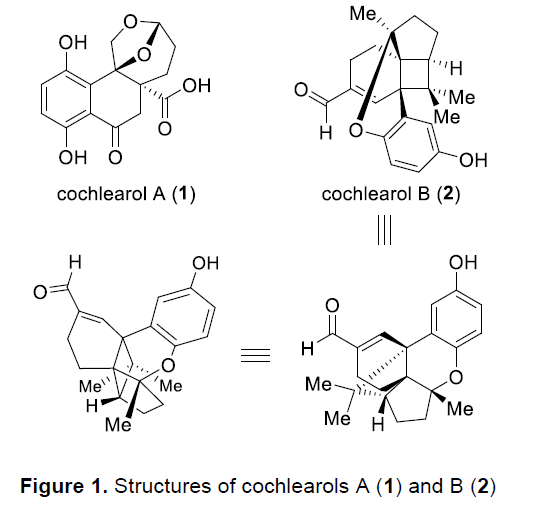
Ganoderma类真菌广泛分布于亚热带与热带地区,在中国,Ganoderma类真菌称为灵芝。其中,G. lucidum与G. sinense已经列入《中华人民共和国药典》。而其它的Ganoderma类真菌同样能够作为中草药,用于癌症、高血压、慢性支气管炎以及哮喘等疾病的治疗。2014年,Cheng课题组[1]在G. cochlear的子实体中,成功分离出Cochlearols A (1)与B (2)的外消旋体,并通过NMR与HRMS分析,对其结构进行推测 (Figure 1)。同时,生物学的初步研究表明,1与2可能具有良好地肾脏保护活性。而迄今为止,已经有三家研究团队[2]独立报道 Cochlearols A (1)的全合成。然而,由于Cochlearol B的化学结构中具有4/5/6/6/6稠合的五环骨架,同时具有四个立体生成中心以及四个四级碳原子,因此,Cochlearol B的全合成将面临诸多挑战。并且,Cochlearol B的全合成目前尚未有相关的文献报道。这里,K. Sugita课题组首次完成Cochlearols B (2)的全合成,并通过X-射线晶体学分析,成功确定其立体构型。其中,Sugita小组全合成路线设计中的关键步骤主要涉及氧化环化以及后续的分子内[2+2]光环加成反应,进而顺利完成Cochlearols B分子中五环骨架的构建。
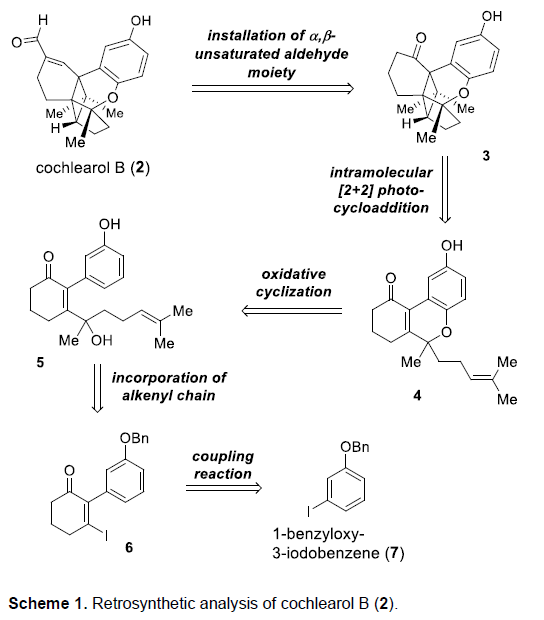
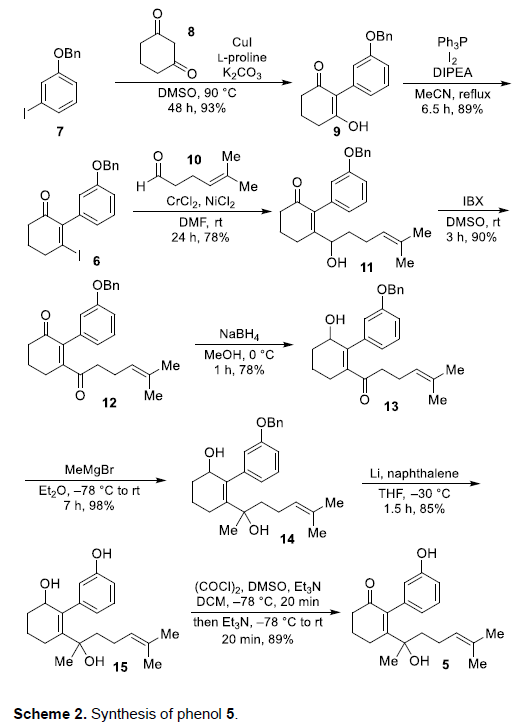
Cochlearol B的逆合成分析过程如 Scheme 1所示。首先,作者推测,由于α,β-不饱和醛结构单元具有显著的不稳定性以及较高的反应活性,因此,需要在全合成过程的后期进行引入。同时,作者假设,2能够通过酮3进行合成。而本课题对于Cochlearol B全合成路线设计的关键步骤则在于通过烯酮砌块4进行的分子内[2+2]光环加成反应。而砌块4中的三环骨架,能够通过苯酚衍生物5的氧化环化步骤进行构建。接下来,作者采用烯基碘砌块6 (能够通过1-苄氧基-3-碘苯 (7)较为方便地进行合成)参与的Nozaki-Hiyama-Kishi反应过程,进而完成烯键与醇结构单元的引入。
酚类砌块5的合成 (Scheme 2)。首先,该小组在CuI催化下,通过市售的芳基碘7与1,3-环己二酮8之间的偶联过程,获得93%收率的烯醇化合物9。之后,通过I2-PPh3体系促进的碘化过程,将烯醇化合物9转化为相应的烯基碘中间体6 (89% 收率)。接下来,通过烯基碘中间体6与醛10之间的Nozaki-Hiyama-Kishi偶联过程,以78%的收率获得相应的二级醇11。再通过二级醇11的氧化以及后续采用NaBH4还原剂进行的区域选择性还原过程,获得70%收率的羟基酮13。之后,通过Grignard试剂,将甲基引入至13中,进而获得二级醇14。并通过锂-萘体系去除苄基,进而获得烯丙醇化合物15 (83% 收率)。接下来,烯丙醇化合物15通过Swern氧化过程,形成酚类砌块5,收率为89%。
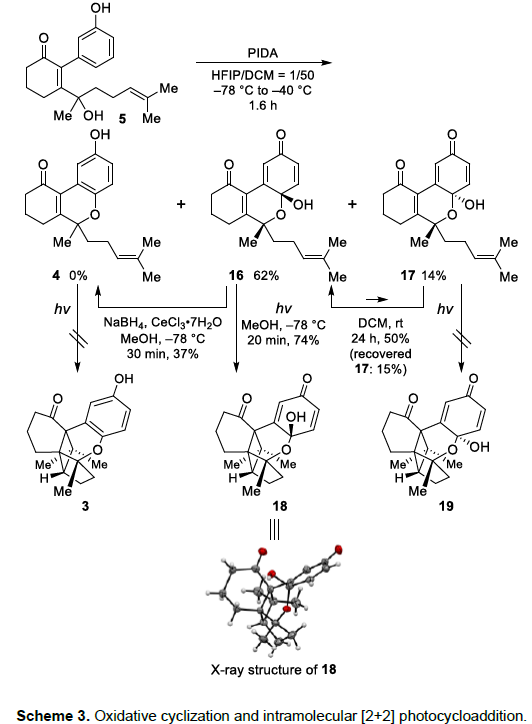
五环骨架的构建 (Scheme 3)。通过PIDA对酚类砌块5的氧化环化过程,能够获得62% 收率的三环半缩醛分子16,同时伴随非对映异构体17 (14% 收率)的形成。同时,在DCM溶剂中,能够形成非对映异构体17与16的平衡混合物。之后,通过Luche还原过程,能够将化合物16转化为对苯二酚砌块4。接下来,作者开始对相关的分子内[2+2]光环加成过程进行深入研究。更新中发现,与预期相反,对苯二酚砌块4在-78 oC以及汞灯辐射的条件下,并未获得相应的五环砌块3。而且,提高反应温度,则获得较为复杂的混合物。另一方面,在三环半缩醛分子16中,由于存在二烯酮环的共轭,进而使烯键更为缺电子,因此,在-78 oC以及汞灯辐射的条件下,16能够顺利进行相应的分子内[2+2]光环加成过程,并以74%的反应收率,获得相应的五环化合物18。同时,该小组通过X-射线晶体学分析,进一步确定化合物18的立体构型。接下来,该小组发现,五环化合物19则无法通过化合物17的分子内[2+2]光环加成过程获得,可能源自于化合物17中α-OH官能团的立体位阻对于光环加成过程的抑制。
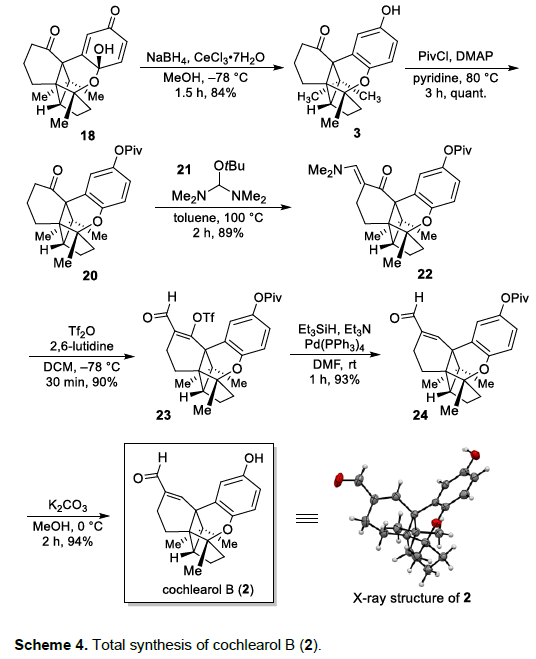
Cochlearol B的全合成 (Scheme 4)。在获得五环砌块18之后,后续的挑战则在于α,β-不饱和醛结构单元的引入。令人欣喜的是,五环砌块18在经历Luche还原之后,能够获得84%收率的苯酚衍生物3。接下来,将苯酚衍生物3通过新戊酰氯进行处理,能够以定量的反应收率,获得相应的酮砌块20,接下来,将酮砌块20通过Bredereck试剂21处理之后,再进一步与三氟甲磺酸酐作用,进而以80%的反应收率,获得相应的三氟甲磺酸酯衍生物23。之后,在钯催化剂存在下,采用三乙基硅烷对砌块23进行还原,能够以93%的收率,获得砌块24。最后,砌块24通过碱性条件下的去保护过程,即去除新戊酰基,进而顺利完成Cochlearol B (2)的全合成 (94% 收率)。同时,作者发现,通过上述路线,最终获得的Cochlearol B的光谱数据 (主要涉及1H-NMR、13C-NMR以及HRMS) 能够与文献报道的天然产物Cochlearol B的相关数据完全匹配。此外,作者通过X-射线晶体学分析,进一步确定Cochlearol B的立体构型。
总结
日本Hoshi大学的K. Sugita课题组采用市售的芳基碘7作为起始原料,通过16步的线性合成路线设计,最终以9%的总收率,首次完成天然产物Cochlearol B (2)的全合成。其中,通过α,β-不饱和酮砌块16的分子内[2+2]光环加成步骤,能够有效地完成Cochlearol B (2)分子中五环骨架的构建。此外,这一全合成路线设计中的关键反应主要涉及:Nozaki-Hiyama-Kishi反应、酚类衍生物5的氧化环化以及后续的相关转化。同时,该小组通过X-射线晶体学分析,进一步确定五环化合物18以及天然产物Cochlearol B (2)的立体构型。
参考文献
[1] M. Dou, L. Di, L. Zhou, Y. Yan, X. Wang, F. Zhou, Z. Yang, R. Li, F. Hou, Y. Cheng, Org. Lett. 2014, 16, 6064. doi: 10.1021/ol502806j. [2] a) D. Zhang, W. Xu, H. Fan, H. Liu, D. Chen, D. Liu, H. Qin, Org. Lett. 2019, 21, 6761. doi: 10.1021/acs.orglett.9b02391.b) K. Naruse, R. Katsuta, A. Yajima, Nukada, H. Watanabe, K. Ishigami, Tetrahedron Lett. 2020, 61,15845. doi: 10.1016/j.tetlet.2020.151845.
c) T. Venkatesh, P. S. Mainkar, S. Chandrasekhar, Org. Chem.2021, 86, 5412.doi: 10.1021/acs.joc.1c00205.

















No comments yet.