Scripps研究所・Phil S. Baran等人,受到生物体中的亚胺引发的环化反应的启发,开发出了大环多肽的合成方法,合成了多种构造多样的大环多肽。反应的亮点是在水中进行而且氨基酸侧链无需保护。生成的亚胺可以进一步进行官能团修饰,得到更多功能丰富的产物。
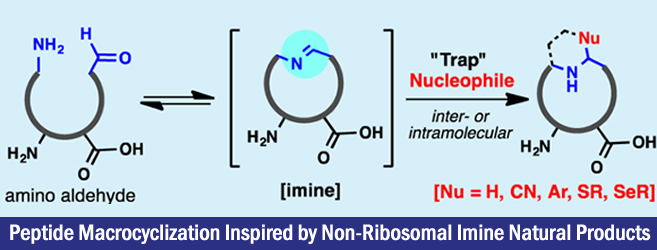
Peptide Macrocyclization Inspired by Non-Ribosomal Imine Natural Products
Malins, L. E.; deGruyiter, J. N.; Robbins, K. J.; Scola, P. M.; Eastgate, M. D.; Ghadiri, M. R.; Baran, P. S.* J. Am. Chem. Soc. 2017, 139, 5233. DOI: 10.1021/jacs.7b01624 (封面图片来自论文)
问题设定与解决方法
分子量在500~2000左右的中分子,具有蛋白质-蛋白质相互作用的阻断功能,近年来作为新药研发的目标化合物,需求逐渐增大。其中以具有蛋白酶耐受性,膜透过性与药物特性的大环状多肽为代表,备受瞩目。
Baran等人参考了环状多肽的生物合成路径,通过多肽末端的一级胺与另一端的醛基直接环化的方法,开发出了多种多样的大环状多肽的合成手法。原料与产物imine呈平衡状态,但是添加适当的亲核试剂后能够使得反应平衡向产物端进行(如标题图所示)
具体操作手法
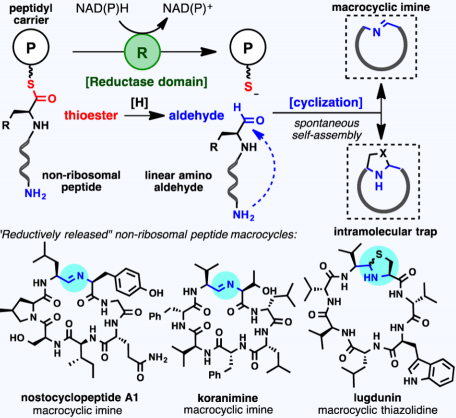
非核糖体多肽(non-ribosomal peptide)[1],之前小编也有过介绍,是一类具有多样性结构与生物活性的多肽化合物。而其中有一部分是经由还原酶还原,再环化形成的(下图所示)。而本论文的idea就是来自这个体内大环多肽的合成法。
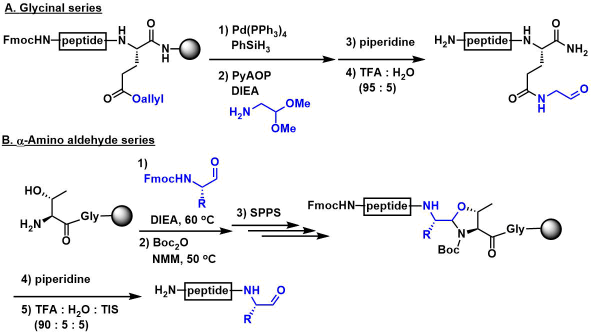
为了本方法的有效性,首先必须合成末端具有醛基结构的线性多肽底物。作者用Rink amide树脂进行Fmoc固相合成法合成了所需底物。(参照下图所示)
主张的有效性验证
①环化反应的条件筛选
本环化反应在水中或者缓冲液中进行。作者通过筛选发现,反应最佳浓度为1 mM。提高底物的浓度的话,会伴有分子间反应的发生,并且环化反应条件下醛部位会被优先还原。并且该反应是一个平衡反应,即使是1 mM的溶液状态,长时间放置的话,多肽环也会解离,伴有产率降低等等问题的发生。
②底物拓展
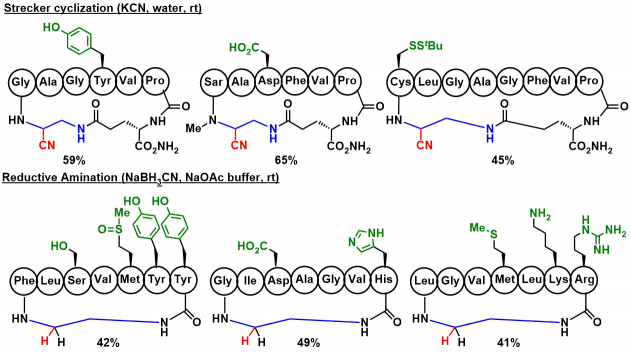
对于Tyr, His, Ser, Asp, Arg, Gln, シスチン(Cys-Cys)等を含有5~10残基的多肽、都可以进行strecker型或者还原胺化环化反应,并且氨基酸残基无需任何保护基。对于含有Lys的底物,只需要调整好pH,反应也能基本发生在N末端的胺基上,但是也有一小部分与Lys侧链反应,生成的副产物的分离比较困难。因此在含有Lys的底物的话,最好是Lys侧链的末端胺基保护后再进行反应为佳。
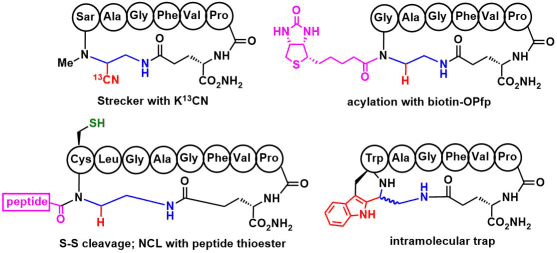
③生物正交的官能团导入
strecker型反应可以很容易的导入13C标记的碳原子。而还原性的胺基化反应由于生成的是2级的胺,所以该二级胺可以作为一个反应位点,继而导入些如生物素,炔烃基团用于后续的荧光标记等等。同时环化N末端的氨基酸如果是Cys、Ser、His、Trp等情况的话,生成的imine中间体也能进行分子内的trap,得到具有刚直结构的缩环结构。
④氨基酸的配列对环化的影响
作者最后对天然环状多肽与人工排列的环状多肽进行温度可变的NMR测定,从N-H键的化学位移发现天然的非核糖体多肽具有更强的分子内氢键相互作用,并且他们的前体也更容易进行环化反应()。并且天然的非核糖体多肽由于疏水性的氨基酸的含有率较高,所以疏水性的相互作用也是对其性质具有重要的作用的。
comment
- 这个课题是与美国制药界巨头施贵宝(BMS)的一项共同研究。顺带说一下,施贵宝在2010年就开始与肽雷姆公司一起,研究特殊环状的多肽药物,并且在去年已经进行到临床试验了。
参考文献
- Schwarzer, D.; Finking, R.; Marahie, M. Nat. Prod. Rep. 2003, 20, 275. DOI: 10.1039/B111145K
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.