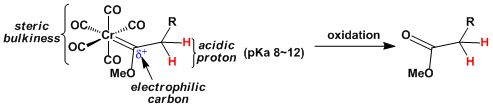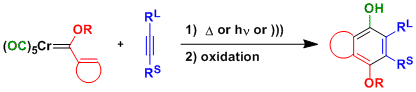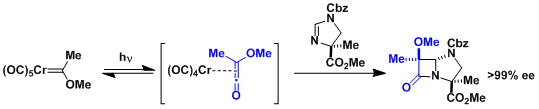概要
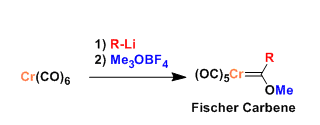
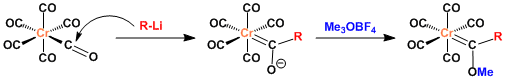
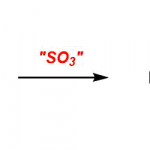
羰基铬上的羰基配体与有机锂试剂反应生成的醇锂,在重氮甲烷或者Meerwein试剂等hard甲基化试剂的存在下,反应生成费舍尔卡宾配合物。
由于Cr上的多个羰基配体的吸电子效应,卡宾上的碳很容易被亲核进攻。同样的,由于卡宾碳的α位的H的酸性增大(pKa~12),容易被碱拔氢。生成的阴离子可以与多种亲电子试剂反应。因此费舍尔卡宾配合物在有机合成化学上可以视作酯的等价体。
基本文献
- Fischer, E. O; Maasbol, A. Angew. Chem. Int. Ed. 1964, 3, 580. DOI: 10.1002/anie.196405801
- de Meijere, A.; Schirmer, H.; Duetsch, M. Angew. Chem. Int. Ed. 2000, 39, 3964. [abstract]
- Barluenga, J.; Fernandez-Rodrguez, M. A.; Aguilar,E. J. Organomet. Chem. 2005, 690, 539. doi:10.1016/j.jorganchem.2004.10.032
反应机理
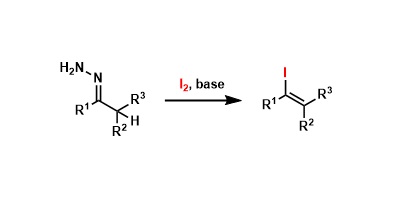
反应实例
芳取代的Fischer卡宾配合物与炔烃混合加热,进行环化反应,然后通过氧化处理得到4-alkoxyphenol产物。(Dötz反应)[1]
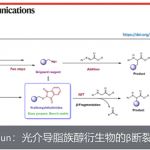
下图所示配合物在光照下形成烯酮。然后通过Staudinger[2+2]环化,最终合成β内酰胺的应用实例。
实验步骤
实验技巧