本文作者:石油醚
天然产物中含有一种复杂的桥联结构,化学家经过长期的努力已经鉴定含有桥环结构的天然产物(从萜烯到类固醇再到生物碱)有着独特的生物学活性。例如我们所熟知的豆蔻油,豆蔻醇,紫杉醇,长春花碱等很多桥联结构的天然产物。桥联 [m.n.1]框架,(如双环[3.3.1],双环[4.2.1],双环[4.3.1],双环[4.4.1]和双环[5.3.1])广泛存在于天然产物的结构中1。下面对这些不同桥联结构的天然产物进行介绍。
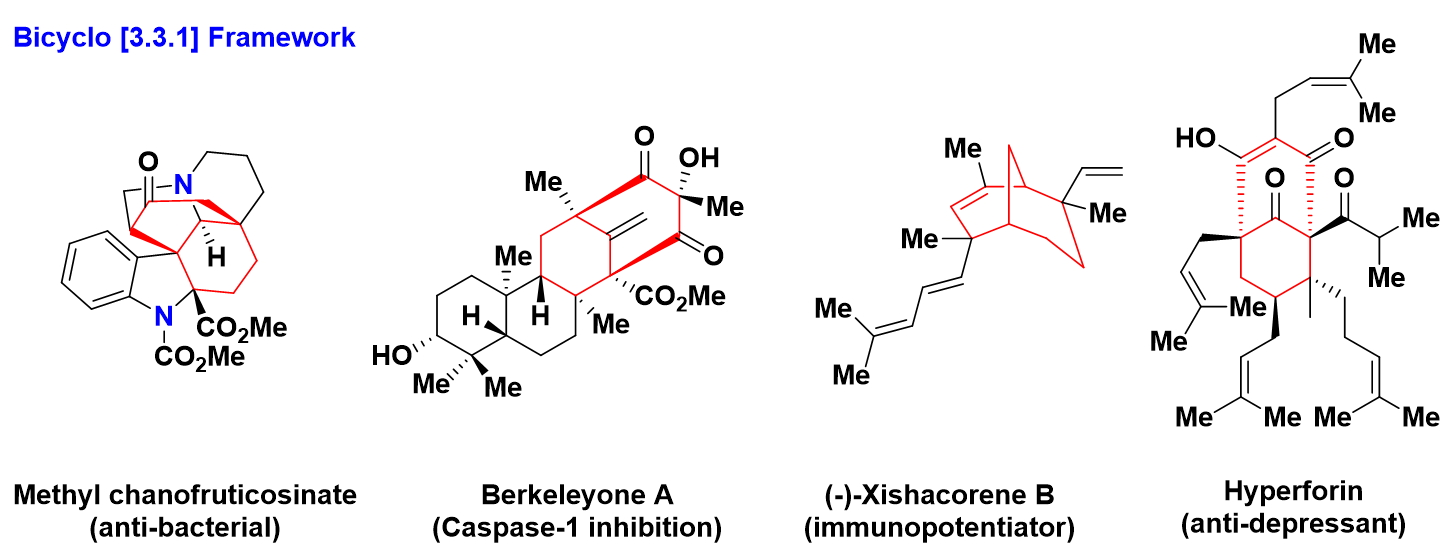
- 双环[3.3.1]框架
双环[3.3.1]框架的天然产物有很多,包括i)从云南蕊木中分离得到具有抗菌作用的蕊木碱甲酯2(Methyl chanofruticosinate),ii)从伯克利·皮特湖中的青霉菌等数十种的真菌和细菌中分离得到具有抑制Caspase-1蛋白与阿尔茨海默氏症相关的神经炎和帕金森病的萜类化合物伯克利酮 A3(Berkeleyone A),iii)从中国西沙群岛沿岸的软珊瑚Sinularia polydactyla分离得具有它们具有作为刀豆球蛋白A诱导的T淋巴细胞增殖的启动子作用的西沙克汀B4(Xishacorene B),iv)从圣约翰草(Hypericum perforatum L.)中分离出来具有TRPC6生物学探针,用来治疗抑郁症和其他人类疾病的Hyperforin5。(scheme 1)
Scheme 1 双环[3,3,1]框架结构的天然产物
- 双环[4.2.1]框架
天然产物中含[4,2,1]骨架的药物分子也很多,其中包括i) 从植物Rauwolfia serpentina根中获得对心脏的抗心律失常作用的吲哚生物碱Ajmaline6, ii)植物Echinops spinosus根中获得的Echinopine A7,iii)重级松节油提取出来的一种天然香料,并且具有抗菌和抗结核病的Longifolene8,iv)海洋褐藻中提取具有抗癌作用的Mediterraneol9。(scheme 2)
Scheme 2 双环[4,2,1]框架结构的天然产物
- 双环[4.3.1]框架
番石榴叶中分离得到具有对肝癌细胞具有抗增殖活性作用的Psiguadial B10,最辉瑞公司从一个未鉴定的真菌的培养液中分离得到具有抑制角鲨烯合酶和Ras法尼基转移酶作用的CP-263,114 (Phomoidride B)11,抗肿瘤作用Welwistatin,180多中茶树生物碱中的Calyciphylline N12。以上天然产物结构都有一种共同的骨架结构(双环[4.3.1]框架),由于这种特殊的结构赋予了它们特殊的药物活性。(scheme 3)
Scheme 3 双环[4,3,1]框架结构的天然产物
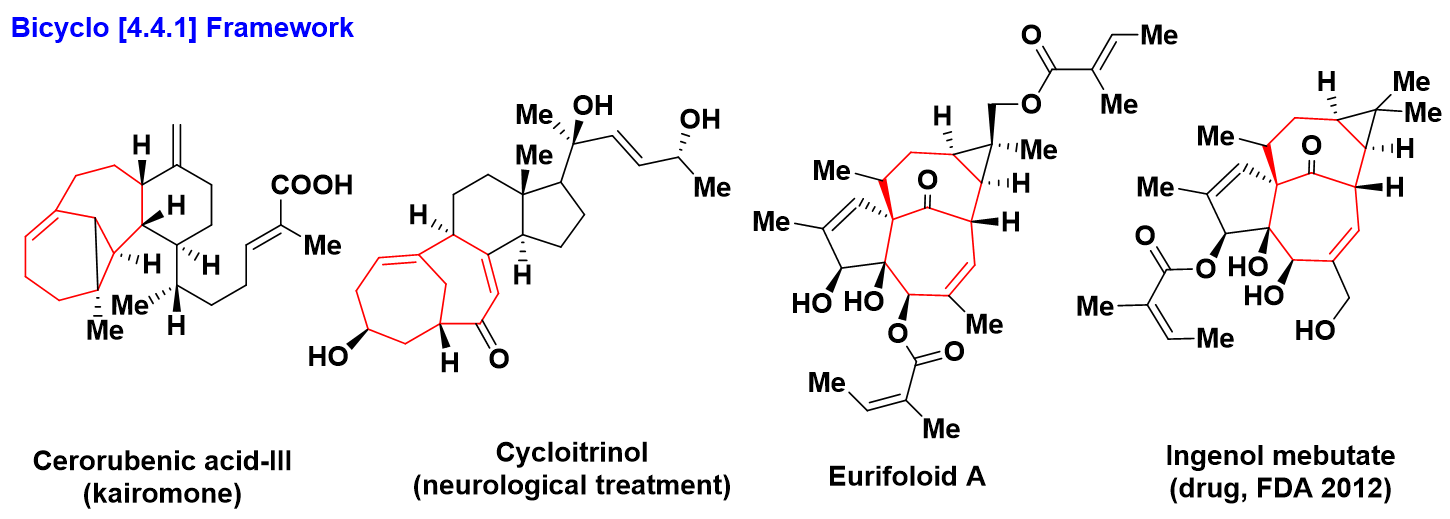
- 双环[4.4.1]框架
Rubens 菌分泌物获得充当独特识别行为的天然产物Cerorubenic Acid-III13,青霉菌中提取具有其在治疗各种神经系统疾病中的潜在用途(将GPR12传染的CHO细胞中诱导产生cAMP)的天然产物Cycloitrinol14,麒麟掌植物中分离得到具有抑制癌细胞和HIV活性的金刚烷二萜结构的Eurifoloid A15,2012年FDA基于Eurifoloid A结构开发第一例局部治疗光化学性角化病Ingenol mebutate。以上天然产物具有双环[4,4,1]框架,由于该骨架结构赋予了化合物独特的功能,结构决定其功能。(scheme 4)
Scheme 4 双环[4,4,1]框架结构的天然产物
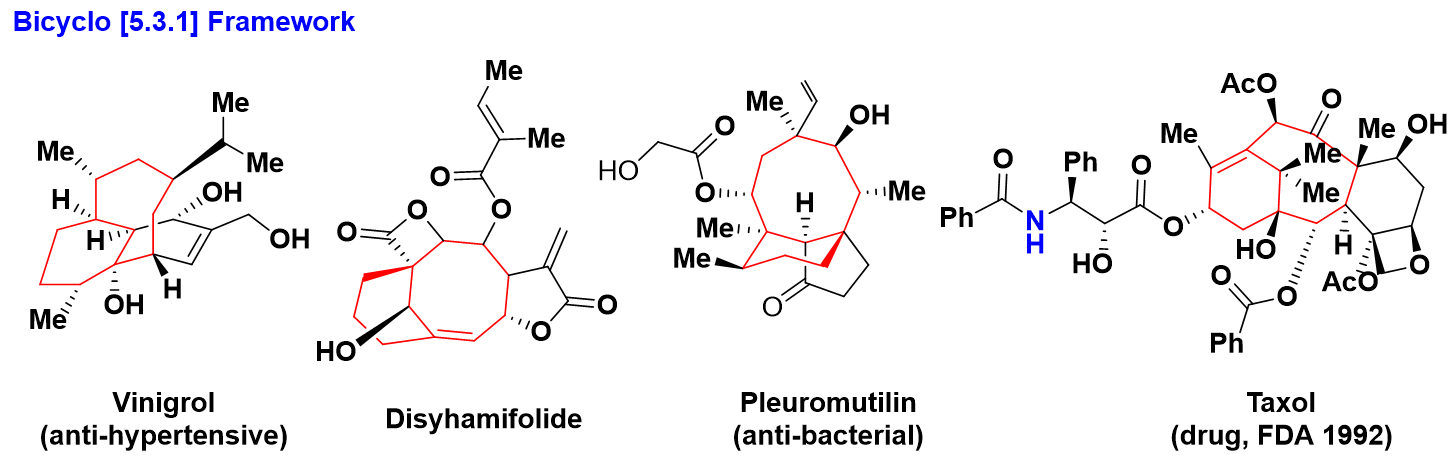
- 双环[5.3.1]框架
双环结构[5,3,1]广泛存在于一下天然产物中。i)天然产物Vinigrol是由日本科学家Hashimoto及其合作者16在具有抗高血压和抑制血小板凝聚活性的霉菌Virgaria nigra F-5408中提取出来的一种具有抗高血压,用作肿瘤坏死因子(TNF)拮抗剂17(治疗内毒素休克、炎症、感染和恶化的药剂,甚至可以被用作阻止艾滋病携带者)的新颖二萜类化合物,ii)天然产物Disyhamifolide 是从植物Disynaphia halimifolia分离获得18,iii)天然产物Pleuromutilin19是从真菌(Clitopilus passeckerianus)中提取出来的一种具有抗菌作用的二萜化合物, iv)天然药物Taxol20是沃尔和瓦尼于1966年在太平洋紫衫中提取出来具有抑制细胞的有丝分裂,抑制肿瘤细胞和抗癌症活性的药物分子21,22。(scheme 5)
Scheme 5 双环[5,3,1]框架结构的天然产物
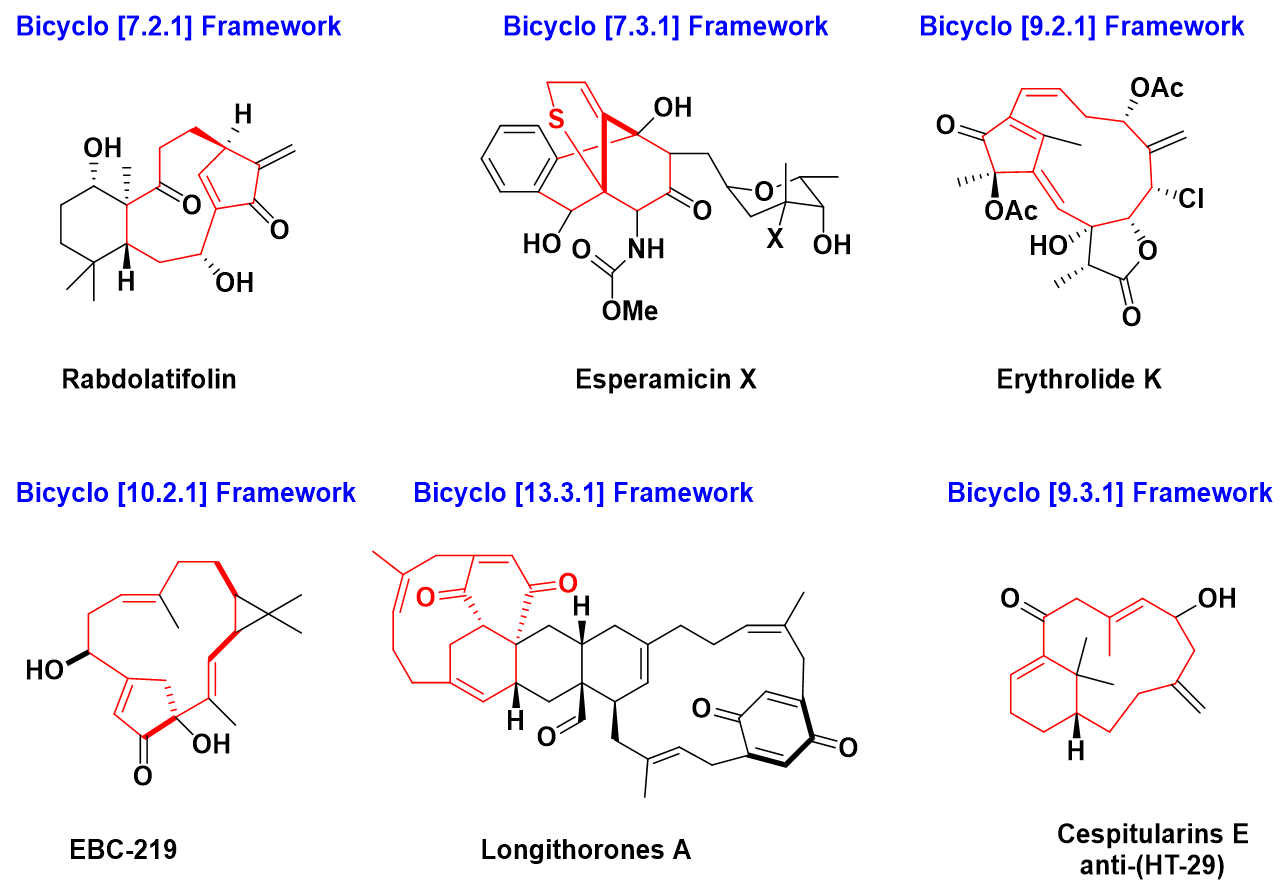
- 其他双环系统
除了上面介绍的几个双环系统外,例如[7,2,1],[7,3,1],[9,2,1],[9,3,1],[10,2,1],[13,3,1]骨架赋予了天然产物特殊的结构和功能。(scheme 6)
Scheme 6 其他双环结构
小结
结构决定有机化合物的功能,药物活性。科学家通过自己的努力来分离鉴定了天然植物,药物,真菌等含有药物活性的天然产物。我相信在不久的将来会分离出来更多结构新颖,药物活性高的天然产物。
参考文献
- [1] Mak, J. Y. W., Pouwer, R. H. & Williams, C. M. Natural Products with Anti-Bredt and Bridgehead Double Bonds. Angew. Chem., Int. Ed.(2014) 53, 13664-13688, doi:10.1002/anie.201400932.
- [2] Lim, K.-H. & Kam, T.-S. Methyl chanofruticosinate alkaloids from Kopsia arborea. Phytochem (2008) 69, 558-561, doi:10.1016/j.phytochem.2007.06.001.
- [3] Stierle, D. B. et al. Berkeleyones and Related Meroterpenes from a Deep Water Acid Mine Waste Fungus That Inhibit the Production of Interleukin 1-β from Induced Inflammasomes. J. Nat. Prod. (2011) 74, 2273-2277, doi:10.1021/np2003066.
- [4] Ye, F. et al. Xishacorenes A–C, Diterpenes with Bicyclo[3.3.1]nonane Nucleus from the Xisha Soft Coral Sinularia polydactyla. Org.Lett. (2017) 19, 4183-4186, doi:10.1021/acs.orglett.7b01716.
- [5] Sparling, B. A., Moebius, D. C. & Shair, M. D. Enantioselective Total Synthesis of Hyperforin. J. Am. Chem. Soc. (2013) 135, 644-647, doi:10.1021/ja312150d.
- [6] Li, J. et al. General Approach for the Synthesis of Ajmaline/Sarpagine Indole Alkaloids: Enantiospecific Total Synthesis of (+)-Ajmaline, Alkaloid G, and Norsuaveoline via the Asymmetric Pictet−Spengler Reaction. J. Am. Chem. Soc. (1999) 121, 6998-7010, doi:10.1021/ja990184l.
- [7] Dong, M. et al. Echinopines A and B: Sesquiterpenoids Possessing an Unprecedented Skeleton from Echinops spinosus. Org.Lett. (2008) 10, 701-704, doi:10.1021/ol702629z.
- [8] Corey, E. J., Ohno, M., Mitra, R. B. & Vatakencherry, P. A. Total Synthesis of Longifolene. J. Am. Chem. Soc. (1964) 86, 478-485, doi:10.1021/ja01057a039.
- [9] Mehta, G., Acharyulu, P., Reddy, K. S. & Umarye, J. D. J. S. Elaboration of S-(-)-α-Pinene into Functionalized Bicyclo [4.2. 1] nonane Framework of Mediterraneols. Synlett (1997) 1997, 1161-1162, doi:10.1055/s-1997-985.
- [10] Chapman, L. M., Beck, J. C., Wu, L. & Reisman, S. E. Enantioselective Total Synthesis of (+)-Psiguadial B. J. Am. Chem. Soc. (2016) 138, 9803-9806, doi:10.1021/jacs.6b07229.
- [11] Waizumi, N., Itoh, T. & Fukuyama, T. Total Synthesis of (−)-CP-263,114 (Phomoidride B). J. Am. Chem. Soc. (2000) 122, 7825-7826, doi:10.1021/ja001664b.
- [12] Shvartsbart, A. & Smith, A. B. Total Synthesis of (−)-Calyciphylline N. J. Am. Chem. Soc. (2014) 136, 870-873, doi:10.1021/ja411539w.
- [13] Liu, X. et al. Asymmetric Total Synthesis of Cerorubenic Acid-III. J. Am. Chem. Soc. (2019) 141, 2872-2877, doi:10.1021/jacs.8b12647.
- [14] Wang, Y., Ju, W., Tian, H., Tian, W. & Gui, J. Scalable Synthesis of Cyclocitrinol. J. Am. Chem. Soc. (2018) 140, 9413-9416, doi:10.1021/jacs.8b06444.
- [15] Liu, X., Liu, J., Zhao, J., Li, S. & Li, C.-C. Toward the Total Synthesis of Eurifoloid A. Org.Lett. (2017) 19, 2742-2745, doi:10.1021/acs.orglett.7b01102.
- [16] Uchida, I. et al. The structure of vinigrol, a novel diterpenoid with antihypertensive and platelet aggregation-inhibitory activities. J. Org. Chem. (1987) 52, 5292-5293, doi:10.1021/jo00232a048.
- [17] ANDO, T., YOSHIDA, K. & OKUHARA, M. J. T. J. o. a. Vinigrol, a novel antihypertensive and platelet aggregation inhibitory agent produced by a fungus, Virgaria nigra. J. Antibiot. (1988) 41, 31-35, doi:10.7164/antibiotics.41.25.
- [18] Bohlmann, F., Dhar, A. K., Jakupovic, J., King, R. M. & Robinson, H. Two sesquiterpene lactones with an additional propiolactone ring from Disynaphia halimifolia. Phytochem (1981) 20, 1077-1080, doi:10.1016/0031-9422(81)83030-0.
- [19] Farney, E. P., Feng, S. S., Schäfers, F. & Reisman, S. E. Total Synthesis of (+)-Pleuromutilin. J. Am. Chem. Soc. (2018) 140, 1267-1270, doi:10.1021/jacs.7b13260.
- [20] Wani, M. C., Taylor, H. L., Wall, M. E., Coggon, P. & McPhail, A. T. Plant antitumor agents. VI. Isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia. J. Am. Chem. Soc. (1971) 93, 2325-2327, doi:10.1021/ja00738a045.
- [21] Nicolaou, K. C. et al. Total synthesis of taxol. Nature (1994) 367, 630-634, doi:10.1038/367630a0.
- [22] Schiff, P. B., Fant, J. & Horwitz, S. B. Promotion of microtubule assembly in vitro by taxol. Nature (1979) 277, 665-667, doi:10.1038/277665a0.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.