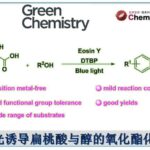
将环状水溶性分子-cucurbit[7]uril模拟生物体内的Diels–Alderase,实现分子内Diels–Alder反应。
利用Host-Guest化学进行人工Diels–Alderase的设计
二烯和亲双烯体的Diels–Alder(DA)反应、可以用于构建具有立体特异性的六元环环状骨架。在天然产物与医药品的合成中具有重要地位。
同时,在生物体内DA反应也作为很多天然有机化合物的生物合成途径被广为所知[1]。该类生物体内的反应中起到催化作用的酶-Diels–Alderase,可以与底物特异性的结合以隔断围绕在底物周围的水分子,促进Diels–Alder反应高效率的进行。而模仿Diels–Alderase的人工分子系统的构建,是目前host-guest化学的活用方面比较受关注的研究方向。
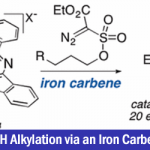
到目前为止Julius Rebek Jr.等人通过使用自组装有机化合物作为host分子催化剂实现了DA反应的200倍加速(图1A)[2a]。但是,无论是天然的Diels–Alderase还是Rebek等人的报道中,由于使用的反应物与得到的生成物结构类似,所以生成物也能作为guest分子,阻碍进一步反应生成物的生成,也就是影响了反应的效率[2]。
2006年,藤田等人通过自组装螯合物,成功实现了无生成物阻碍的催化DA反应[3],然而到目前为止也仅仅局限于这一个例子(图1B)。
今天介绍的这篇文章中,作者着眼于环状水溶性host分子之一的cucurbit[7]uril(CB[7])。通过使用CB[7],并且模仿生物体中的温和条件下,成功实现了无保护的N-烯丙基-2-糠胺衍生物的分子内DA反应(图1C)。本方法的特点是,在竞争性生成物阻碍下也能高效率的进行反应。
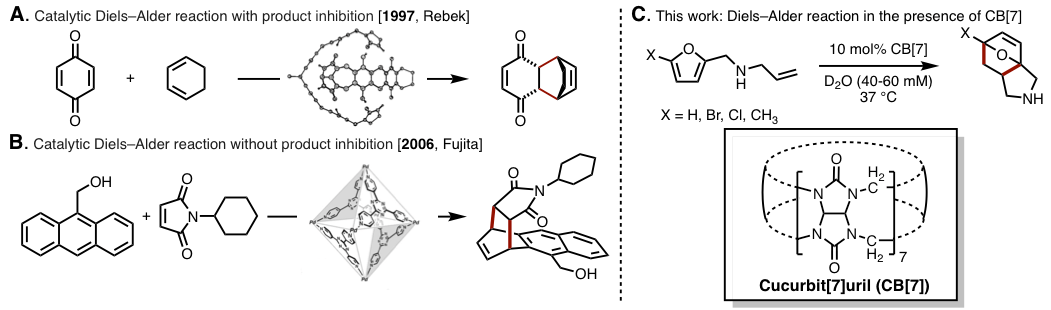
图1. 运用host-guest化学进行Diels–Alder反应
“Cucurbit[7]uril as a Supramolecular Artificial Enzyme for Diels–Alder Reactions”
Palma, A.; Artelsmair, M.; Wu, G.; Lu, X.; Barrow, S. J.; Uddin, N.; Rosta, E.; Masson, E.; Scherman, O. A.Angew. Chem., Int. Ed. 2017, 56, 15688.
论文作者简介

研究者:Oren A. Scherman
研究者经历:
-1999 B.A., Cornell University (Prof. Dotsevi Y. Sogah)
2004 Ph.D., California Institute of Technology (Prof. Robert H. Grubbs)
2004-2006 Posdoc, Eindhoven University of Technology (Prof. E.W. (Bert) Meijer)
2006- Lecturer and Next Generation Fellow of the Melville Laboratory, University of Cambridge
2011- Reader in Supramolecular and Polymer Chemistry, University of Cambridge
2013- Director of the Melville Laboratory, University of Cambridge
2015- Professor, University of Cambridge
研究内容:超分子、高分子化学

研究者:Eric Masson
研究者经历:
-2001 M.S., University of Lausanne
2005 Ph.D., Swiss Federal Institute of Technology Lausanne (Prof. Manfred Schlosser)
2005-2007 Posdoc, Yale University (Prof. Andrew D. Hamilton)
2007-2013 Assistant Professor, Ohio University
2013- Associate Professor, Ohio University
研究内容:超分子、分子识别化学
论文概要
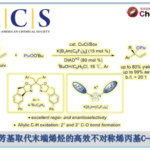
CB[7]自身是具有高水溶性的分子,而环内部确是疏水性的。因此,在水中的疏水性化合物就会更容易进入CB内部。本研究就是通过利用南瓜环这个特殊性质,通过将疏水性底物N-烯丙基-2-糠胺衍生物1引入CB内部,成功促进了其分子内DA反应的进行(图1A)。反应机理如下图中B所示。质子化的底物1与存在于CB[7]开口部的羰基之间发生ion-dipole相互作用,从而使疏水残基(呋喃,丙烯基)掺入到内部,形成底物的发夹诱导构象(HIC)(图1B)。通过HIC的形成将双烯与亲双烯体以最合适的位置关系配置以促进DA反应进行。呋喃与烯烃之间的π – π相互作用参与了HIC的形成,如果烯烃部位换成饱和烷烃链的话,烷烃链就无法渗入到CB内部,也就无法形成HIC(图1C)。
本手法,DA产物比原料更容易进入CB内部,因此不会产生显著地生成物阻害作用,甚至当使用催化量的CB时,反应仍以高收率进行[7]。通过各种速度论实验发现,生成物的CB[7]的结合常数比是原料的几十倍,因此即使在催化条件下,也不会产生阻碍生成物生成这一个普遍问题。
在这项研究中获得的发现不仅在于南瓜环可以作为host-guest化学的新催化剂,而且该项研究有利于对Diels-Alderase的更深层作用机制的理解。
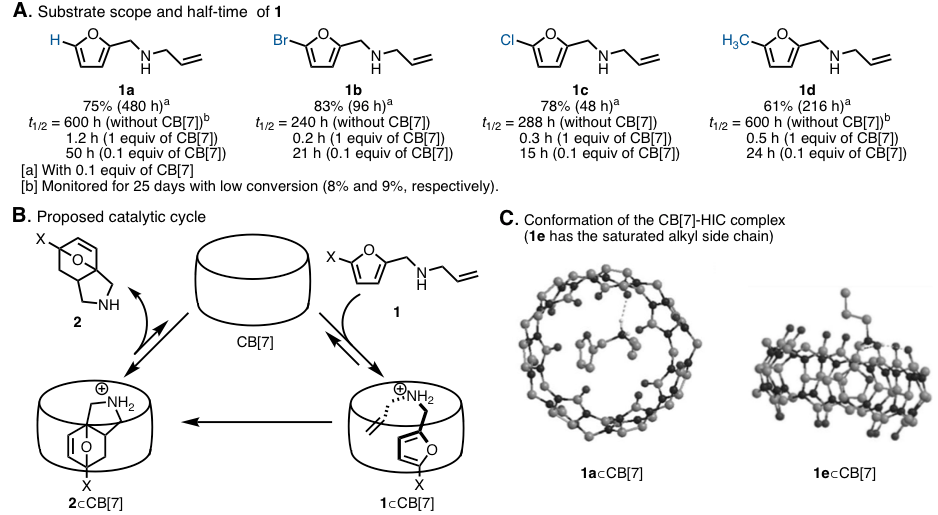
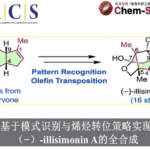
图2. (A) 底物适用范围与半衰期 (B) 本反应的催化循环 (C) 发夹诱导构象(HIC)
参考文献
- Review: (a) Klas, K.; Tsukamoto, S.; Sherman, D. H.; Williams, R. M. J. Org. Chem. 2015, 80, 11672. DOI: 10.1021/acs.joc.5b01951 A representative report, see: (b) Ose, T.; Watanabe, K.; Mie, T.; Honma, M.; Watanabe, H.; Yao, M.; Oikawa, H.; Tanaka, I. Nature. 2003, 422, 185. DOI: 10.1038/nature01454
- (a) Kang, J.; Rebek, Jr., J. Nature, 1997, 385, 50. DOI: 1038/385050a0 (b) Marty, M.; Watson, C-. Z.; Twyman, L. J.; Nakash, M.; Sanders, J. K. M. Chem. Commun.1998, 2265. DOI: 10.1039/A806070C
- (a) Yoshizawa, M.; Tamura, M.; Fujita, M. Science, 2006, 312, 251. DOI: 10.1126/science.1124985 Another example: (b) Howlader, P.; Das, P.; Zangrando, E.; Mukherjee, P. S. J. Am. Chem. Soc. 2016, 138, 1668. DOI: 10.1021/jacs.5b12237
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






















No comments yet.