本文作者:Summer
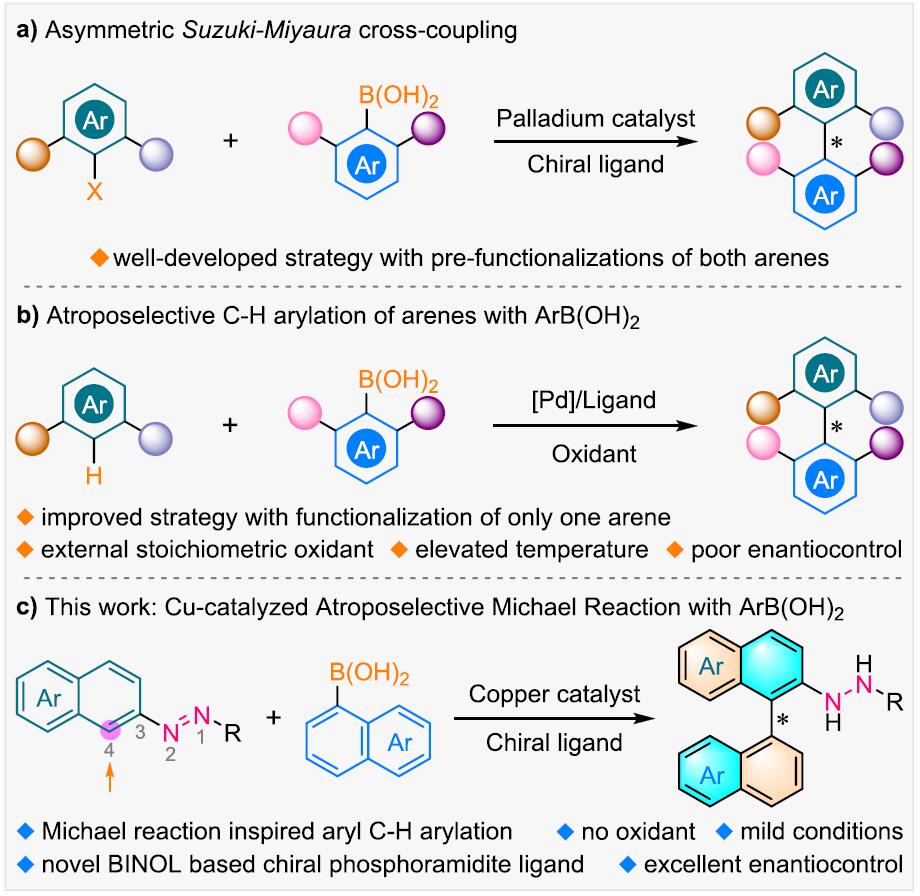
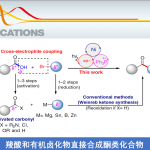
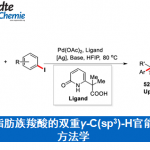
轴手性联芳基化合物广泛存在于天然产物、药物以及先进的材料中,同时轴手性联芳基化合物还可作为手性配体和催化剂用于不对称催化中,因此轴手性联芳基化合物的不对称合成受到化学家们的广泛关注且取得了不错的进展。其中,Pd催化芳基硼酸的不对称Suzuki−Miyaura偶联反应可以有效地构建非C2对称的二芳基轴手性化合物[1](Figure 1a),但这种策略存在芳基预官能团化等缺点。过渡金属催化芳基硼酸的C-H芳基化反应[2]虽然可以有效地避免芳基预官能团化的缺点(Figure 1b),但这种方法需要大量的外源性氧化剂以及高温条件,这极大的影响了反应产物的对映选择性。受到Hayashi课题组报道的过渡金属催化剂α,β-不饱和化合物与芳基硼酸的不对称Michael加成反应[3]的启发,南方科技大学谭斌团队 (谭斌教授介绍)和华侨大学宋秋玲团队共同首次报道了金属Cu和新型BINOL衍生的亚磷酰胺手性配体催化偶氮苯衍生物与芳基硼酸不对称Michael反应,能以良好的收率和对映选择性得到一系列轴手性联芳基化合物(Figure 1c)。该策略成功的克服了高温、外源性氧化剂以及芳基预官能团化等问题,为轴手性联芳基化合物的不对称合成提供了更为有效的方法。相关研究成果发表于
“Michael Reaction Inspired Atroposelective Construction of Axially Chiral Biaryls”
Yan, S.; Xia, W.; Li, S.; Song, Q.;* Xiang, S.-H.; Tan, B.*Angew. Chem. Int. Ed. 2020, 142 , 7322-7327. DOI: 10.1021/jacs.0c01963
Figure 1. 研究背景
论文概要
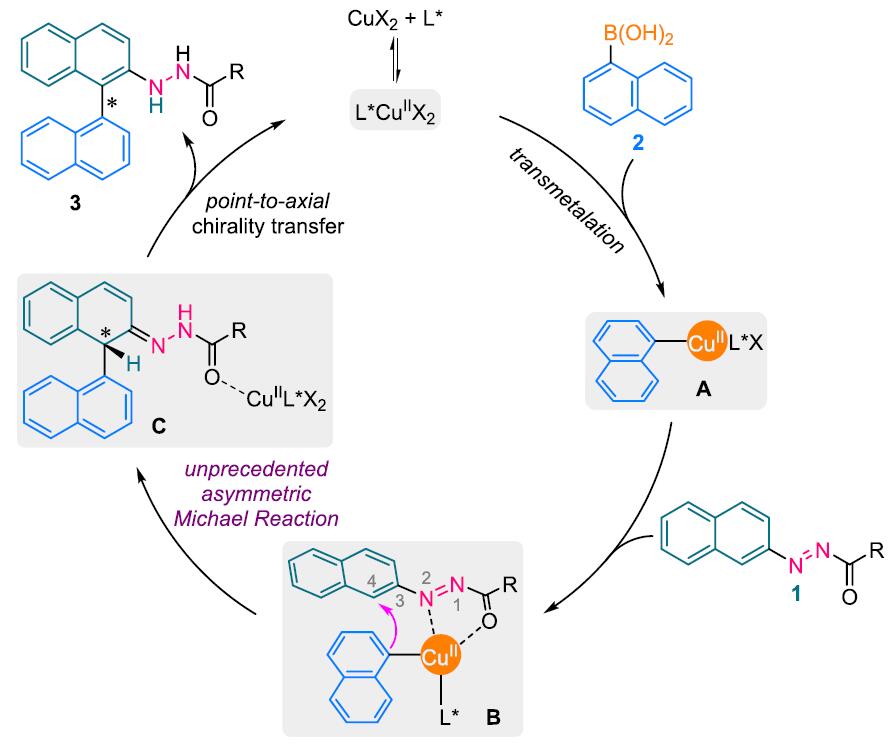
基于前人的报道,作者推测可能的反应过程(Scheme 1):首先,催化剂与芳基硼酸结合生成中间体A。然后,A迅速与偶氮苯衍生物结合形成中间体B。受到偶氮基团以及Cu催化剂的影响,B会发生分子内Michael型加成反应生成具有中心手性的中间体C。最后,手性亚磷酰胺配体会促使中间体C转化为轴手性产物,同时释放的催化剂会进入下一次催化循环。
Scheme 1. 反应机理图
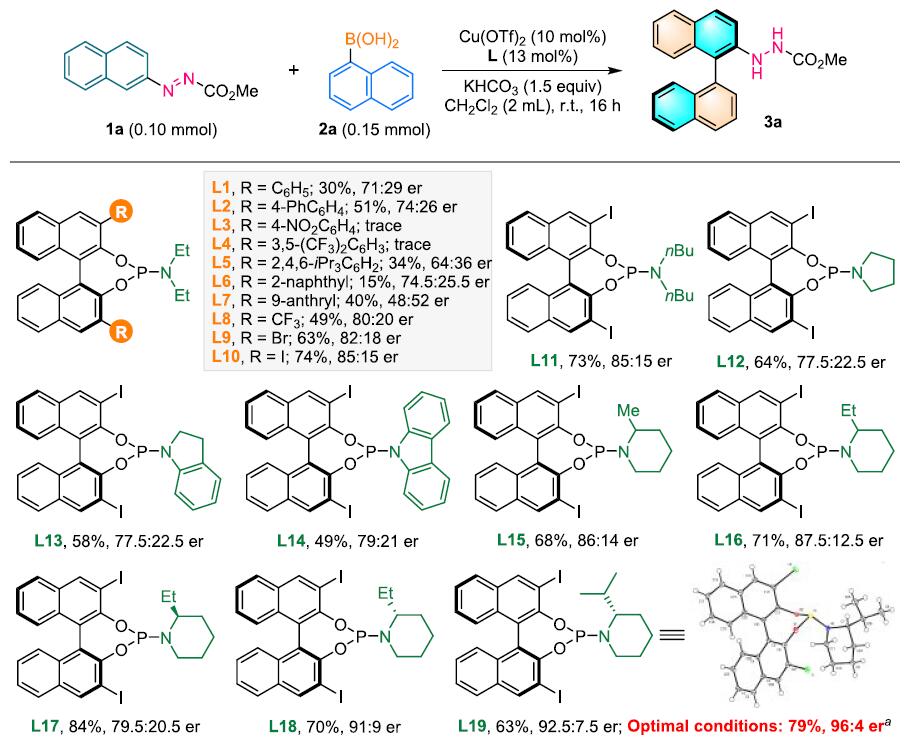
作者以偶氮萘衍生物1a与1-萘苯硼酸2a为模板底物,对反应条件进行反复筛选,确定最优条件(Table 1):10 mol% Cu(OTf)2和20 mol% L19为最优催化剂,2 equiv KHCO3 为碱,CH2Cl2为溶剂,在15 oC条件下反应24 h,能以79%的收率和92%的对映选择性得到产物3a。
在最优反应条件下,作者考察了偶氮苯衍生物和芳基硼酸的底物范围。各种取代的偶氮苯衍生物都能较好的适应反应条件,能以良好的收率和对映选择性得到相应产物。芳基硼酸也能较好的适应反应条件,能以良好的对映选择性得到一系列轴手性化合物,但有些产物的收率偏低。将配体L19换成L18,其它条件不变,相应产物的收率有了一定的提高。
Table 1. 条件筛选
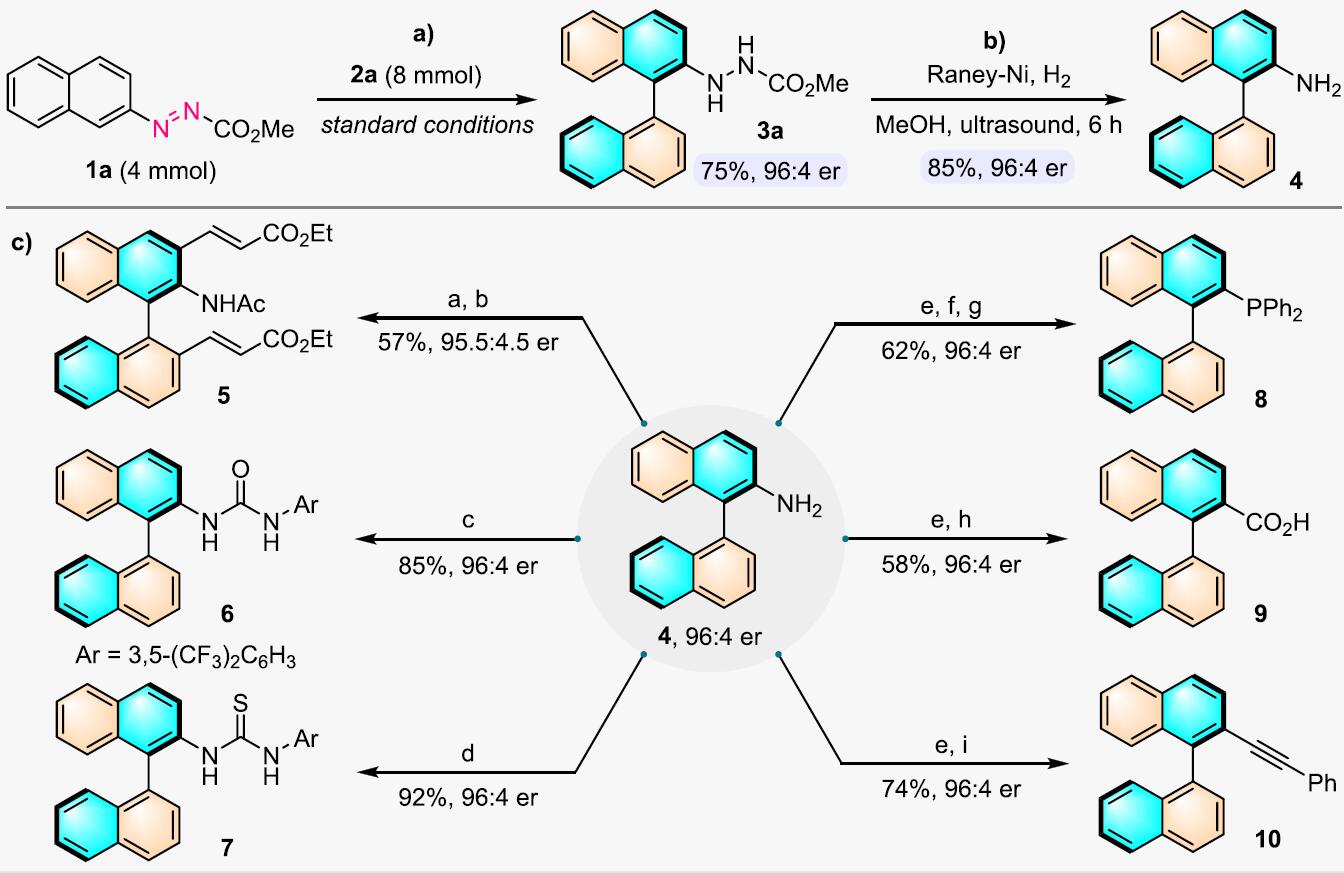
为了证明反应的应用潜力,作者进行了一系列衍生反应(Figure 2)。首先,在最优反应条件下,扩大化反应可以很好地进行,收率稍微有所降低但对映选择性较好。然后,通过简单的还原反应3a可转化为轴向性2-氨基联萘化合物4。4可以再转化为具有催化作用的轴手性硫脲类结构以及其他重要的轴手性结构。
Figure 2. 衍生反应
论文总结评价
南方科技大学谭斌团队和华侨大学宋秋玲团队共同首次报道了金属Cu和新型BINOL衍生的亚磷酰胺手性配体催化偶氮苯衍生物与芳基硼酸不对称迈克尔型加成反应,能以良好的收率和对映选择性得到一系列轴手性联芳基化合物(Figure 1c)。该策略成功的克服了高温、外源性氧化剂以及芳基预官能团化等问题,为轴手性联芳基化合物的不对称合成提供了更为有效的方法。
参考文献
- [1] Shen, D.; Xu, Y.; Shi, S.-L. J. Am. Chem. Soc. 2019, 141, 14938-14945. DOI: 10.1021/jacs.9b08578
- [2] Ackermann, L.; Vicente, R.; Kapdi, A. R. Angew. Chem., Int. Ed. 2009, 48, 9792-9826. DOI: 10.1002/anie.200902996
- [3] Takaya, Y.; Ogasawara, M.; Hayashi, T.; Sakai, M.; Miyaura, N. J. Am. Chem. Soc. 1998, 120, 5579-5580. DOI: 10.1021/ja980666h
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.