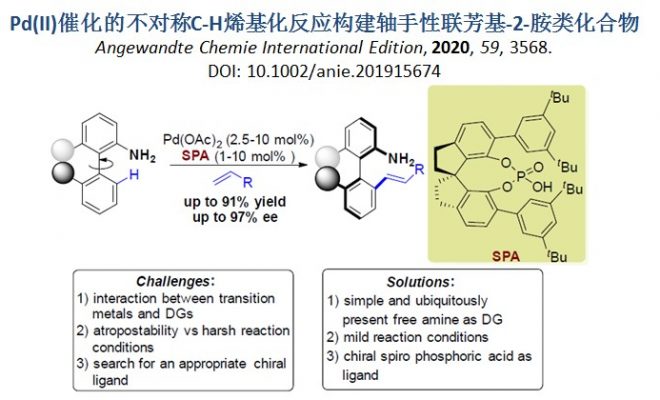
背景介绍
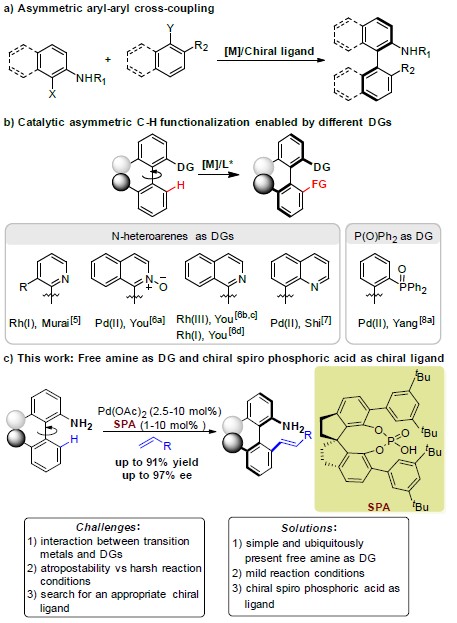
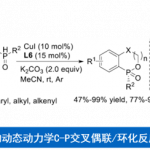
轴手性联芳基-2-胺类化合物及其衍生物不仅广泛存在于具有生物活性的化合物、天然产物中,还可作为手性配体或催化剂用于不对称合成中。传统的合成轴手性联芳基-2-胺类化合物的方法主要通过不对称芳基-芳基交叉偶联反应[1]进行构建(Scheme 1a)。最近,不对称C-H活化[2]为含N-杂芳烃及其衍生物或二苯基膦氧化物等导向基团的轴手性联芳基化合物的合成提供了一种新的思路,其中导向基团可以增强反应活性以及对产物对映选择性的控制(Scheme 1b)。然而,迄今为止仍无应用不对称C-H活化策略合成轴手性联芳基-2-胺类化合物的报道。同时,基于史炳锋课题组之前关于过渡金属Pd(II)和瞬态手性辅基(TCA)催化二芳基醛的对映选择性C-H官能团化反应的研究,浙江大学史炳锋课题组成功报道了过渡金属Pd(II)和新型手性螺环磷酸(SPA)催化含氨基直接基团的联芳基化合物的阻转选择性C-H烯基化反应,能以良好至优良的收率和对映选择性获得一系列轴手性联芳基-2-胺类化合物(Scheme 1c)。相关研究成果发表于
“Synthesis of Axially Chiral Biaryl-2-amines via Pd(II)-Catalyzed Free Amine-Directed Atroposelective C–H Olefination”
B.-B. Zhan, L. Wang, J. Luo, X.-F. Lin, B.-F. Shi* Angew. Chem. Int. Ed. 2020, 59, 3568. DOI: 10.1002/anie.201915674
Scheme 1 背景研究
论文概要
以2-(萘-1-基)苯胺1a与丙烯酸丁酯2a为模板底物,作者对催化剂、溶剂、氧化剂等反应条件进行反复筛选,确定最佳反应条件(Table 1):10 mol% Pd(OAc)2为催化剂和10 mol% 新型磷酸L1配体为手性配体,1.0 equivAg2CO3为氧化剂,甲苯为溶剂,在40 oC条件下反应24小时,能以96%的收率和95%的对映选择性获得相应轴手性产物3aa。
Table 1 条件筛选
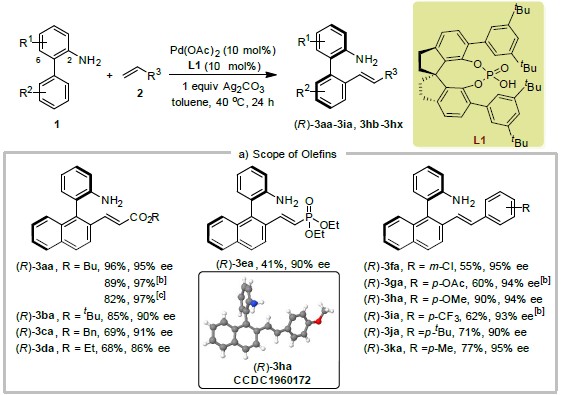
在最佳反应条件下,作者考察了烯烃和二芳基-2-胺的底物范围(Table 2)。研究发现各种丙烯酸酯、乙烯基膦酸二乙酯以及各种取代的苯乙烯都能较好的适应反应条件,能以中等至优良的收率与对映选择性对映选择性获得相应产物。各种芳基取代的2-(萘-1-基)苯胺以及二芳基-2-胺均能够与4-甲氧基苯乙烯反应,均能够中等至优良的收率与对映选择性得到相应产物。其中,具有供电子基团取代的联芳基-2-胺的反应收率高于具有吸电子基团取代的联芳基-2-胺的反应收率,然而,联芳基-2-胺中芳基上所连取代基的电子效应对于反应过程的对映选择性控制无显著影响。
Table 2 底物扩展
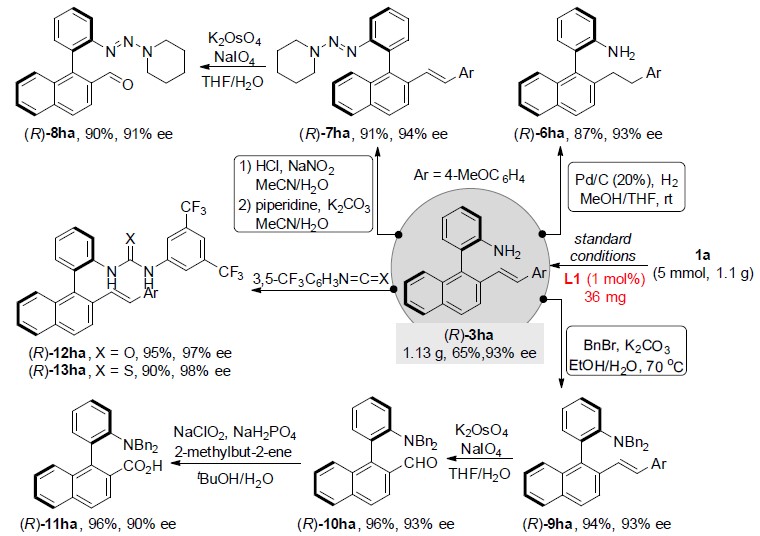
为了进一步验证反应的应用潜力,作者进行了克级放大合成和上述标题化合物的进一步合成转化研究(Scheme 2)。研究表明,即使将催化剂用量降至1 mmol%,扩大化反应仍能正常进行,可以65%的收率和92%的对映选择性获得(R)-3ha。通过进一步的合成转化,作者发现3ha可转化为烷基化联芳基-2-胺6ha、三氮烯类化合物7ha、手性δ-氨基酸11ha、尿素12ha以及硫脲13ha。其中,7ha还可进一步转化为相应的醛8ha。
Scheme 2标题化合物的进一步合成转化研究
论文总结评价
浙江大学史炳锋课题组成功报道了过渡金属Pd(II)和新型手性螺环磷酸催化含氨基导向基团的联芳基化合物的不对称C-H烯基化反应。各种烯烃和二芳基2-胺均能较好的适应反应条件,可以良好至优良的收率和对映选择性得到一系列轴手性联芳基-2-胺类化合物。
参考文献
- [1] B. Zilate, A. Castrogiovanni, C. Sparr. ACS Catal. 2018, 8, 2981. DOI:10.1021/acscatal.7b04337
- [2] (a) J. Luo, T. Zhang, L. Wang, G. Liao, Q.-J. Yao, Y.-J. Wu, B.-B. Zhan, Y. Lan, X.-F. Lin, B.-F. Shi. Angew. Chem. Int. Ed. 2019, 58, 6708. DOI:10.1002/anie.201902126 (b) S.-X. Li, Y.-N. Ma, S.-D. Yang, Org. Lett. 2017, 19, 1842. DOI:10.1021/acs.orglett.7b00608
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





















No comments yet.