作者:石油醚
导读:
近日,上海有机化学研究所的李昂研究员团队在J. Am. Chem. Soc.上,以 “Total Synthesis of Four Classes of Daphniphyllum Alkaloids.” 为题,报道了四种亚家族的14个虎皮楠生物碱的首次全合成。其中,关键步骤主要涉及:Calyciphylline A 的C4-N和C1-C8键为中心的仿生策略(biomimetic strategies centered on the C4–N and C1–C8 bonds of calyciphylline A),该策略充分利用与假定生物遗传网络中的对应物不同的合适底物、反应和途径。
“Total Synthesis of Four Classes of Daphniphyllum Alkaloids.
Wenhao Zhang, Ming Lu, Lu Ren, Xiang Zhang, Shaonan Liu, Mengyu Ba, Peng Yang, and Ang Li*
J. Am. Chem. Soc., 2023, ASAP. doi: 10.1021/jacs.3c06088.”
正文
虎皮楠生物碱(Daphniphyllum alkaloids)是一大类结构复杂多样且活性特殊的nortriterpenoid生物碱[1]。几十年以来,虎皮楠生物碱骨架合成一直吸引着众多科学家的眼球。然而,由于此类分子骨架巨大的合成难度。自Heathcock小组报道了methyl homodaphniphyllate的全合成[2]以来,300多个成员中仅有不到36个分子被化学家们完成。近日,李昂研究员团队报道了四种亚家族的14个虎皮楠生物碱的全合成。,并发表于J. Am. Chem. Soc.上。
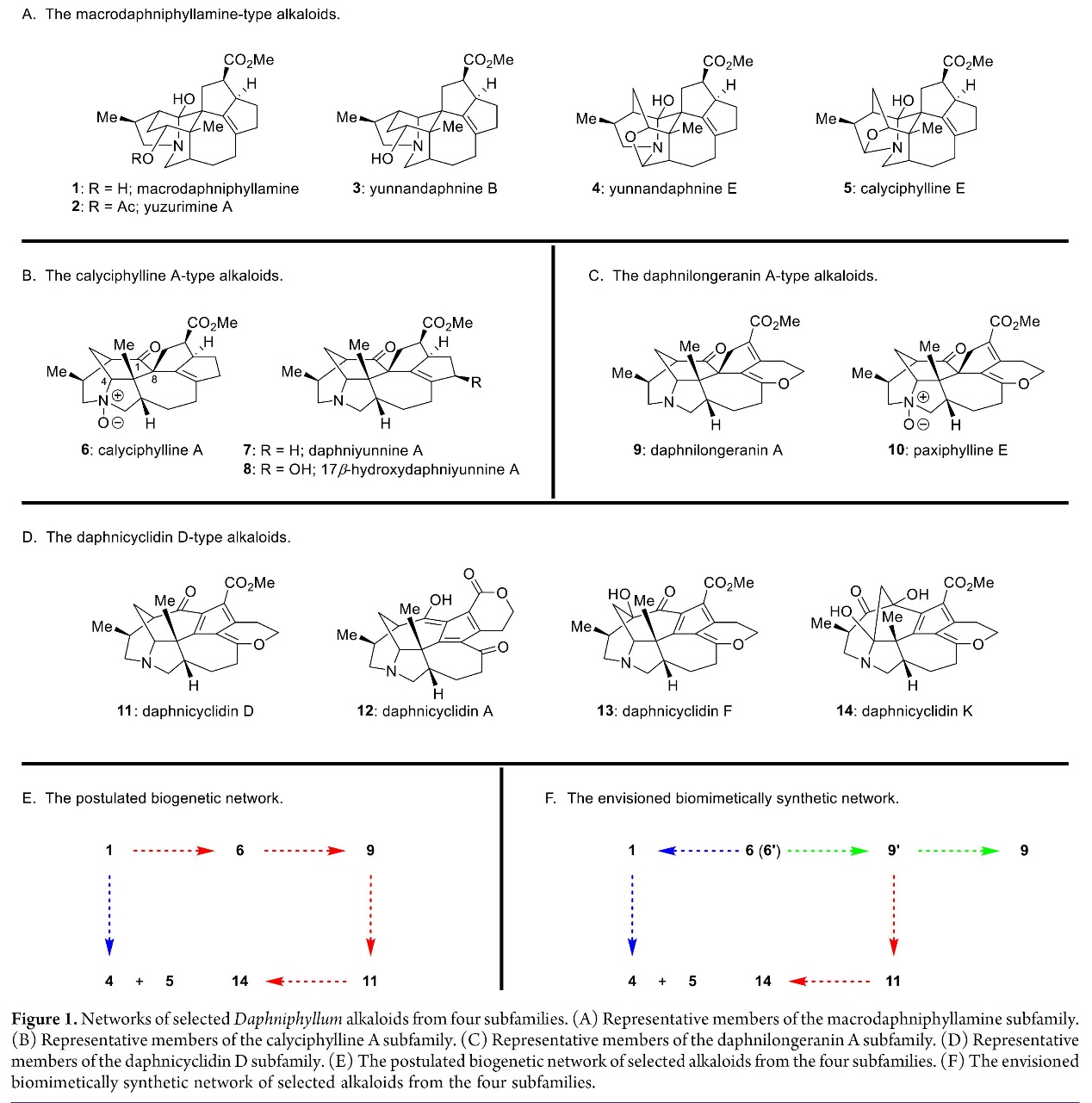
首先,作者对虎皮楠生物碱(1-14,Figures 1A-D)的生物途径进行了系统的分析,其来自macrodaphniphyllamine, calyciphylline A, daphnilongeranin A 和 daphnicyclidin D的四个亚家族[3]。其中Macrodaphniphyllamine型生物碱(1)是被认为是该网络的入口点[4],该网络通过两条途径连接各种虎皮楠生物碱[5](Figure 1E,蓝色和红色突出显示)。受此的启发,作者构思了一个化学合成网络(Figure 1F),即用Calyciphylline A (6)[6]取代(1)作为后一网络的入口点,可为这些生物碱提供两个优势,如1)(6)可作为最灵活的中间体:对(6)[或类似物(6 ‘)][7]的C4-N和C1-C8键的修饰,可以快速构建macrodaphniphyllamine 和daphnicyclidin D亚家族生物碱;2)calyciphylline A型生物碱方面的合成经验可底物仿生合成提供各种中间体。在确定(6)在合成网络的作用后,作者进一步设计了从6(或6 ‘)开始的三条路线(图1F,用蓝色、绿色和红色突出显示),利用一系列广义的仿生学策略,对四种亚型的虎皮楠生物碱进行了全合成的研究。
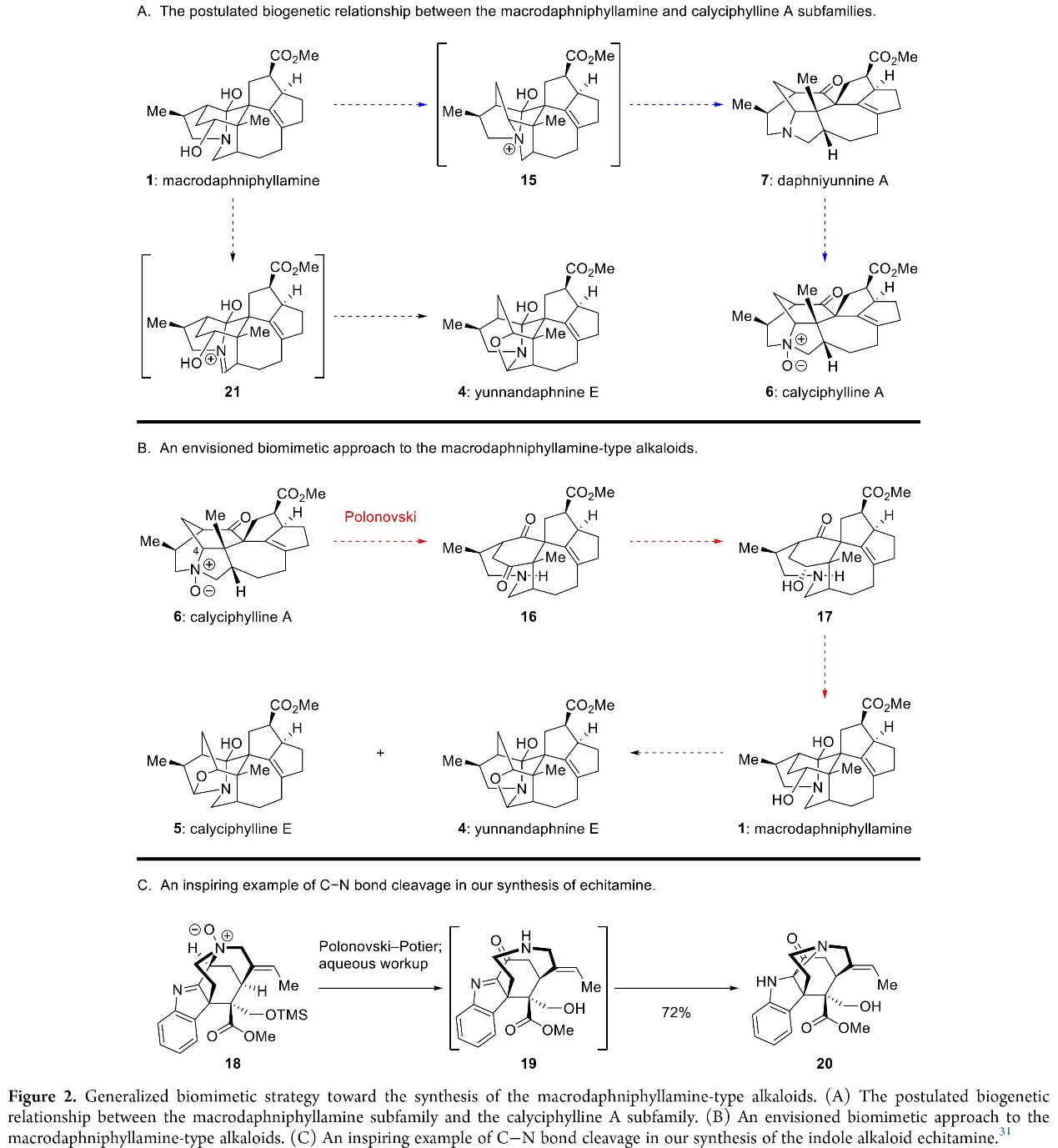
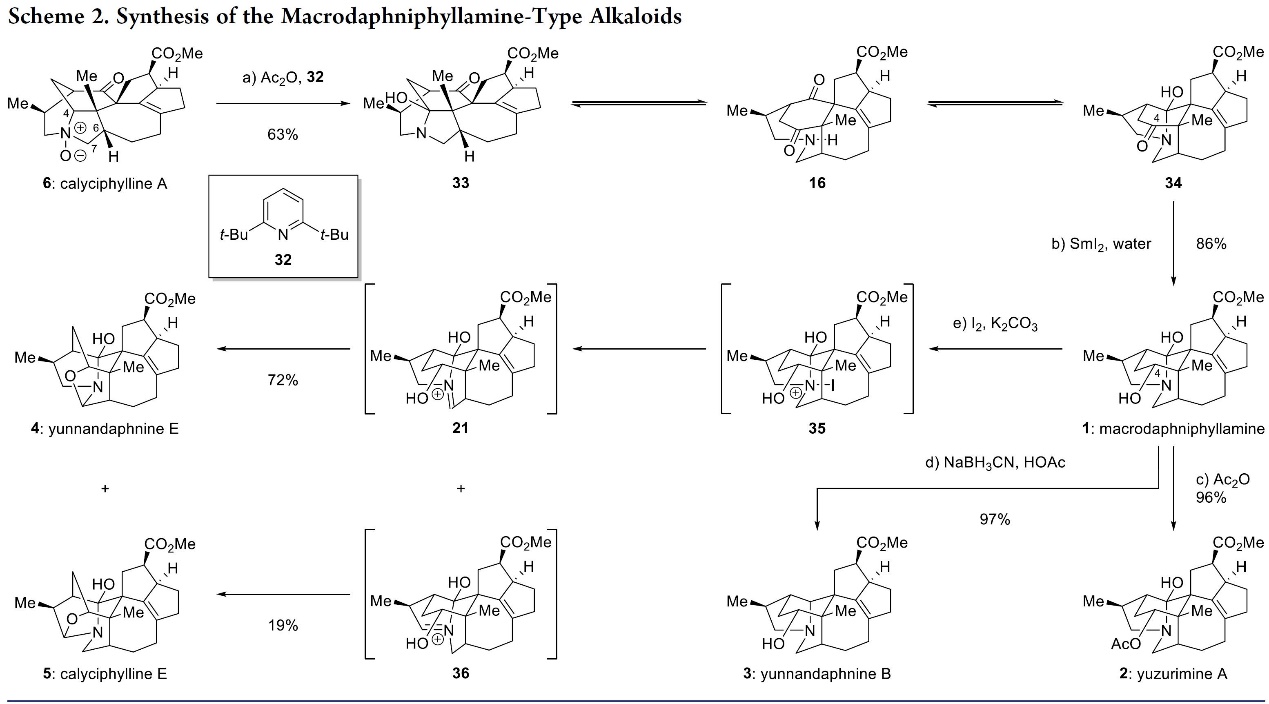
接下来,作者对Macrodaphniphyllamine-型生物碱的策略进行了分析如Figure 2所示。即与假设的以分子内胺化为特征的1–6 (1→15→7→6,Figure 2A)的生物发生途径不同,作者设计了一直相反的化学合成步骤(6→16→17→1,Figure 2B),其中包括(6)的C4-N键的断裂,然后是化学选择性酮还原和半胺形成。关键的C–N键断裂可以通过Polonovski反应实现[8](18→19→20,Figure 2C)。此外,从(1)到yunnandaphnine E (4)通过亚氨离子物种的假定生物成因途径(21, Figure 2A),作者估计胺脱氢反应将转化1到4和calyciphylline E(5)(Figure 2B)。
其具体的合成步骤如下:
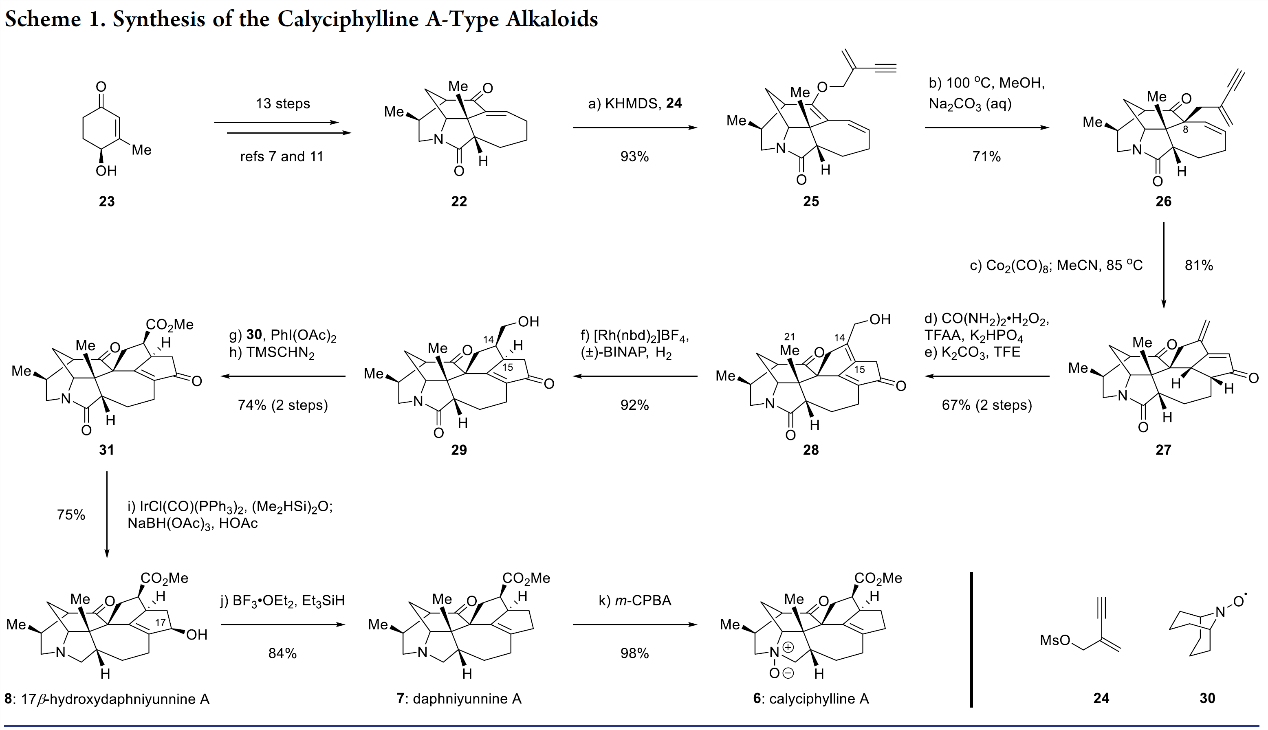


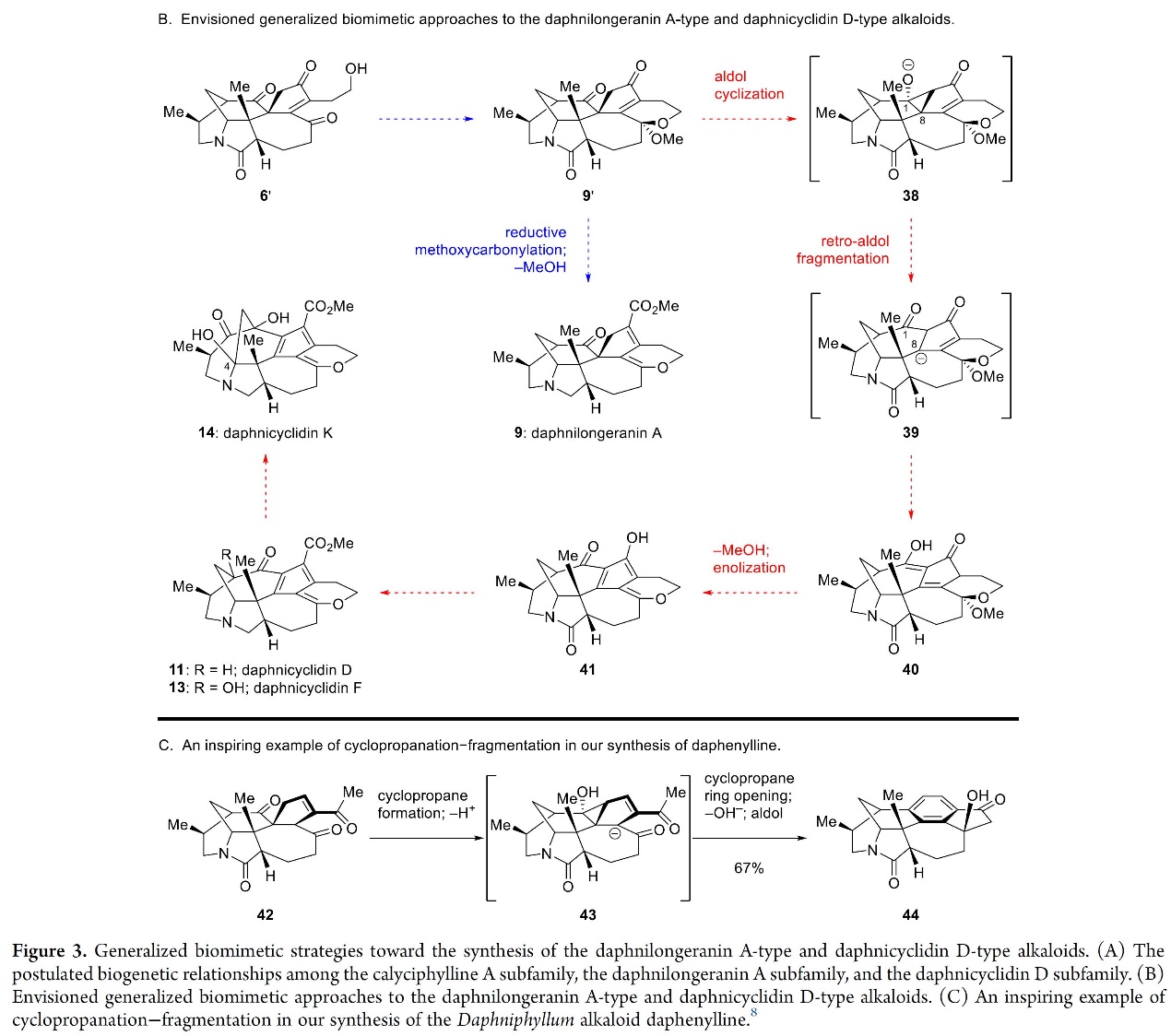
其次,在完成上述两个亚家族的天然产物分子的合成以后,作者对daphnilongeranin A型和daphnicyclidin D型生物碱的合成策略进行了分析,如图3所示。Daphnilongeranin A (9)在连接calyciphylline A亚家族和daphnicyyclidin D亚家族的假定生物遗传途径中占据关键位置。然而,从合成的角度来看,此类分子并不是一种理想的中间体,其主要原因是,daphniyunnine A(7)(7→9,Figure 3A)的9的生物发生涉及到C10-C17键的正式氧原子插入(21),难以直接模仿;2)从9到daphnicyclidin D(11)(9→11,Figure 3A) 的生物遗传途径具有C1-C8键断裂和C1-C13键形成的有趣过程,其可能与环丙醇物种的中间作用有关。综上,作者设计了化合物9’(图3B)作为合成daphnilongeranin A-型 and daphnicyclidin D-型生物碱的常用中间体。并且该中间体易于制备。9 ‘的综合通用性将确保通往合成两个亚家族的路线的可行性(Figure 3B,蓝色和红色突出显示),即9 ‘的还原性甲氧基羰基化,然后消除MeOH,易于生成9;2)合适的条件下,9′可发生醛醇环化反应——涉及中间体38和39的醛醇缩合/retro-醛醇裂解串联反应,形成具有daphnicyclidin D-型alkaloids生物碱特征的六环核心骨架40。一系列的MeOH消去和烯醇化将得到化合物41,从而为制备11和daphnicyclidin F 13铺平道路。考虑到相应的生物发生途径(Figure 3A), 作者估计通过α-酮醇重排和C4羟基化(Figure 3B), 将13进一步转化为daphnicyclidin K(14)。
其具体合成步骤如下:
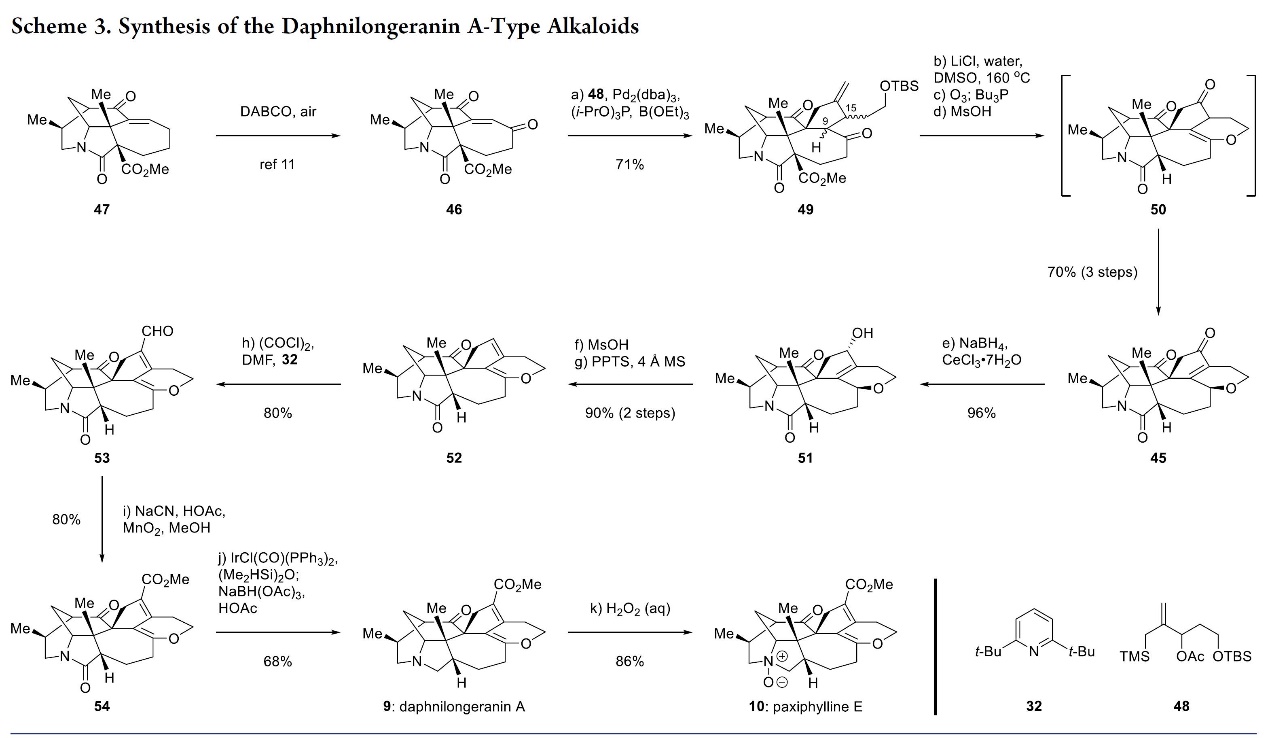

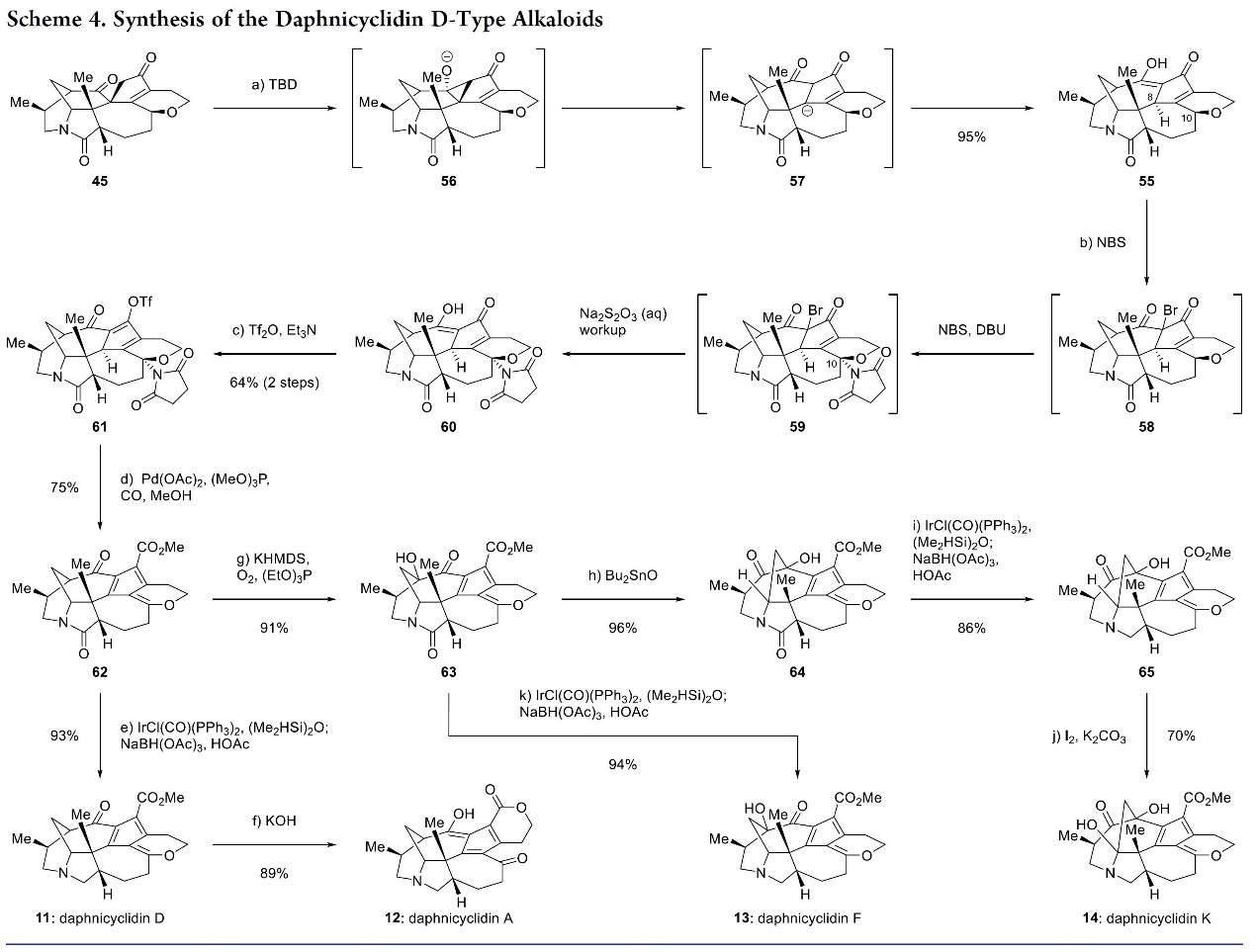

总结, 李昂研究员团队报道了四种亚家族的14个虎皮楠生物碱的首次全合成。其中,关键步骤主要涉及:Calyciphylline A 的C4-N和C1-C8键为中心的仿生策略(biomimetic strategies centered on the C4–N and C1–C8 bonds of calyciphylline A),该策略充分利用与假定生物遗传网络中的对应物不同的合适底物、反应和途径。此外,该项工作不经为系统研究这些分子的作用机制铺平了道路,并且还可能促进其他虎皮楠生物碱亚科成员的合成研究。
参考文献:
- [1] J. i. Kobayashi, T. Kubota, Nat. Prod. Rep. 2009, 26, 936. doi:10.1039/B813006J.
- [2] S. Piettre, C. H. Heathcock, Science, 1990, 248, 1532. doi:doi:10.1126/science.248.4962.1532.
- [3] Y.-T. Di, H.-P. He, C.-S. Li, J.-M. Tian, S.-Z. Mu, S.-L. Li, S. Gao, X.-J. Hao, J. Nat. Prod. 2006, 69, 1745. doi:10.1021/np060350k.
- [4] L.-D. Guo, Y. Zhang, J. Hu, C. Ning, H. Fu, Y. Chen, J. Xu, Nat. Commun. 2020, 11, 3538. doi:10.1038/s41467-020-17350-x.
- [5] H. Zhang, S.-P. Yang, C.-Q. Fan, J. Ding, J.-M. Yue, J. Nat. Prod. 2006, 69, 553. doi:10.1021/np050490e.
- [6] R. Yamada, Y. Adachi, S. Yokoshima, T. Fukuyama, Angew. Chem. Int. Ed. 2016, 55, 6067. doi:10.1002/anie.201601958.
- [7] S. Ikeda, M. Shibuya, N. Kanoh, Y. Iwabuchi, Org. Lett. 2009, 11, 1833. doi:10.1021/ol9003405.
- [8] X. Zhang, B. N. Kakde, R. Guo, S. Yadav, Y. Gu, A. Li, Angew. Chem. Int. Ed. 2019, 58, 6053. doi:10.1002/anie.201901086.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.




















No comments yet.