投稿作者 alberto-caeiro
接上一篇而来,这里将主要介绍两位化学家的合成工作。首先从K. C. Nicolaou教授在2006年的全合成工作开始。
Nicolaou‘s的全合成研究[1]
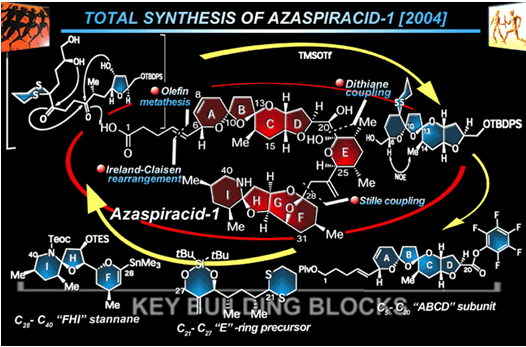
1). 逆合成分析
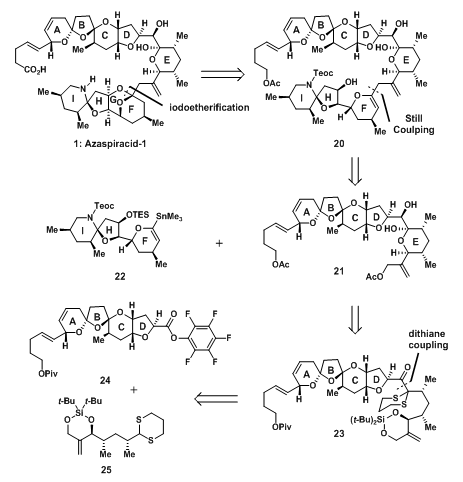
2006年的合成工作主要是建立在之前的结构分析中用到的合成策略,并且在有准确结构的基础上,设计了如图1所示的改进策略。为了消除E和F环之间偶联时的位阻影响,首先通过碘化成醚反应将G环从F上切割出来,后由Still偶联即可将F与E环相连接起来;D与E环部分可通过二唑烷偶联实现构建,具体如下。
图1: Nicolaou‘s Retrosynthetic Analysis of Azaspiracid-1
图2:Nicolaou‘s Retrosynthetic Analysis of Fragment24&Vinyl Stannane 22
2). Azaspiracid-1的全合成
A:ABCDE环体系的合成
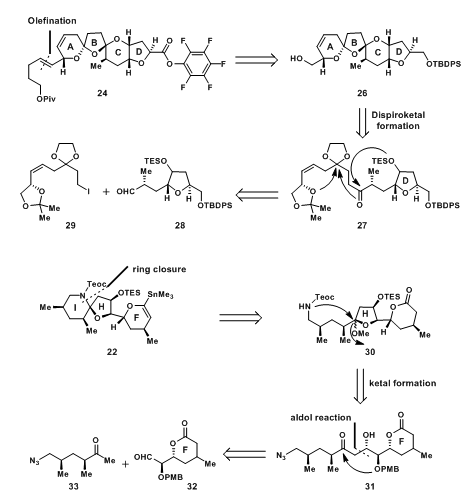
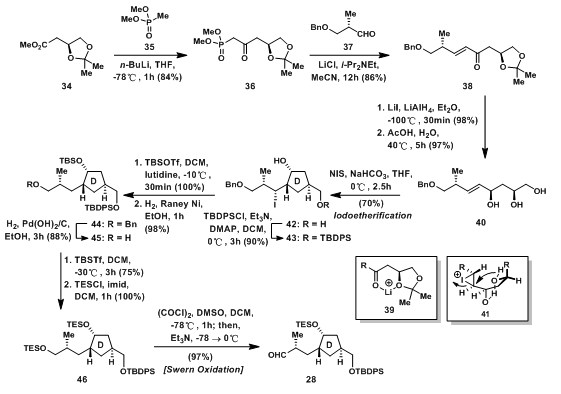
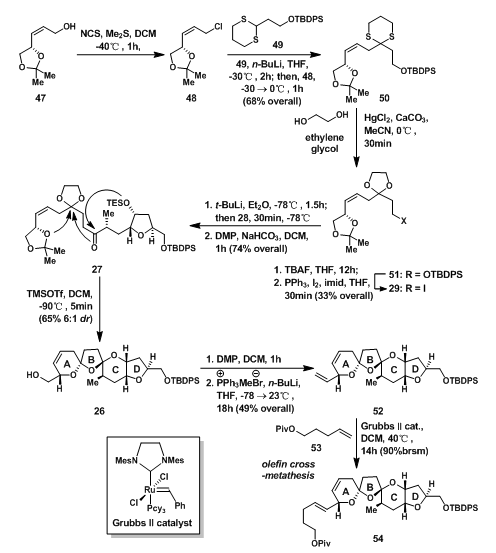
34先与磷酸盐负离子反应生成磷叶立德的前体36,后发生Hornery-Wadsworth-Emmons偶联,生成E型双键;38的羰基还原成羟基后在乙酸中脱除缩丙酮保护,还原时的高效立体选择性是因为锂离子的配位作用如39所示;40发生碘化成醚反应得到D环,经过41的中间状态得到42,在保护两个游离的羟基后,进行保护基的交换,再经过Swern Oxidation即可得到28,当然,其中可以不需要进行保护基的交换,但通过这一步,前一代合成策略中的原料就可以在此得到利用。
图3:Nicolaou‘s Synthesis of D-ring Aldehyde 28
烯丙醇47在NCS和Me2S作用下原位氯代后,发生二噻烷偶联得到50,再用乙二醇保护羰基得51;51先脱TBDPS保护后再进行碘代得29;29需加2eq的t-BuLi脱除碘,1当量用于脱除碘,另一当量使t-BuI形成异丁烯、异丁烷与碘化锂,从而反应能够向右进行形成负离子,后发生Dess-Martin氧化得到27;27经Lewis酸诱导的domino反应,通过脱除TES基团与丙酮保护基,形成ABC三环得到的26在C-10位的差向异构体dr值为6:1[2];26端基处一级醇氧化成羰基后,发生Wittig反应得到52;52在GrubbsⅡ cat. 的催化下,发生烯烃复分解反应得到ABCD四环部分54[3, 4]。
图4:Nicolaou‘s Synthesis of ABCD Ring Systme 54
25是构建E环的主要前体。从手性环内酯55出发,先经DIBAL-H还原成环半缩醛56后在Lewis酸催化下开环并用1,3-丙二硫醇保护醛基得57;一级醇经Dess-Martin氧化得醛58后,与61发生Nozaki-Hiyama-Kishi偶联得62;62先氧化后还原得到需要构象的羟基64;64先脱TBS保护得到2醇后,换保护基得到25
图5:Nicolaou‘s Synthesis of Alkyl Iodide 29
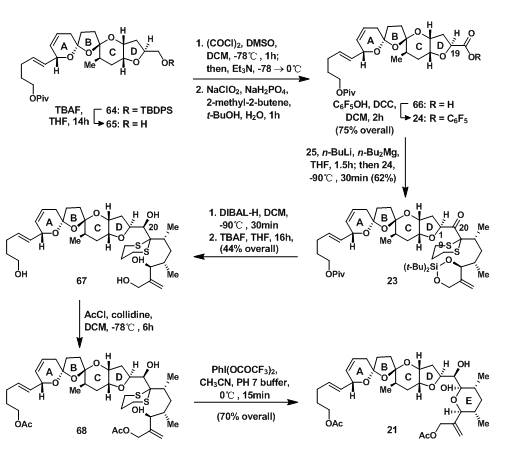
54脱TBDPS保护后,先后经历Swern氧化及Pinnick氧化得到相应的羧酸后酯化得24;24经二噻烷偶联得23后,DIBAL-H还原得到的C-20位的2级羟基,TBAF脱除羟基的保护基,最终得四醇化合物67;用乙酰氯将端羟基保护后,氧化条件下脱除二硫醇保护得到的羰基立刻与游离的羟基羟醛缩合得半缩酮,完成E环的构建,得21。
图6:Nicolaou‘s Synthesis of ABCDE Ring Fragment 21
B:FHI环体系的合成
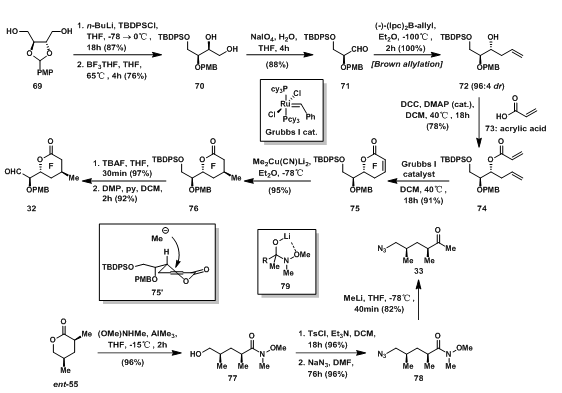
FHI环体系的合成首先从F环的构建开始。L-酒石酸拆分得到的二醇69先单保护羟基,PMP保护基在还原条件下切断一侧的C-O键,得到链状邻位二醇70,随后被氧化得到醛71;71经过Brown Allylation反应后高选择性的得到高烯丙醇72[5]。游离的羟基与丙烯酸发生酯化反应得74,随后在GrubbsⅠ催化剂下进行烯烃复分解反应关环得α,β-不饱和酯75;烷基铜锂试剂与75经过75‘所示过渡态发生1,4-共轭加成得到环内酯76,随后在TBAF的作用下脱除保护基的一级醇被氧化成醛32。
碎片33的合成是从反式55开始的。ent-55在Lewis酸作用下开环得到weinerb酰胺77;77中端羟基与TsCl反应后,被叠氮取代得叠氮化合物78;78与甲基锂发生亲核取代得33,其中由于锂离子的配位形成稳定的中间体79,使得78不会被还原过度得到三级醇。
图7:Nicolaou‘s Synthesis of Aldehyde 32 & Fragment 33
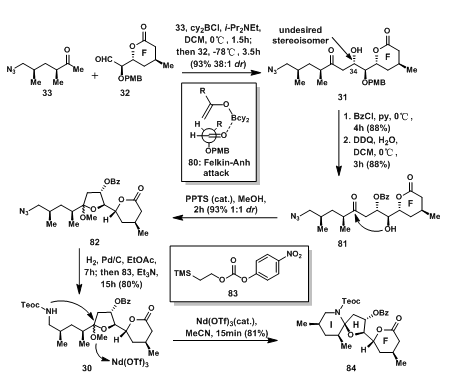
经Paterson Boron Aldol Reaction甲基酮33与醛32连接得到31,但C-34位不是期望的手性。Mukaiyama Aldol Reaction可以直接得到期望的手性,但所有的尝试都直接使32分解。虽然不是期望的手性,但是在后面的反应中,此手性中心有望可以得到转换;31的C-34位先用苄基保护后,DDQ脱除PMB保护得81;将81用催化量的PPTS催化在甲醇中反应得缩酮82;叠氮被H2还原成一级胺后经83(Teoc-O-(p-NO2C6H4))保护得到酰胺30;最后,在Nd(OTf)3的催化下关上另一侧的I环得混缩酮84。
图8:Nicolaou‘s Synthesis of FHI-Ringsystem 84
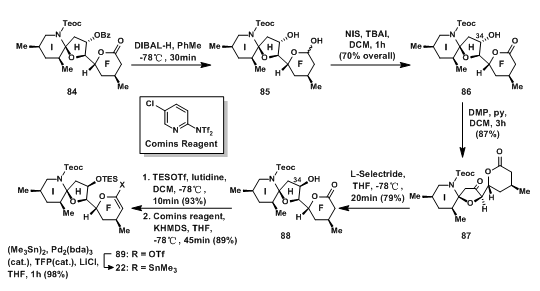
FHI环体系只剩将C-34位的手性转化成需要的构型了。为此首先将混缩酮84经DIBAL-H脱除苄基保护后,再将还原得到的羟基氧化成羰基的到86;再将C-34位的羟基氧化成羰基,随后还原得到88,通过氧化-还原的方法,C-34位的构型得到翻转;88的羟基先被保护,随后与comins reagent反应得磺酸盐89,最终将磺酸盐转化为烯基锡试剂22。
图9:Nicolaou‘s Synthesis of FHI-Ring Vinyl Stannane 84
C:碎片连接及全合成
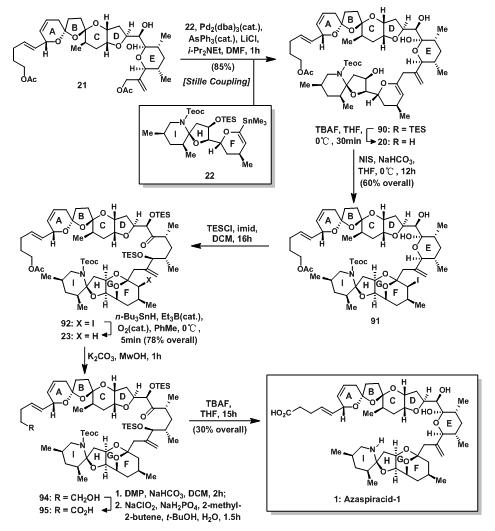
如下图所示,21和22通过Stille Coupling链接起来得90,脱除H环上O的TES保护基后得三醇20;20在NIS及NaHCO3的条件下立体选择性的形成G环,F环上的碘随后经自由基反应转换成H得到93(46);碱性条件下脱除A环侧链上的乙酰基得一级醇,随后发生两步氧化得端基处羧酸95,最后在TBAF条件下脱除N上保护基,完成azaspiracid-1的全合成。
图10:Nicolaou‘s Total Synthesis of Azaspiracid-1
参考文献
- (a) K. C. Nicolaou, M. O. Frederick, G. Petrovic, K. P. Cole, E. Z. Loizidou, Angew. Chem. Int. Ed. 2006, 45, 2609.DOI: 10.1002/anie.200600295 (b) K. C. Nicolaou, M. O. Frederick, E. Z. Loizidou, G. Petrovic, K. P. Cole, T. V. Koftis, Y. M. A. Yamada, Chem. Asian. J. 2006, 1–2, 245.DOI: 10.1002/asia.200600059;
- Margaret A. Brimblea, Farès A.Farèsb,Tetrahedron, 1999, 55, 7661 org/10.1016/S0040-4020(99)00387-7;
- (a) Robert H. Grubbs, Sukbok Chang, Tetrahedron, 1998, 54, 4413.org/10.1016/ S0040-4020(97)10427-6 (b)A. Fürstner, Angew. Chem. Int. Ed. 2000, 39, 3012. DOI: 10.1002/1521-3773(20000901)39 (c) K. C. Nicolaou, P. G. Bulger, D. Sarlah, Angew. Chem. Int. Ed. 2005, 44, 4490. DOI: 10.1002/anie.200500369;
- Arnab K. Chatterjee, Tae-Lim Choi, Daniel P. Sanders, Robert H. Grubbs, J. Am. Chem. Soc., 2003, 125, 11360. DOI: 10.1021/ja0214882;
- (a)Prabhakar K. Jadhav, Krishna S. Bhat, P. T. Perumal, Herbert C. Brown, J. Org. Chem., 1986, 51, 432. DOI: 10.1021/jo00354a003 (b) Uday S. Racherla, Herbert C. Brown, J. Org. Chem., 1991, 56, 401. DOI: 10.1021/jo00001a072;
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






















No comments yet.