摘要
合肥工业大学吴祥课题组(主页)近日发展了一种新颖的不对称脱氢Diels-Alder反应。该反应底物范围广,立体选择性高,可为其他珍贵手性化合物的合成提供参考。
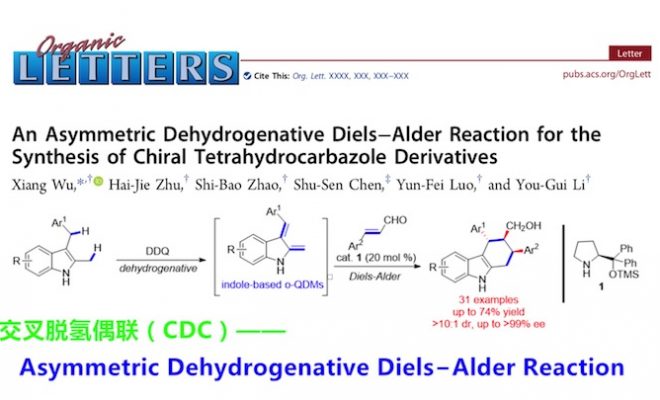
An Asymmetric Dehydrogenative Diels–Alder Reaction for the Synthesis of Chiral Tetrahydrocarbazole Derivatives
Xiang Wu* , Hai-Jie Zhu, Shi-Bao Zhao, Shu-Sen Chen, Yun-Fei Luo, and You-Gui Li
Org. Lett., 2018, 20, 32–35. DOI:10.1021/acs.orglett.7b03251
导师简介(引用自合肥工业大学官网)

吴祥
2001.09-2005.06,南开大学化学学院,理科基地班,本科
2005.09-2010.12,南开大学元素有机国家重点实验室,博士
2010.12-2012.08,苏州诺华制药科技有限公司,高级研究员
2012.08-2014.12,中国科学技术大学微尺度物质科学国家实验室,博士后
2014.12-2015.08,美国宾夕法尼亚州立大学化学系,博士后
2015.08-至今,合肥工业大学化学与化工学院应用化学系,副研究员
一、研究背景
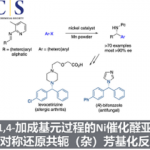
C-H键的直接官能团化是通过易得原料合成复杂分子的一种强有力的方法[1]。两个C-H键的交叉脱氢偶联(cross dehydrogenative coupling,CDC)是高效构建C-C键的另一策略[2]。尤其要提的是,脱氢后产生的多种多样的双烯用于Diels-Alder反应已经成为一步构建六元碳环的独特方法[3]。2011年White等人报道了Pd催化下末端烯烃烯丙位C-H键脱氢氧化形成双烯的方法[4]。双烯和烯酮的Diels-Alder反应也使BrosimonesA和B的全合成得以实现。最近,Antonchick组成功地将双烯前体范围扩展到简单的芳烷烃,多种缺电子的烯烃作为亲双烯体参与此Diels-Alder反应[5]。
作为一个独特的结构模块,四氢咔唑包含多个立体中心,广泛存在于天然的吲哚生物碱和合成药物,它们具有多种重要的生物活性(图1,B)。抛开合成四氢咔唑衍生物取得的进步,新颖和更加高效地合成多样化四氢咔唑结构的方法在有机和医药化学领域仍然迫切需要。脱氢Diels-Alder反应已经被用于四氢咔唑的合成,Zhang等人发现DDQ促进2-甲基-3-芳甲基和亲双烯体的Diels-Alder反应经历的是indole-2,3-quinodimethane途径(图1,A)[6]。课题组的兴趣是不对称氧化C-H键官能团化,因此他们希望实现此反应的对映选择性。氧化法构建手性四氢咔唑没有先例主要原因可能是(1)氧化剂与手性催化剂之间的兼容问题;(2)过(度)氧化问题。因此,本文报道了2-甲基-3-芳甲基吲哚和α,β-不饱和醛的首例不对称脱氢Diels-Alder反应(图1,C)。通过手性二级胺催化剂降低不饱和醛LUMO轨道能量这种经典的活化方式,此反应可以实现极好的立体控制,得到带有三个相邻手性中心的光学纯的四氢咔唑。
图 1合成四氢咔唑的脱氢Diels-Alder反应
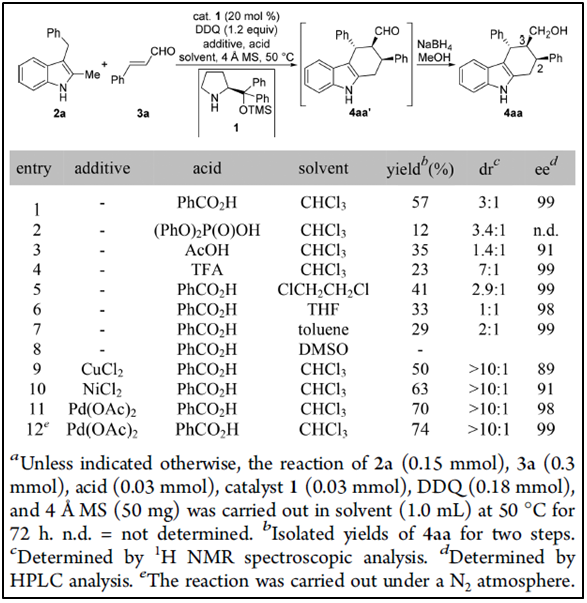
二、最佳反应条件的优化
课题组人员在4ÅMS存在下,以3-苄基-2-甲基-1H-吲哚(2a)和肉桂醛(3a)为底物,DDQ作为氧化剂,α,α-二苯基脯氨酸三甲基硅醚(1)/苯甲酸作为催化剂建立模型反应。50℃下,CHCl3中进行的反应取得较为不错的结果,NaBH4还原之后观察到3:1的dr值,主要的非对映体4aa分离产率57%,ee值高达99%,仅有少量的氧化副产物3-苯甲酰基-2-甲基-1H-吲哚生成(表1,entry 1)。改变不同的Brønsted酸,产率降低(entries 2-4)。值得提出的是一个强的Brønsted酸会提高反应的非对映选择性(entries 2,4 vs 1)。筛选溶剂时发现,在DCE、THF、甲苯和DMSO中,CHCl3仍然是最好的溶剂(entries 5-8 vs 1)。为了提高非对映选择性,课题组人员探究了添加剂的作用,催化量的过渡金属盐确实提高了dr值(entries 9-12)。例如,加入20 mol%的CuCl2或NiCl2会得到大于10:1的dr值,然而是以降低对映选择性为代价的(entries 9-10)。Pd(OAc)2在非对映选择性和对映选择性上都能取得
较好的结果,如果能在N2保护下进行效果将会更好(entry 12)。产物4aa的绝对构型通过X-射线衍射得到确定,结果表明分子中存在一个不常见的2,3-顺式结构。
表 1反应条件的优化
三、底物拓展
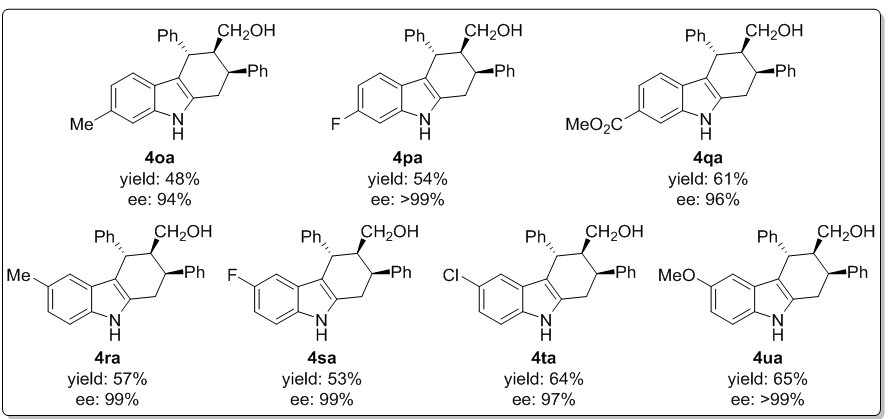
确定最佳反应条件之后,研究人员固定底物肉桂醛3a,首先探究了底物2-甲基-3-芳甲基吲哚(2)的适用范围。多数情况下,带有给电子基、吸电子基取代的底物都能进行反应,生成对应的四氢咔唑产物4ba-4na,产率中等(38-73%),但是对映选择性和非对映选择性都极佳(图2)。苯环间位带有氰基的底物2j得到的产物ee值略低。虽然芳环换成萘之后产率很低(4ma),但非对映选择性还是极好的(98%ee)。此外,芳杂环例如噻吩(4na)也可以兼容反应,产率中等。吲哚环上带有不同取代基也可顺利进行反应(图3)。无论取代基的位置和电性因素如何,最优条件下反应都可以顺利进行,生成手性四氢咔唑4oa-4ua,产率中等(48-65%),两种立体选择性也是非常好的。
图 2底物2-甲基-3-芳甲基吲哚的适用范围
图 3取代2-甲基-3-苄基吲哚的适用范围
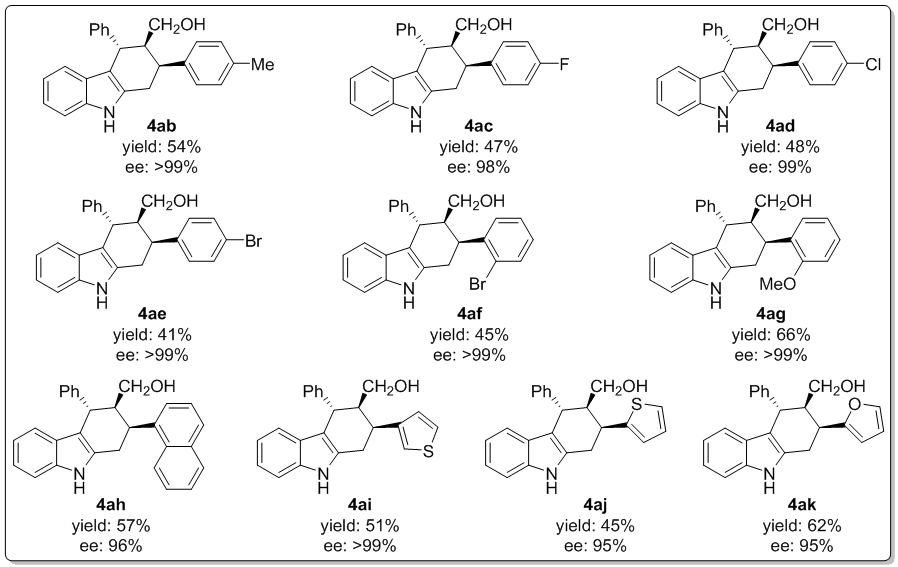
随后探究的是α,β-不饱和醛的范围,β-芳基或杂环芳基单取代的底物结果如下(图4)。不难发现,肉桂醛的苯环上不同取代基对反应的立体选择性没有大的影响,对应的产物为4ab-4ag,产率41-66%。噻吩环C2取代和C3取代的底物相比(4ai和4aj),后者产率和ee值都更高,值得一提的是呋喃环在反应过程中可以与氧化剂共存,产率可观(4ak)。
图 4底物α,β-不饱和醛的适用范围
四、机理探究
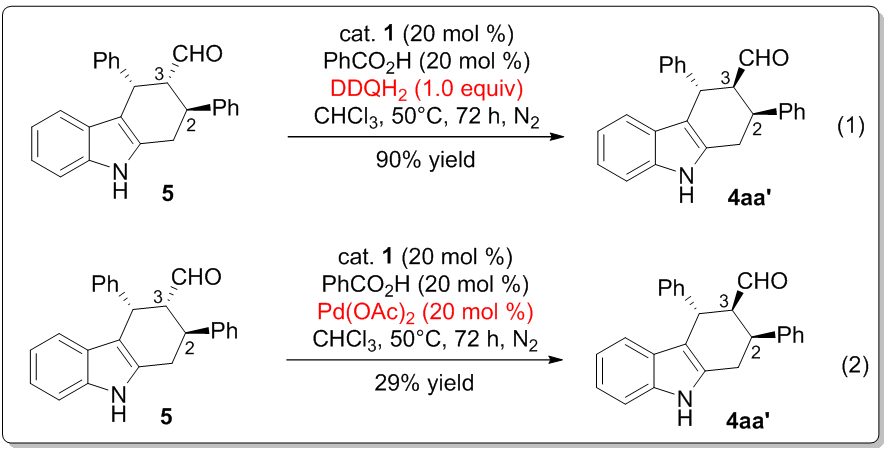
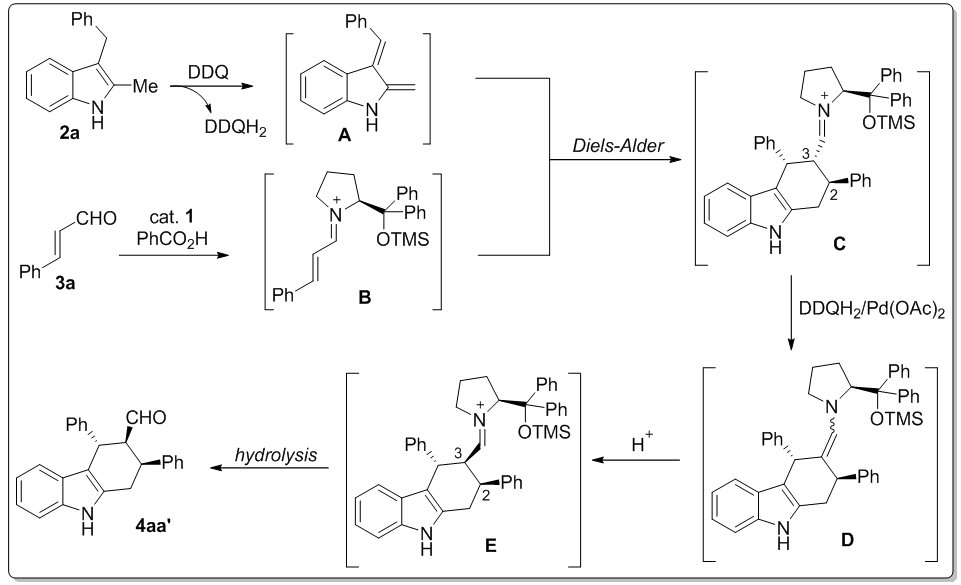
为了更全面地理解产生不常见2,3-顺式产物的反应过程,研究人员进行了两个对照实验。在本文氧化反应体系中,DDQH2作为生成的副产物可能会促进产物构型的翻转。因而,当2,3-反式的醛5和DDQH2在催化剂和苯甲酸存在下以90%产率生成了2,3-顺式产物(eq 1)。此外,添加剂Pd(OAc)2具有类似的转化作用,可将醛的构型部分转化(产率29%)(eq 2)。上述事实清楚地表明本文不常见的2,3-顺式结构是通过DDQH2和Pd(OAc)2将反式结构的醛翻转而来。为了解释反应的立体选择性结果,课题组提出了一个可能的反应机理(图6)。首先,在DDQ作用下底物脱氢形成中间体A。亚胺正离子B由催化剂1和PhCO2H催化底物醛3a产生。随后两中间体顺利地发生Diels-Alder反应得到一个环加成中间体C。DDQH2和Pd(OAc)2则促进C3位差向异构化得到2,3-顺式结构的中间体E,此过程经历手性烯胺D。最后,水解释放催化剂1得到最终的顺式产物。
图 5对照实验
图 6反应机理
参考文献
[1]Selected recent reviews: (a) Bering, L.; Manna, S.; Antonchick, A.P. Chem. – Eur. J.2017, 23, 10936.DOI:10.1002/chem.201702063;(b) Qin, Y.; Zhu, L.; Luo, S. Chem. Rev. 2017, 117, 9433. DOI:10.1021/acs.chemrev.6b00657 [2]Selected reviews on the CDC reaction: (a) Li, C.-J. Acc. Chem. Res. 2009, 42, 335. DOI:10.1021/ar800164n (b) Scheuermann, C. J. Chem. – Asian J. 2010, 5,436. DOI:10.1002/asia.200900487 [3]Li, W.; Zhou, L.; Zhang, J. Chem. – Eur. J. 2016, 22, 1558. DOI:10.1002/chem.201503571 [4]Stang, E. M.; White, M. C. J. Am. Chem. Soc. 2011, 133, 14892. DOI: 10.1021/ja2059704 [5]Manna, S.; Antonchick, A. P. Chem. – Eur. J. 2017, 23, 7825. DOI: 10.1002/chem.201701535 [6](a) Zhou, L.; Xu, B.; Zhang, J. Angew. Chem., Int. Ed. 2015, 54,9092. DOI: 10.1002/anie.201503549 (b) Liu, T. X.; Ma, J. L.; Chao, D.; Zhang, P. L.; Ma, N. N.; Liu,Q. F.; Shi, L.; Zhang, Z. G.; Zhang, G. S. Org. Lett. 2016, 18, 4044. DOI: 10.1021/acs.orglett.6b01902
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.