译自Chem-Station网站日本版 原文链接:溶媒の同位体効果 solvent isotope effect
翻译:炸鸡
什么是溶剂的同位素效应?(solvent isotope effect)
溶剂的同位素效应是指使用被同位素(尤其是氢的同位素)标记的溶剂时显现出的同位素效应。
在化学研究中为了能用NMR等手段观察分子的化学性质或化学反应的进行状态,经常会用重水(D2O)或氘代甲醇(CD3OD)溶解分子(前提是分子可溶于水或甲醇)。当分子在重水(D2O)或氘代甲醇(CD3OD)中,原本的化学性质或反应特性可能会发生极大的改变。
- 例1: 羧酸的酸解离度
羧酸在D2O中的酸度系数要比在H2O中的要小,酸解离度下降到了原来的二分之一。
- 例2: 特殊酸催化剂催化的酯的水解
由特殊酸催化剂(H3O+)催化的酯的水解的反应在D2O中的反应速度要比在H2O中的要快一倍(逆同位素效应)
怎么理解溶剂同位素效应
以上两个就是溶剂同位素效应的具体例子。和被同位素替换的分子的动力同位素效应相比,溶剂的同位素效应并不是特别为人熟知,但质子性重溶剂中,溶剂的同位素效应会更显著,这一点要注意。用氘代溶剂会比用其他同位素标记的分子省去很多麻烦,所以经常利用溶剂同位素效应来分析反应机理。
本篇记事参考了教科书[1],以前平衡的逆同位素效应为中心,介绍溶剂的同位素效应。
◎从分离系数上理解
有一个活泼氢的分子(反应物)SH和作为氘代溶剂的醇ROD进行同位素交换反应,当反应达到平衡时,有如下反应方程式。
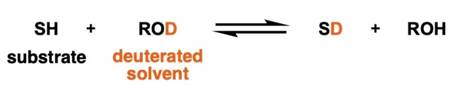
(注:式子中的SH和SD中的S是反应物Substrate的缩写S,并非表示硫元素。)
分离系数φ可以用上式左右两边的物质的浓度来表示。例如[SD] 表示物质SD的浓度。
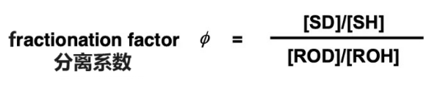
分离系数可以通过实验来测得,所以通过测定分离系数的值可以准确预测出同位素效应。分离系数的大小与分子和可交换氢之间的键的类型有关。可以依据键的类型大致预估分离系数的大小(下图)[1]。
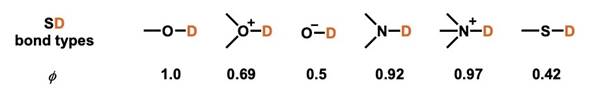
根据分离系数的大小,可以解释同位素效应和预测同位素效应的发生。
◎从反应平衡上理解
例1
如果反应物SH生成另一种反应物S’H的反应有反应平衡,那么可以假定把SH的活泼氢替换成氘原子而得到的SD也会拥有同样的反应平衡。
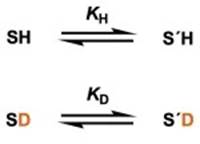
氘代前和氘代后的反应的平衡常数分别设为KH、KD ,反应物SH和S’H的分离系数用φ和φ’代替,那么KH/KD可以写成:

我们可以看出:氘代溶剂中反应的平衡常数KD可以用普通溶液中的反应的平衡常数KH和分离系数φ、φ‘来表示。
仅仅通过数值计算我们可以做出如下预测:羧酸在重水D2O中的解离平衡常数比在普通水中的小,解离平衡常数减半。
为什么能做出上述的预测呢?下面以醋酸 (CH3CO2H)为例,思考下面的反应平衡。
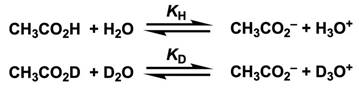
非氘代反应和氘代反应的平衡常数用各物质的浓度来表示。
例2
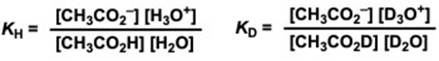
我们可以得到KH/KD的大小,然后代入各个物质的分离系数,就得到以下等式。
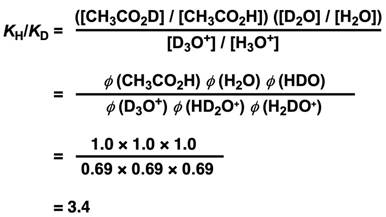
(这里要注意:H2O要变成D2O需要替换两次氘原子(HDO, H2O),所以有两个分离系数,H3O+ 要变成D3O+ ,需要替换三次氘原子(D3O+, HD2O+, H2DO+),所以有三个分离系数。)
这里补充一个小知识:当酸的解离度很小的时候,解离度约与平衡常数K的平方根成正比,所以KH/KD=3.4可以推出酸在普通水中的解离度/酸在重水中的解离度=√3.4≈1.8(是重水中的解离度的近乎两倍)。如果把羧酸换成醇ROH同样也会有类似的结果[2]。
特殊酸催化剂(H3O+)催化的酯水解反应在重水D2O中的速度是普通水H2O中的两倍(逆同位素效应)。
以SN1型的加水分解(比如苯甲酸乙酯)为例。水解反应分为两个阶段:第一阶段为质子化平衡反应,设这段反应的平衡常数为KH,第二阶段为质子化体的分解反应,是决速步,设这段反应的速率常数为kR。同样的反应发生在重水中也是这么设(分别为KD,kR)。下面来看看是怎么用分离系数表示出kH/kD的比值,这个比值表示氘代前反应的总速率与氘代后反应的总速率的比值,同时也标志着着同位素效应的强弱。
加课: 怎么理解动力学同位素效应
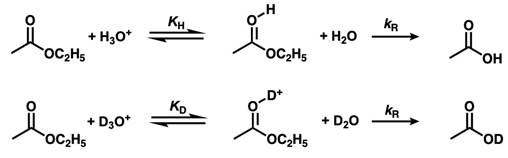
第一步的平衡常数可以用下式表示。
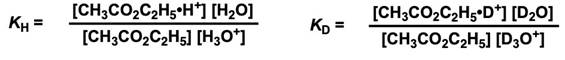
决速阶段(kR)不涉及同位素效应,又因为kH = KH × kR 、kD = KD × kR,所以可以用KH/KD表示同位素效应kH/kD。接下来我们代入分离系数φ求解kH/kD。
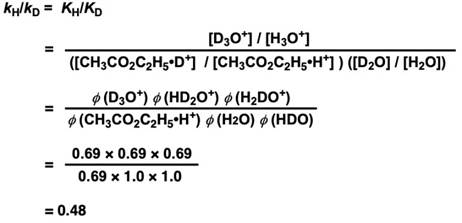
kH/kD = 0.48,可以得知在重水中的酯水解反应速度是普通水中的约两倍(逆同位素效应)。
四级铵盐在碱性条件下进行的Hofmann消除反应,在重水中观察到速率比普通水中快7倍,这也可以用类似的方法解释[3]。
另一方面,在没有第一步的平衡反应(即前平衡)的情况下,质子化作为反应的决速步骤时,一级同位素效应会起到重要作用,这会导致在重水中反应速率变慢。使用羧酸作为催化剂进行的乙烯醚水解反应(通常是酸催化反应)就是一个很好的例子[1]。
参考文献
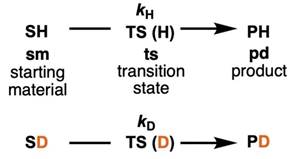
以上两个例子都是包含平衡阶段的反应的的同位素效应,但有时反应不仅仅要考虑平衡阶段的同位素效应,还要考虑动力学阶段和决速阶段的动力同位素效应(Kinetic Isotope Effect, KIE)。反应物 SH (starting material, sm)经过过渡态 TS(H)(transition state, ts)变成生成物 PH (product, pd)。设这个反应的反应速率常数为kH。氘代反应物SD同样经过过渡态TS(D)变成PD,反应速率常数设为kD。
动力同位素效果(KIE)kH/kD可以用下面式子表示。反应物和生成物的分离系数可以通过测量得到,但过渡态的分离系数无法测得,所以过渡态的分离系数φ(ts)暂且用加权平均数来近似。(∏代表无穷乘积。x 代表过渡态接近生成物的程度(0~1)。)
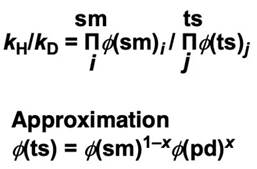
需要考虑动力学同位素效应的场景有:分子(反应物)有易于与溶剂进行交换的质子(醇类的OH、酰胺的NH或活性亚甲基),催化剂里有可以被氘代的质子,氘代溶剂直接参与反应等。当反应的决速步涉及质子交换时,把反应溶剂换成氘代溶剂几乎都会减慢反应速度,但当反应的前一阶段为平衡反应时,会出现例2中那样的逆同位素效应,所以要格外注意kH/kD的计算值。
- 野依良治ほか編「大学院講義有機化学I(第一版)」東京化学同人, 1999.(第二版では詳細は削除)
- Albery, J. (1975). Solvent Isotope Effects. In: Caldin, E., Gold, V. (eds) Proton-Transfer Reactions. Springer, Boston, MA. https://doi.org/10.1007/978-1-4899-3013-2_9
- Clayden, Greeves, Warren, Organic Chemistry, 2nd eds. Oxford University Press, Chap 39, 2001.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.
























No comments yet.