本文作者:杉杉
导读
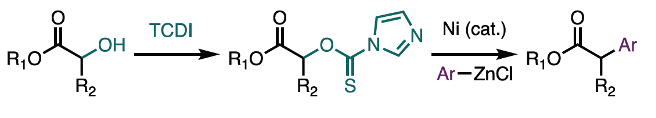
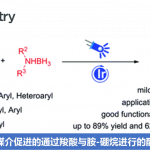
近日,Toronto大学的S. A. L. Rousseaux课题组在Org. Lett.中发表论文,报道一种通过镍催化剂促进的α-羟基酯衍生物与芳基锌试剂之间的Negishi交叉偶联反应方法学。这一全新的交叉偶联策略对于一系列一级与二级C(sp3)-O醇前体均能够有效地兼容,并且反应过程中无需添加相关的外部金属还原剂、光催化剂或其他添加剂。同时,这一全新的Negishi交叉偶联方法学具有实验操作简捷以及反应条件温和等优势。
Ni-Catalyzed C(sp3)-O Arylation of α‑Hydroxy Esters
J. J. Monteith, S. A. L. Rousseaux, Org. Lett. 2021, ASAP. doi:10.1021/acs.orglett.1c03674.
正文
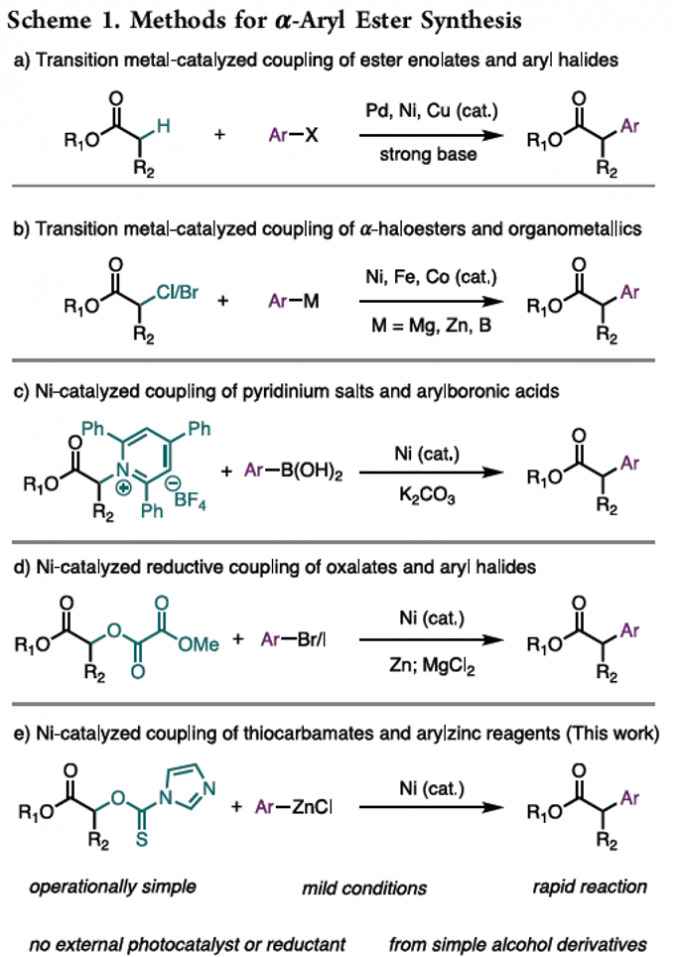
α-芳基酯及其衍生物广泛存在于一系列具有重要价值的药物分子中。目前,对于各类α-芳基羰基化合物的构建,已经成功设计出诸多的合成转化策略 (Scheme 1a-d)[1]-[8]。这里,受到本课题组前期对于采用具有氧化还原活性的O-硫代氨基甲酸酯离去基团进行的三级环丙醇C(sp3)-O芳基化反应方法学[9]研究的启发,本文作者成功设计出一种通过镍催化剂促进的α-羟基酯衍生物与芳基锌试剂之间的Negishi交叉偶联反应方法学 (Scheme 1e)。
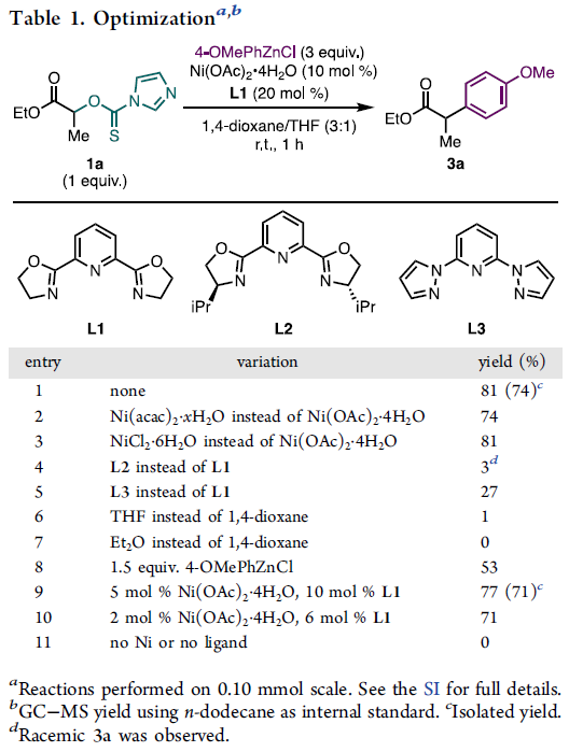
首先,作者采用thiocarbonyl imidazolide 1a与4-OMePhZnCl (2a)作为模型底物,进行相关偶联反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Ni(OAc)2·4H2O作为催化剂,L1作为配体,在1,4-二氧六环与THF的混合溶剂中,反应温度为室温,最终获得74%收率的α-芳基酯偶联产物3a。
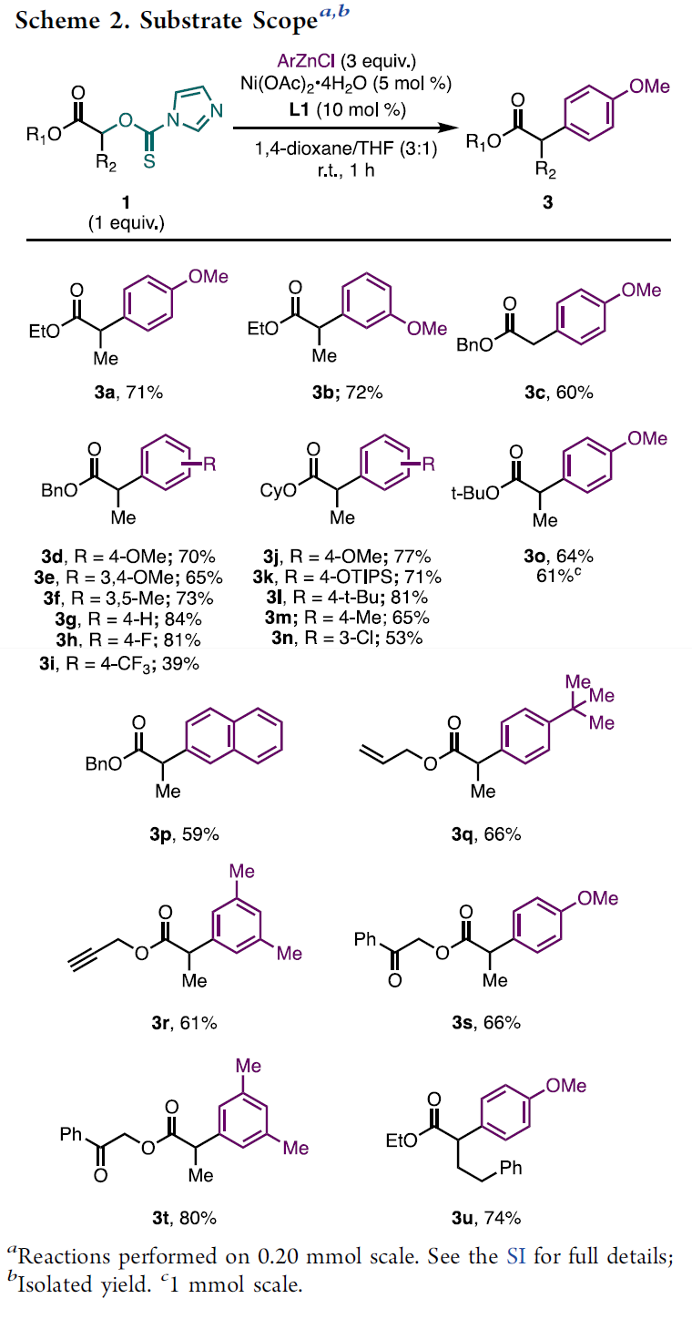
在上述的最佳反应条件下,作者首先对各类thiocarbonyl imidazolide底物的应用范围进行考察 (Scheme 2)。研究表明,具有苄基、环己基以及叔丁基取代的thiocarbonyl imidazolide底物,均能较好地与上述的标准反应条件兼容,并获得相应的交叉偶联产物3a–3p (39-84% 收率)。同时,作者发现,具有烯基、炔基以及酮羰基结构单元的thiocarbonyl imidazolide底物,同样能够顺利地完成相应的交叉偶联过程,并获得相应目标产物3q–3t (61-80% 收率)。综上研究表明,这一全新的交叉偶联策略具有良好的官能团兼容性。之后,作者进一步发现,上述的标准反应体系对于具有α-烷基侧链的thiocarbonyl imidazolide底物,同样能够以良好的反应收率,获得预期的偶联产物3u。
接下来,作者对一系列芳基锌试剂的应用范围进行深入研究。该小组发现,芳基不同位置具有一系列供电子与吸电子基团取代的芳基锌试剂,均能够有效地参与上述的交叉偶联过程,并获得相应的目标产物3a–3u。
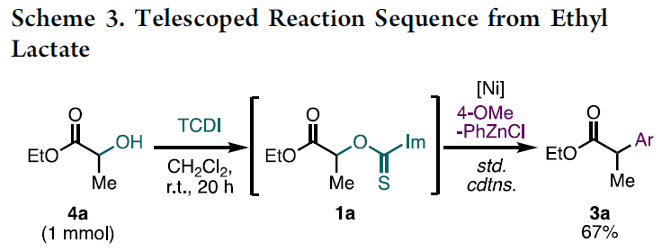
之后,作者发现,通过4a (用量扩大至1 mmol)原位制备的1a底物在上述的标准反应条件下,同样能够以良好的反应收率,获得相应的偶联产物3a (Scheme3)。
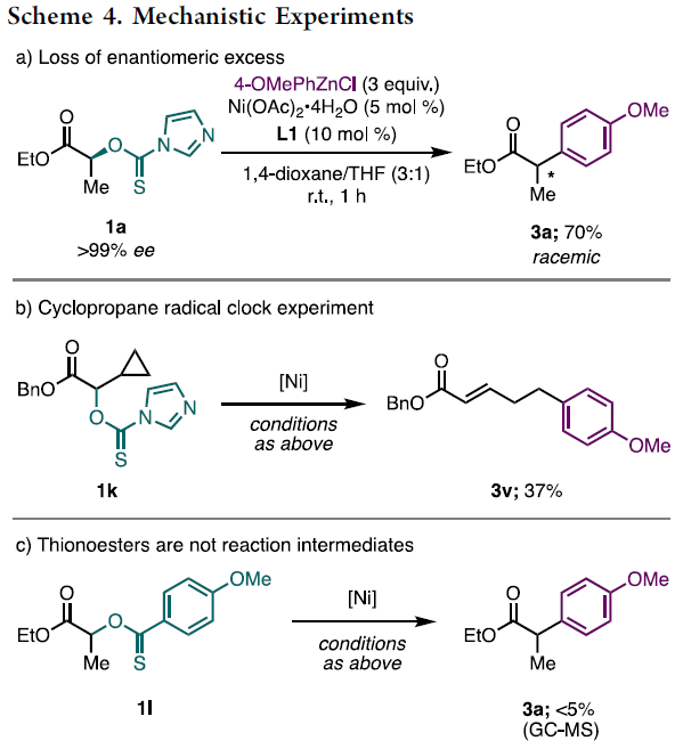
接下来,作者对上述偶联过程的反应机理进行初步研究 (Scheme 4)。首先,作者发现,采用对映纯的thiocarbonyl imidazolide底物 1a,在上述的标准体系中,最终能够分离出70%收率的外消旋混合物3a (Scheme 4a)。进而表明反应过程中,产物立体化学的消失涉及烷基自由基中间体的形成。之后,该小组进一步通过自由基钟实验的研究,证实这一烷基自由基中间体的存在 (Scheme 4b)。同时,研究发现,在选择具有氧化还原活性的硫代酯1l参与的偶联过程中,则仅能够观察到痕量 (<5% 收率)的产物3a,这一事实表明,反应过程中涉及通过C(sp3)-O 键断裂过程形成的自由基中间体 (Scheme 4c)。
总结
S. A. L. Rousseaux课题组报道一种采用镍催化剂促进的通过C(sp3)-O亲电底物参与的Negishi交叉偶联反应方法学,进而成功完成一系列α-芳基酯分子的构建。同时,反应过程中无需添加外部金属还原剂、光催化剂或添加剂。此外,这一全新的Negishi交叉偶联反应策略具有底物廉价易得、应用范围广泛、良好的官能团兼容性以及反应条件温和等优势。
参考文献
[1] (a) B. C. Hamann, J. F. Hartwig, J. Am. Chem. Soc. 1997, 119, 12382. doi: 10.1021/ja9727880.(b) M. Palucki, S. L. Buchwald, J. Am. Chem. Soc. 1997, 119, 11108. doi: 10.1021/ja972593s.
[2] (a) C. Carfagna, A. Musco, G. Sallese, R. Santi, T. Fiorani, J. Org. Chem. 1991, 56, 261. doi: 10.1021/jo00001a049.(b) T. Hama, X. Liu, D. A. Culkin, J. F. Hartwig, J. Am. Chem. Soc. 2003, 125, 11176. doi: 10.1021/ja036792p.
[3] Z. T. He, J. F. Hartwig, J. Am. Chem. Soc. 2019, 141, 11749. doi: 10.1021/jacs.9b03291. [4] (a) N. A. Strotman, S. Sommer, G. C. Fu, Angew. Chem. Int. Ed. 2007, 46, 3556. doi: 10.1002/anie.200700440.(b) C. Liu, C. He, W. Shi, M. Chen, A. Lei, Org. Lett. 2007, 9, 5601. doi: 10.1021/ol702456z.
[5] (a) T. Q. Chen, D. W. C. A. MacMillan, Angew. Chem. Int. Ed. 2019, 58, 14584. doi: 10.1002/anie.201909072.(b) H. Guan, Q. Zhang, P. J. Walsh, J. Mao, Angew. Chem. Int. Ed. 2020, 59, 5172. doi: 10.1002/anie.201914175.
[6] M. E. Hoerrner, K. M. Baker, C. H. Basch, E. M. Bampo, M. P.Watson, Org. Lett. 2019, 21, 7356. doi: 10.1021/acs.orglett.9b02643. [7] M. Gao, D. Sun, H. Gong, Org. Lett. 2019, 21, 1645. doi: 10.1021/acs.orglett.9b00174. [8] Z. Li, W. Sun, X. Wang, L. Li, Y. Zhang, C. Li, J. Am. Chem. Soc. 2021, 143, 3536. doi: 10.1021/jacs.0c13093. [9] R. Mills, J. J. Monteith, G. dos Passos Gomes, A. Aspuru-Guzik, S. Rousseaux, S. J. Am. Chem. Soc. 2020, 142, 13246. doi: 10.1021/jacs.0c06904.本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载














No comments yet.