本文投稿作者孙苏赟
平面对称在化学中是很常见的,一般来讲当一个化合物具有结构镜面对称并且性质相同的结构就称为面对称,当一个反应只在这两个结构中的一个上发生时就是去对称化。在有机合成中,去对称化有着广泛的应用,可以用作合成一些复杂的天然产物分子1,2,2016年Inoue组合成的ryanodine就是一个例子。
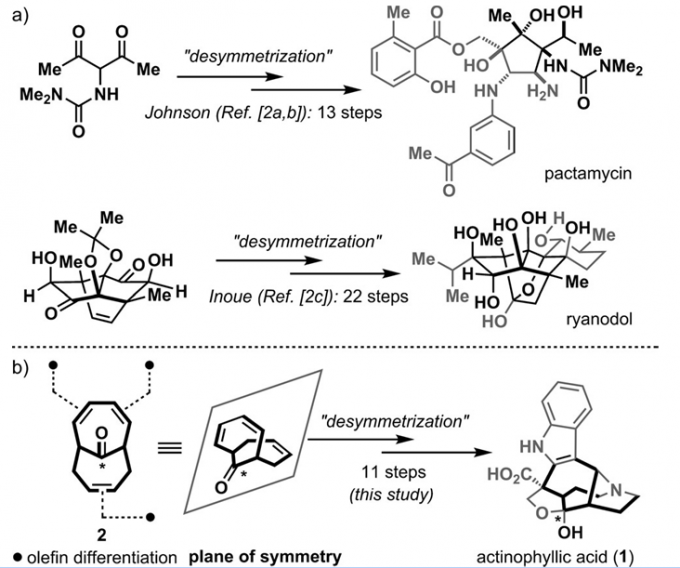
SCHEME1|a)去对称化的目标导向性合成的分子;b)使用二环[4.4.1]三酮作为重要中间体合成actinophyllicacid(1)的前体
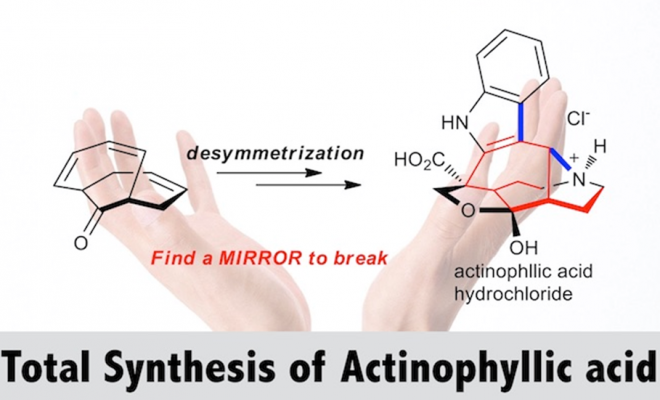
不久前,首尔国立大学David Y.-K.Chen课题组和北海道大学的Hidetoshi Tokuyama课题组联合在ACIE上报道了利用以上去对称化的思路进行的antinophyllicacid的全合成工作,尽管这个分子在之前有被其他课题组合成过3-7,但是小编觉得本文报道的方法更加巧妙。
“Total Synthesis of Actinophyllic Acid
Yu Yoshii, Hidetoshi Tokuyama, and David Y.-K. Chen*
Angew. Chem. Int. Ed. 2017, 56, 12277-12281 DOI: 10.1002/anie.201706312
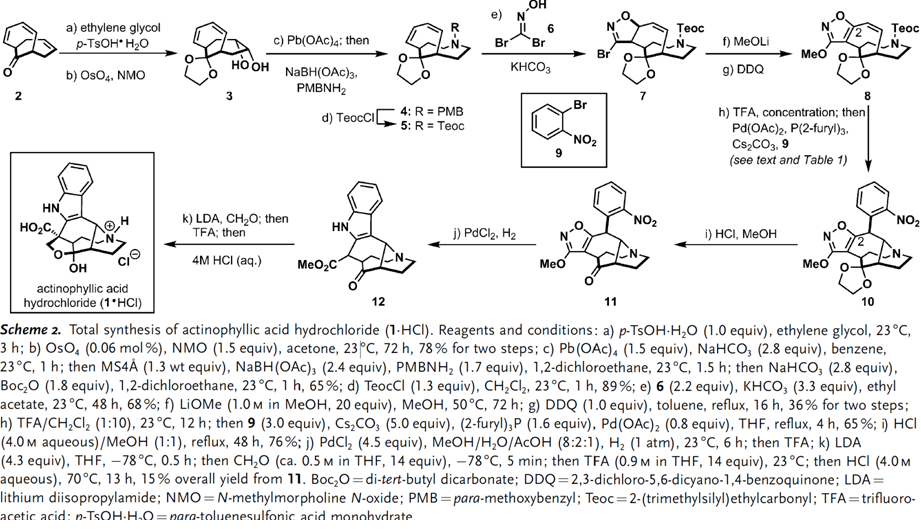
SCHEME2|Actinophyllicacid盐酸盐的合成(1·HCl).
合成从二环[4.4.1]三烯酮出发,先是用TsOH和乙二醇保护羰基,再小心控制反应条件,NMO/OsO4进行不对称双羟基化得到3,可喜的是这个过程并不会影响旁边两个共轭的双键。之后再用Pb(OAc)4进行邻二醇的裂解得到二醛中间体,再用NaBH(OAc)3还原、PMBNH2成环得到的4用TeocCl换上保护Teoc的化合物5。这里将PMB换成Teoc是因为EWG会使分子在接下来的氧化反应等反应中收到尽可能少的影响。
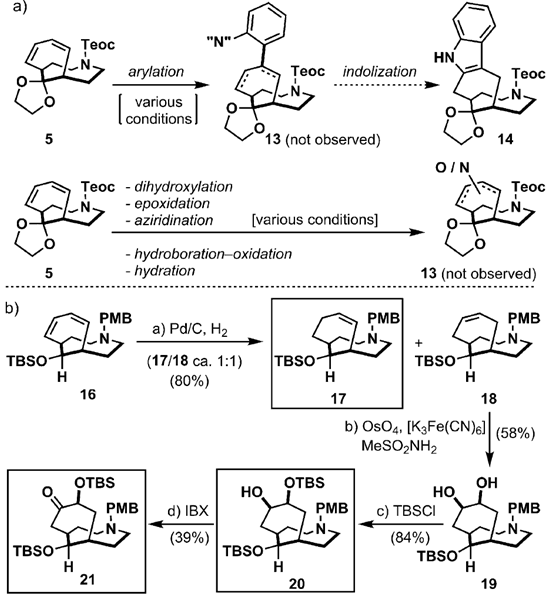
SCHEME3|a)利用去对称话策略对5的处理的早期研究;b)合成不对称烯烃17和二硅醚化合物20,21
当得到了5之后就要进行关键的步骤了(Scheme3),如果从目标分子actinophyllicacid的角度来看,如何构造吲哚结构片段是很重要的,所以在scheme3a中是一些进行测试的可能可行的方案。氧化或是胺化条件的效果都不太好,但是后来发现用催化氢化的条件可以得到比例近似1:1的17和18,但是生成18的机理尚不是很清楚8。尽管如此,18在双羟基化的条件下(OsO4,[K3Fe(CN)6],58%yield)可以得到二醇19,再利用TBSCl进行去对称化得到硅醚化合物20,再利用IBX进行氧化即得到了重要的中间体21。这样的合成策略在合成中是非常有用的。
接下来来看通过中间体17,20和21合成actinophyllicacid的途径,特别是构造其中的吲哚结构(此前也有人对此进行研究过4-7)。基于以上的研究,回到scheme2的合成路线中,5和6进行脱溴的[2+3]环加成反应原位得到异恶唑啉化合物7,产率68%,并且没有异构体产生。溴代异恶唑啉7之后在MeOLi作用下脱溴,DDQ氧化得到8,8是一个缩酮类,并且在C2的氧化态是符合目标分子的要求的。
SCHEME4|偶联反应的筛选条件
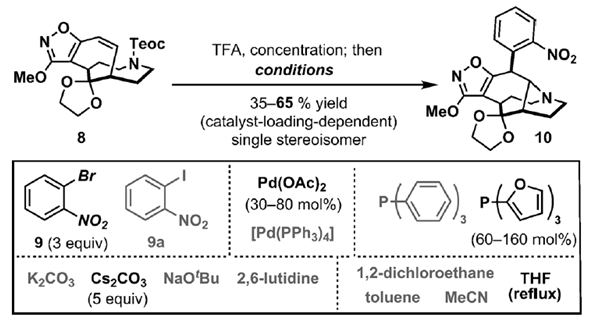
选择性的将2中三个双键中的两个进行官能团化,多步处理后得到了还有剩余一个双键的8,8接下来就是要进行芳构化反应以进行后续的吲哚结构的构造;此外,通过将其与邻吡咯烷进行同步化,可以使得芳基化更容易发生;这里利用的是Wolfe开发的方法学,反应中可以使双键的两个碳原子的同时偶联反应10。将8用TFA处理出去二胺的保护剂形成TFA的盐,而这个中间体就可以直接用芳胺化反应条件进行处理了。10的产率是和反应条件息息相关的(Scheme4),找寻到的最佳反应条件是p-NO2BrPh,Pd(OAc)2,P(2-furyl),Cs2CO3和THF作为溶剂。
SCHEME5|胺化芳化过程可能的机理的推测
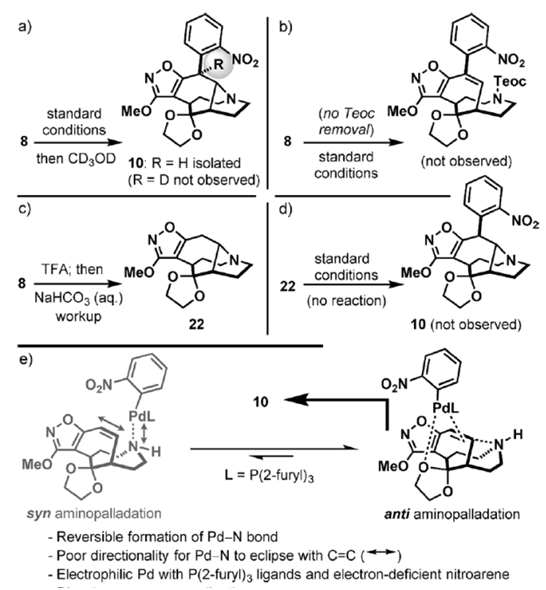
通过二维NMR和一系列研究最终确定了10的成功合成。可能的反应过程是初始产物发生异构化,或者是芳化反应的发生可能和氨基无关。但是后来用同位素标记法的试验结果并不支持这样的推测(Scheme5a,b)。但是后来发现脱胺保护基之后会生成化合物22(Scheme5c),但是这个结构并不能在一般的条件下进行接下来的芳化反应(Scheme5d)。因此作者提出了Scheme5e中的模型。
再回到scheme2中,以上的胺化芳化的方法可以将8转化成的10,10在酸性条件下脱去保护剂得到11,之后可以自发的发生反应生成具有吲哚片段的化合物12,12在羧基的α-位增碳成环最终得到目标分子actinophyllicacid。
在上述的合成中,从二环化合物2出发,利用一系列方法学,包括非常新颖的双键双位偶联反应,这个步骤在以往对天然产物的合成中是非常少见的。
参考文献
- The Logic of Chemical Synthesis, Wiley-VCH,Weinheim,1989
- Tetrahedron Lett. 2014, 55, 7147;DOI:1016/j.tetlet.2014.10.152
- J. Am. Chem. Soc. 2008,130, 7568; DOI:10.1021/ja803158y
- J. Am. Chem. Soc. 2010,132,4894; DOI:10.1021/ja100178u
- J. Am. Chem. Soc. 2013,135,12984; DOI:10.1021/ja4070206
- Tetrahedron, 2014, 70, 4094; DOI:1016/j.tet.2014.03.034
- J. Am. Chem. Soc. 2016,138, 3298; DOI:10.1021/jacs.6b00567
- J. Am. Chem. Soc.1987,109, 6115; DOI:10.1021/ja00254a034
- J. Org. Chem. 2008, 73, 8851; DOI:10.1021/jo801631v
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.