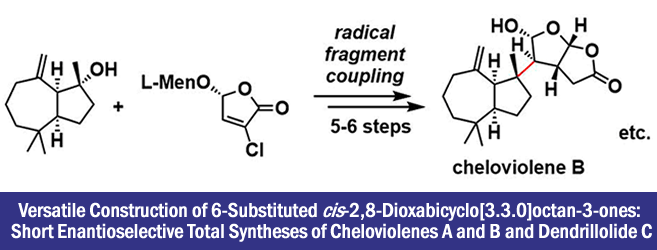
2017年、加州大学欧文分校・Larry E. Overman等人、通过利用可见光氧化还原催化剂催化的3级碳的自由基偶联为突破点、开发出了6位取代cis-2,8-dioxabicyclo[3.3.0]octan-3-one unit的高效不对称合成法。此外,使用这种方法,实现了海绵状双萜天然产物的短步骤不对称全合成。
“Versatile Construction of 6-Substituted cis-2,8-Dioxabicyclo[3.3.0]octan-3-ones: Short Enantioselective Total Syntheses of Cheloviolenes A and B and Dendrillolide C”
Slutskyy, Y.; Jamison, C. R.; Zhao, P.; Lee, P.; Rhee, Y. H.; Overman, L. E.* J. Am. Chem. Soc. 2017, 139, 7192-7195. DOI: 10.1021/jacs.7b04265
概要
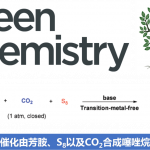
cis-2,8-dioxabicyclo[3.3.0]octan-3-one环骨架存在于100种以上的天然产物中。另外、地中海产的海绵生物Spongia zimocca中提取的重排型的Spongiane diterpenes以及其关联化合物的全合成迄今还未被达成。因此,对于其生物活性也所知甚少,目前为止所了解的仅仅是对高尔基体显示有一定的活性。
Overman等人,针对6位取代的骨架作为目标,设计了一个合成策略。
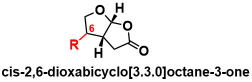
具体方法
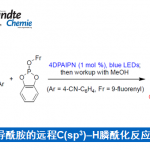
作恶者们利用以前研究积累的经验,认为可以通过使用叔碳自由基与5-烷氧基丁烯内酯的偶联短步骤合成所需骨架。
而对于叔碳自由基,他们通过以前独自开发的hemioxalate盐作为底物[1],在可见光还原催化剂下生成。
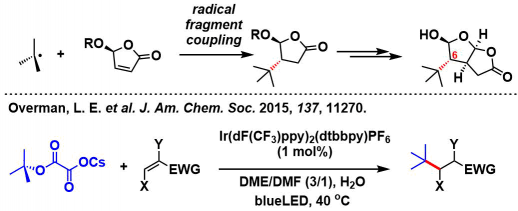
策略的有效性验证
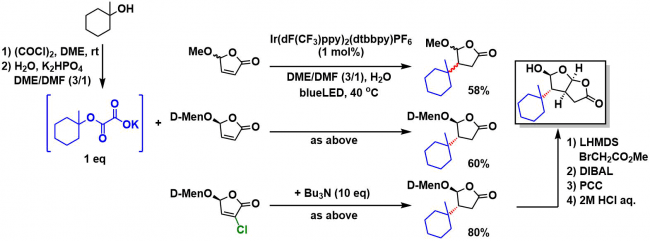
①使用模型底物对关键反应进行尝试
以1-甲基环己醇为原料,进行上述反应研究。主要目的是one-pot合成目标偶联产物。
*具体实施方法: 在1-甲基环己醇的DME溶液中,加入1当量的(COCl)2,再与水/K2HPO4 (3 eq)混合生成hemioxalate钾盐。然后再加入1当量的5-alkoxybutenolide,在可见光氧化还原催化剂催化下,得到58%产率的偶联产物。
*在甲氧基部位使用手性辅助基的情况,可以的氘60%产率,单一非对映体目标产物。
*另外,作者在以前的研究中已经了解到氯取代的化合物具有更好的反应性[2],因此在使用氯取代底物并且加入Bu3N (10 eq)为添加剂,在脱氯进行的同时,目标产物产率提高到了80%。然后再经过4步得到6位取代的关键骨架。
②全合成
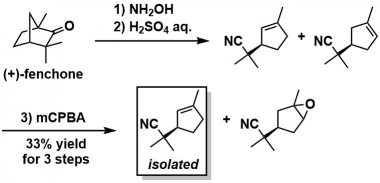
起始原料的合成:从(+)-fenchone可以合成10g量的出发原料[3]。
左侧片段的合成:根据Stork的环氧-腈环化方法[4]构建7元环,继而经过Eschweiler-Clarke还原甲基化→Cope消除反应高效实现了左侧片段的合成。
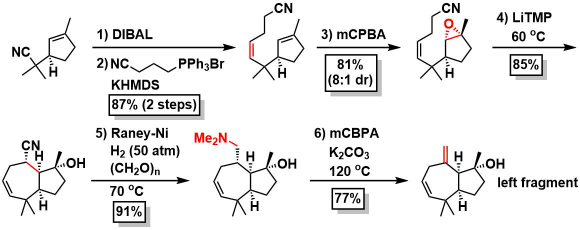
hemioxalate自由基偶联(关键反应):然后在用左侧片段进行关键反应的时候,由于叔碳自由基自身的还原副反应会竞争性的发生,作者通过溶液浓度从0.05M调整成0.6M(THF),有效地抑制了该副反应,得到了76%产率的偶联产物,继而实现了cheloviolene A的不对称全合成。
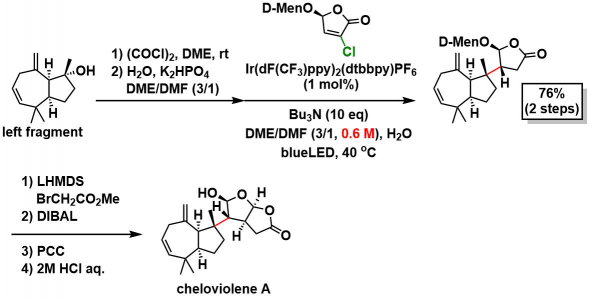
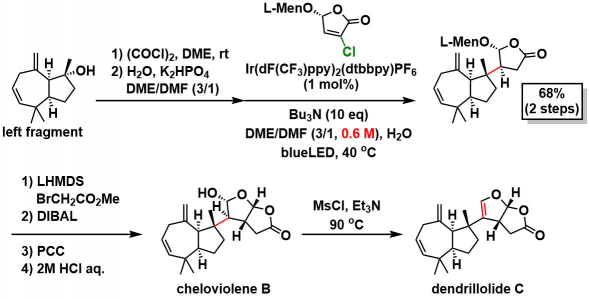
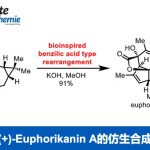
类似物的全合成:使用带有手性辅助基的氯代丁烯内酯,使用同样的方法得到非对映异构体。然后经过4步全合成cheloviolene B(X射线单晶衍射确定结构),修正了以前报道中的结构错误。然后脱水得到dendrillolide C。
读后感
- 在温和的Ir-phoxox氧化条件下进行的关键反应是最大的特点。而且使用的原料也是容易制备的,并且反应条件可以生成邻位没有杂原子也无π电子稳定系的叔碳自由基,相比于单纯的羧酸盐脱炭酸的process来说,更稳定。
- 本以为HAT催化剂催化的C-H活化也应该同样可以实现,然而可能位置选择性是个问题(底物中很多3级C-H共存)。
参考文献
- (a) Nawrat, C. C.; Jamison, C. R.; Slutskyy, Y.; MacMillan, D. W. C.; Overman, L. E. J. Am. Chem. Soc. 2015, 137, 11270. DOI: 10.1021/jacs.5b07678
- Schnermann, M. J.; Overman, L. E. Angew. Chem., Int. Ed. 2012, 51, 9576. DOI: 10.1002/anie.201204977
- Kreiser, W.; Below, P. Liebigs Ann. Chem. 1985, 203.
- Stork, G.; Cama, L. D.; Coulson, D. R. J. Am. Chem. Soc. 1974, 96, 5268. DOI: 10.1021/ja00823a052
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.