作者:杉杉
导读:
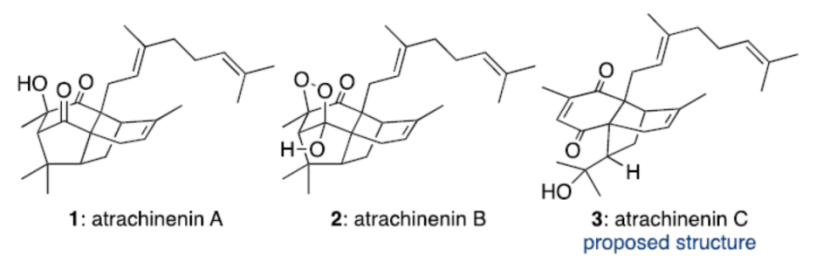
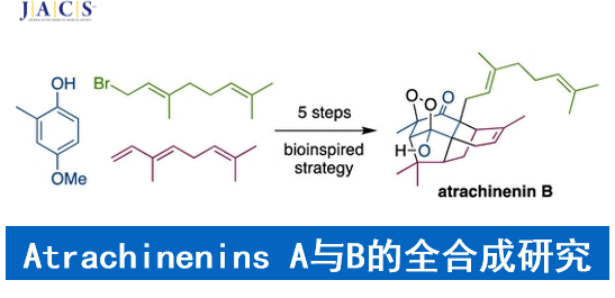
近日,澳大利亚Adelaide大学的J. H. George小组成功完成一种全新的天然产物atrachinenins A与B的仿生全合成路线设计。这一路线设计中的关键步骤主要涉及分子间Diels-Alder反应、分子内(3+2)环加成以及后期的氧化环化反应。同时,作者进一步对atrachinenin C的分子结构进行修正。
Total Synthesis of Atrachinenins A and B
A. French, C. J. Sumby, D. M. Huang, J. H. George, J. Am. Chem. Soc.2022, 144, 22844.doi: 10.1021/jacs.2c09978.
正文:
天然产物atrachinenins A-C (1–3,Figure 1)已经由Atractylodes chinesis的根茎中成功分离。这里,受到Chen小组对于Atrachinenins A与B生物合成反应路径[1]相关报道的启发,澳大利亚Adelaide大学的J. H. George小组成功完成一种全新的天然产物atrachinenins A与B的仿生全合成路线设计,并进一步对atrachinenin C的结构进行修正。
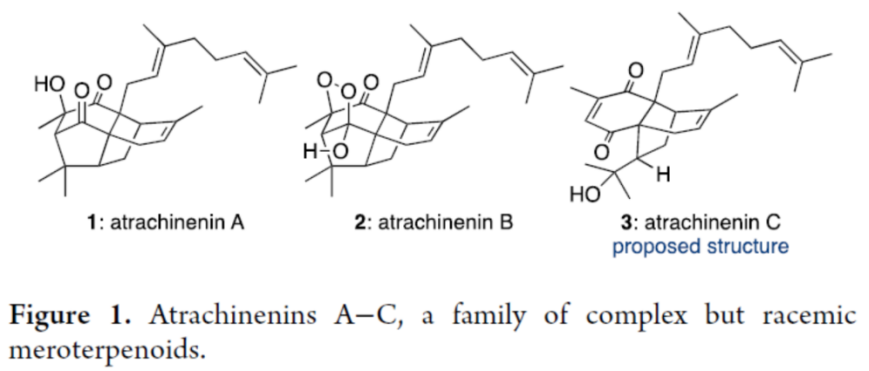
首先,该小组基于Chen团队提出的生物合成路径 (Scheme 1),提出天然产物atrachinenins A与B的全合成路线设计中的关键砌块、起始原料及关键反应步骤,主要涉及:通过起始原料4与5之间的仿生Diels−Alder反应 (biomimetic Diels−Alder reaction),获得endo-型砌块6、通过endo-型砌块6 参与的C-5烯醇化过程,获得烯醇砌块7,再通过砌块7参与的(2 + 2)光环加成步骤,形成环丁烷砌块8,通过砌块8参与的插烯α-酮醇重排 (vinylogous α-ketol rearrangement)反应步骤,获得相应的二酮砌块9。通过二酮砌块9与三线态氧分子之间的氧化环化过程,完成atrachinenins B (2)分子中的过氧半缩醛 (peroxyhemiacetal)结构单元构建,2经历后续的还原步骤,进而完成atrachinenins A 分子中三级醇结构单元的构建。
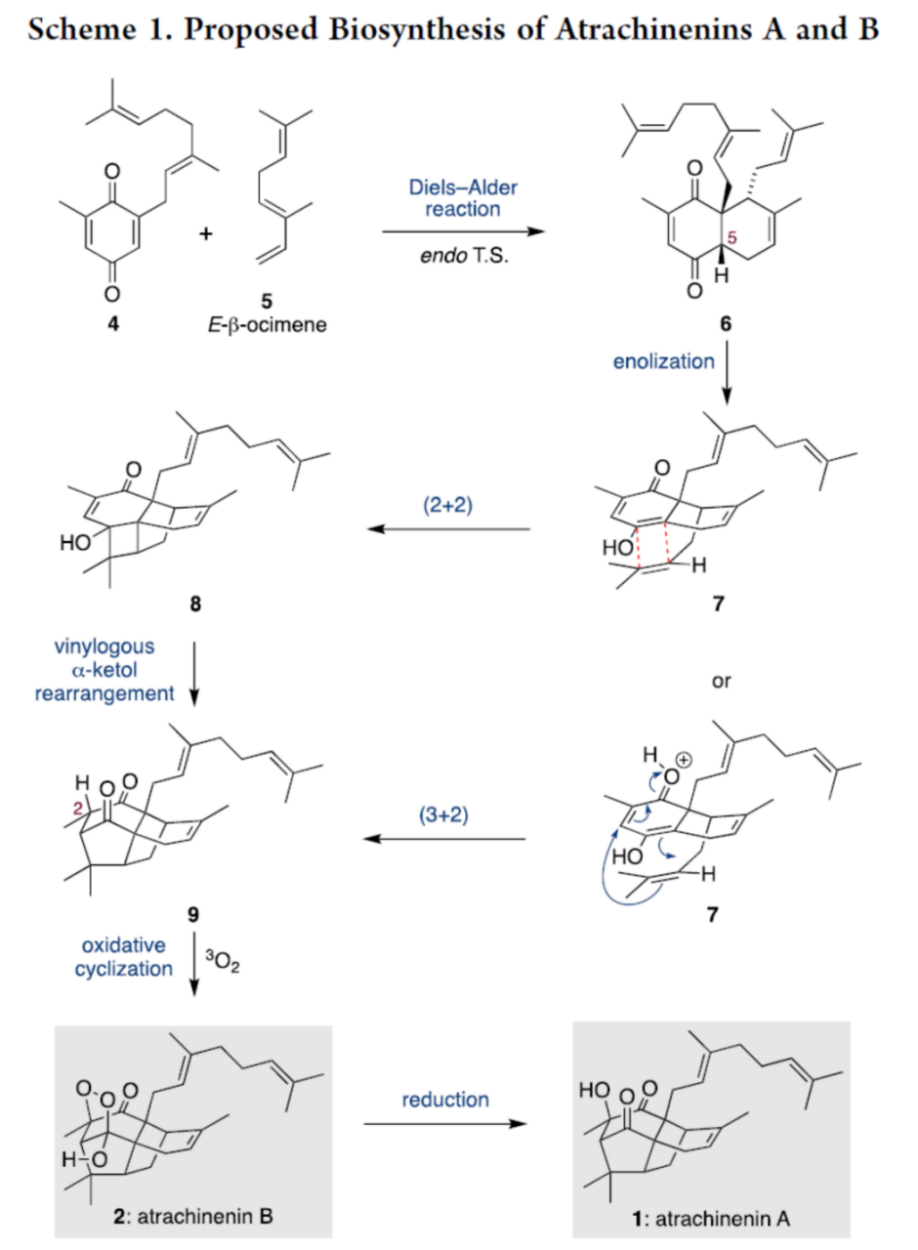
同时,该小组通过砌块5与10之间的on-water Diels−Alder反应[2],完成烯二酮砌块12的构建,并进一步对烯二酮砌块12参与的分子内环加成过程的反应条件进行深入研究 (Scheme 2)。
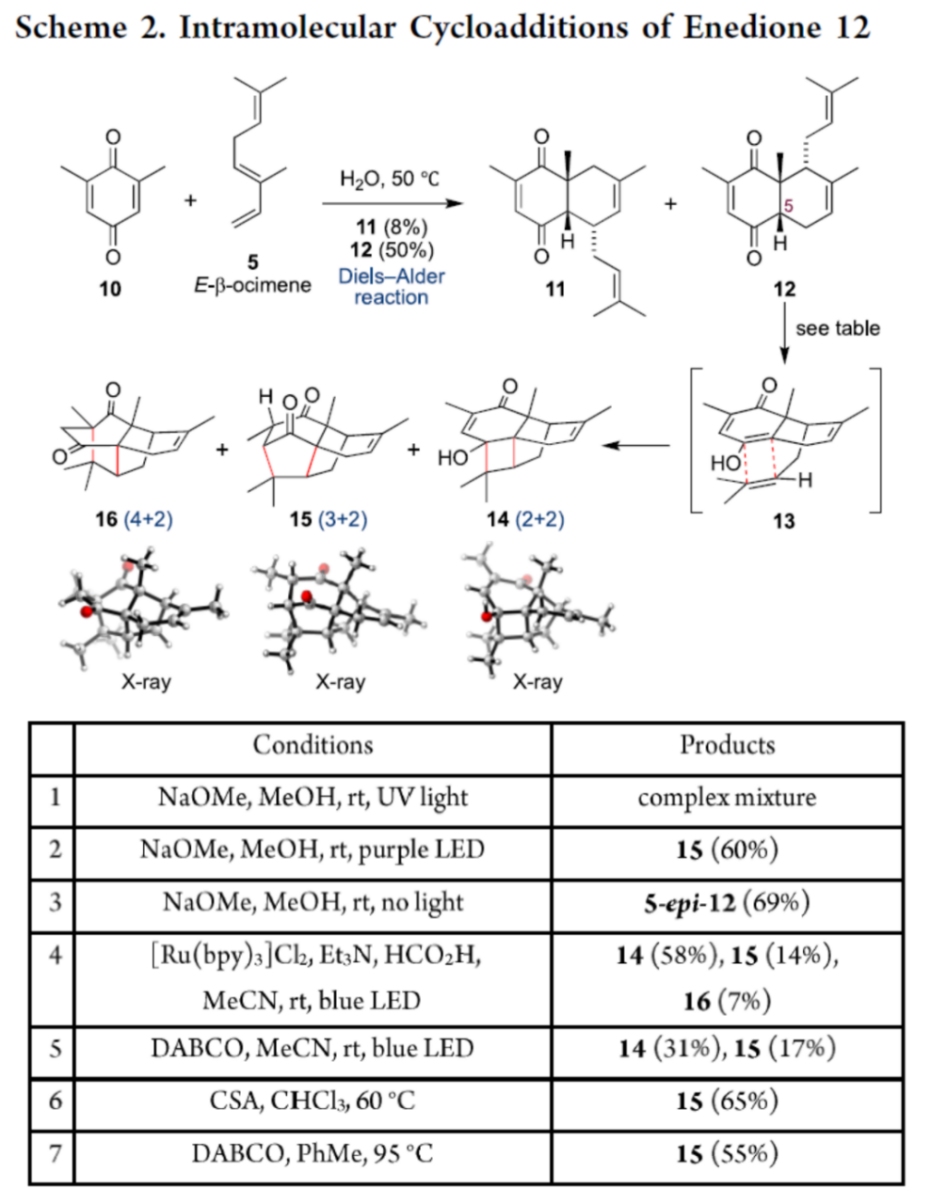
之后,该小组通过环丁烷砌块14进行atrachinenin A、atrachinenin B以及atrachinenin C类似物的发散合成研究 (Scheme 3)。
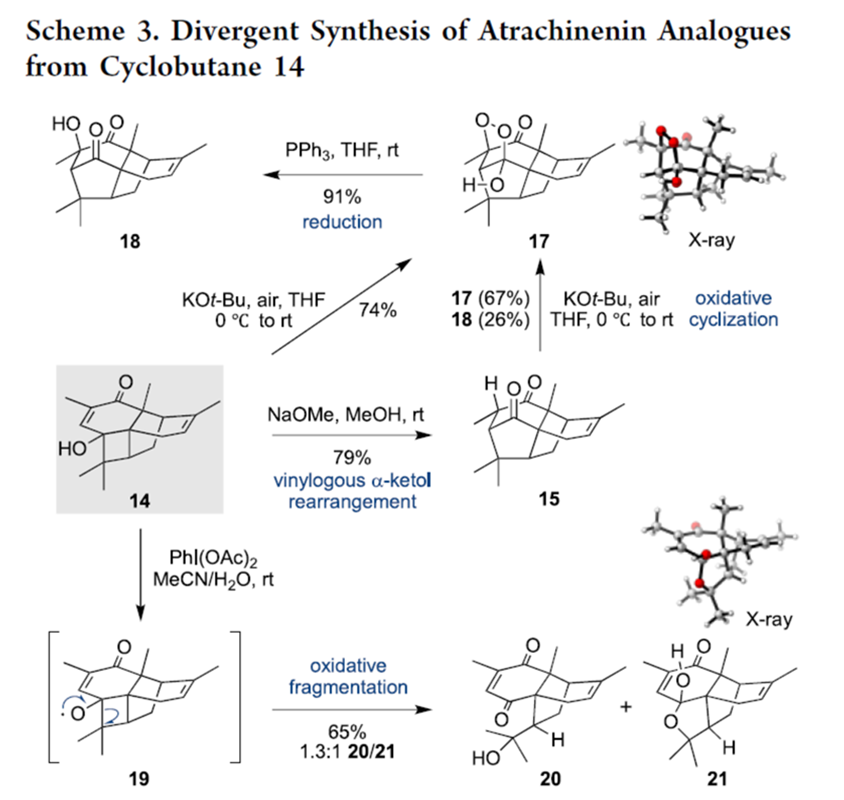

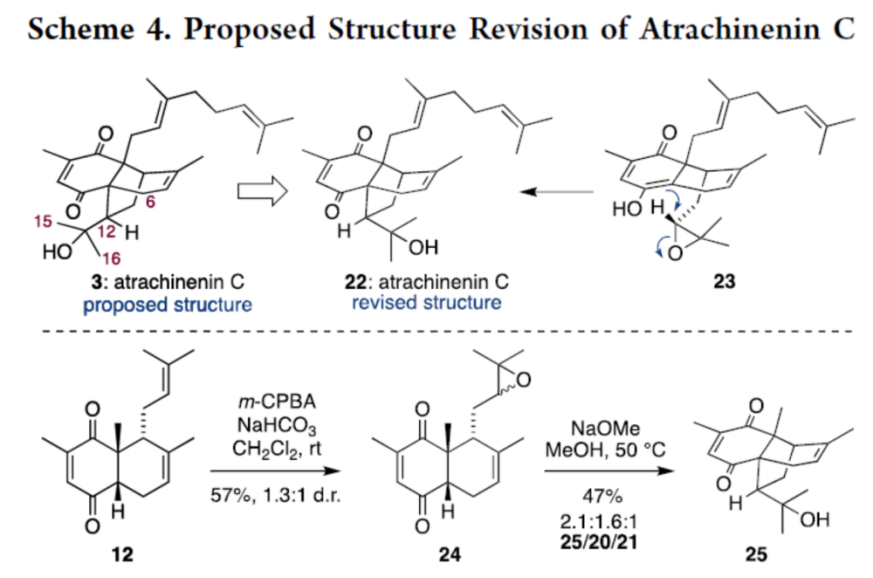
同时,该小组基于之前提出的结构3与模型化合物20之间在Me-15, Me-16, H-12以及H-6位置的1H-与13C-NMR信号之间的显著差异,进一步对atrachinenin C的结构进行修正 (Scheme 4)。

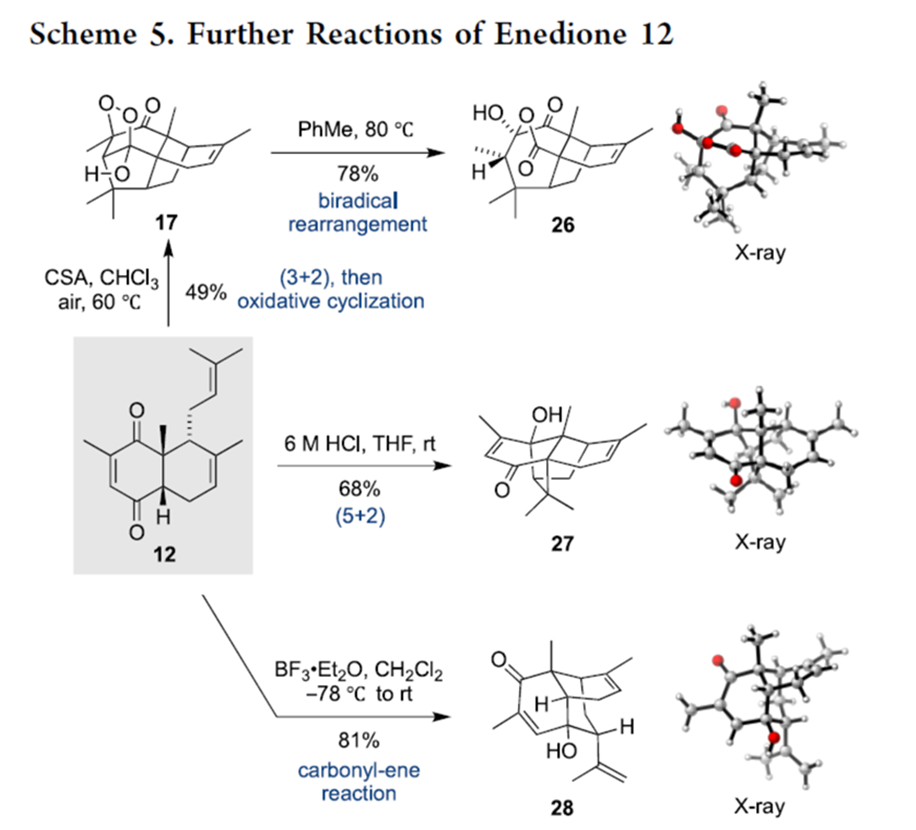
之后,该小组进一步对烯二酮砌块12在不同酸存在条件下的环化过程进行深入研究 (Scheme 5)。
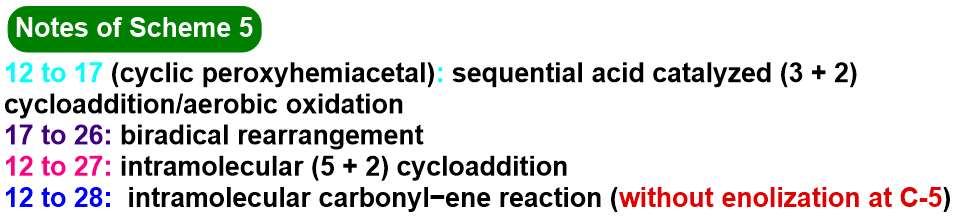
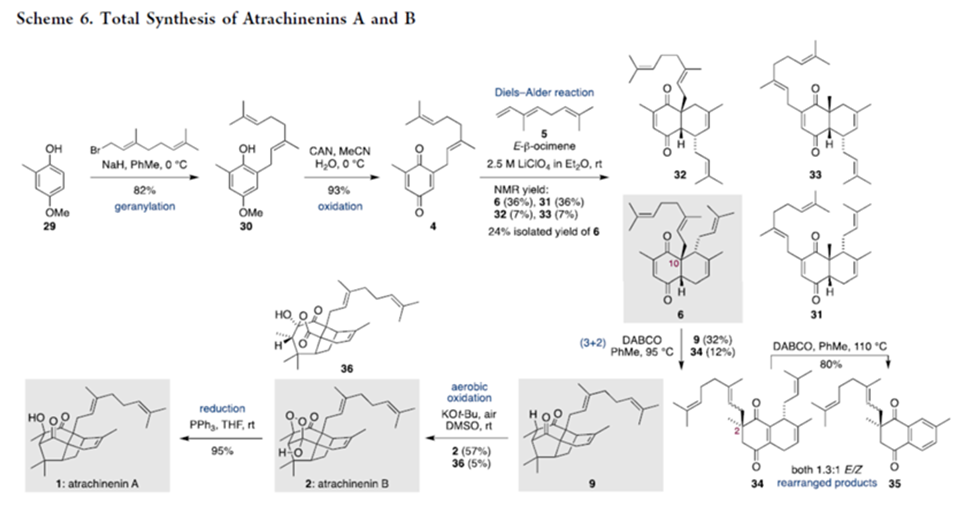
接下来,该小组进一步通过酚砌块29,成功完成atrachinenin A与B的全合成 (Scheme 6)。
总结:澳大利亚Adelaide大学的J. H. George小组一种全新的天然产物atrachinenins A与B的仿生全合成路线设计。其中,关键步骤主要涉及分子间Diels-Alder反应、分子内(3+2)环加成以及后期的氧化环化反应。同时,作者进一步对atrachinenin C的结构进行修正。
参考文献:
- [1] F. Chen, D. Liu, J. Fu, J. Yang, L. Bai, W. Zhang, Z. Jiang, G. Zhu, Chin. J. Chem. 2022, 40, 460. doi:10.1002/cjoc.202100700.
- [2] R. Breslow, Acc. Chem. Res. 1991, 24, 159. doi: 10.1021/ar00006a001. (b) S. Narayan, J. Muldoon, M. G. Finn, V. V. Fokin, H. C. Kolb, K. B.Sharpless. Angew. Chem. Int. Ed. 2005, 44, 3275. doi: 10.1002/anie.200462883. (c) H. C. Lam, H. P. Pepper, C. J. Sumby, J. H. George, Angew. Chem. Int. Ed. 2017, 56, 8532.doi: 10.1002/anie.201700114.
- [3] E. Zhang, C. Fan, Y. Tu, F. Zhang, Y. Song, J. Am. Chem. Soc. 2009, 131, 14626. doi: 10.1021/ja906291n.
- [4] (a) Y. Liang, N. Jiao, Angew. Chem. Int. Ed. 2014, 53, 548. doi: 10.1002/anie.201308698. (b) L. Novkovic, M. Trmcic, M. Rodic, F. Bihelovic, M. Zlatar, R. Matovic, R. N. Saicic, RSC Adv. 2015, 5, 99577. doi: 10.1039/C5RA13476E.
- [5] H. Kinouchi, K. Sugimoto, Y. Yamaoka, H. Takikawa, K. Takasu, J. Org. Chem. 2021, 86, 12615. doi: 10.1021/acs.joc.1c01108.
- [6] P. A. Grieco, J. J. Nunes, M. D. Gaul, J. Am. Chem. Soc. 1990, 112, 4595. doi: 10.1021/ja00167a096.
- [7] C. M. Williams, L. N. Mander, Tetrahedron 2001, 57, 425. doi: 10.1016/S0040-4020(00)00927-3.
- [8] (a) B. Miller, Acc. Chem. Res. 1975, 8, 245. doi: 10.1021/ar50091a005. (b) Y. Fujimoto, K. Takahashi, R. Kobayashi, H. Fukaya, H. Yanai, T. Matsumoto, Synlett 2020, 31, 1378. doi: 10.1055/s-0040-1707117.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载




















No comments yet.