本文作者:杉杉
导读
近日,美国Colorado州立大学 (Colorado State University)的J. S. Bandar课题组报道一种通过Lewis碱性盐试剂促进的苄基三甲基硅烷与(杂)芳基腈、砜以及氯代之间的交叉偶联反应方法学,进而获得一系列1,1-二芳基烷烃衍生物。值得注意的是,这一全新的偶联策略中,选择稳定、廉价并易于制备的有机硅烷作为偶联参与物,同时,能够在酸性官能团的存在下,实现选择性的芳基化反应。此外,该小组通过对这一新型的偶联策略在药物类似物分子的合成以及多组分反应中的应用,进一步阐明这一全新的偶联反应方法学具有良好的合成应用价值。
Lewis Basic Salt-Promoted Organosilane Coupling Reactions with Aromatic Electrophiles
T. W. Reidl, J. S. Bandar, J. Am. Chem. Soc. 2021, 143, 11939. doi: 10.1021/jacs.1c05764.
正文
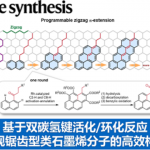
1,1-二芳基烷烃是一类具有较高应用价值的有机分子,通常采用官能团化的苄基试剂与芳香亲电底物之间的偶联反应策略,完成上述分子的制备。其中,过渡金属催化的芳卤或芳基拟卤代物与苄基镁、锌以及硼化合物之间的偶联反应方法学应用最为广泛。然而,上述策略中,通常需要原位制备出具有较高反应活性的苄基试剂,因此,实验操作较为繁琐。由此,有机合成化学家开始致力于设计全新的偶联反应策略,进而实现1,1-二芳基烷烃分子的高效构建。
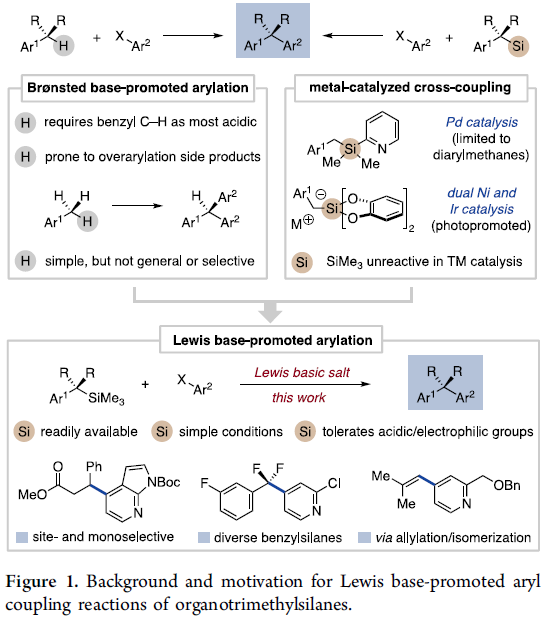
苄基去质子化反应方法学[1]作为一种极具吸引力的反应策略,能够通过碳负离子中间体的形成,进而与芳基亲电底物在金属催化剂存在或无催化剂存在的条件下,完成相应的偶联反应过程 (Figure 1, left)。然而,这一策略中,却伴随多芳基化副产物的产生,并且,需要选择具有一定酸性的前亲核底物,例如二芳基甲烷。同时,上述去质子活化过程的底物应用范围同样较为有限。
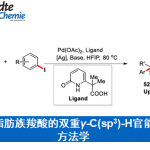
为解决上述问题,本课题组开始致力于设计一种采用碱促进的全新的苄位芳基化策略,反应过程中涉及Lewis碱对于具有一定Lewis酸性的苄基化合物的活化,进而实现芳基Csp2-Csp3键之间的偶联过程[2]。其中,由于苄基三甲基硅烷具有良好的空气稳定性、无吸湿性以及廉价易得等优势,由此成为较为理想的偶联底物。以此同时,涉及复杂苄基三甲基硅烷合成[3]的相关反应策略已有文献报道。而且,迄今为止,由于苄基三甲基硅烷分子所具有的高度稳定性,致使其在金属催化的交叉偶联反应过程中,无法表现出良好的反应活性,进而使其在芳基化反应方法学中的应用受到较大限制[4]。为进一步解决上述反应过程中存在的局限,同样有文献报道采用钯催化以及金属光氧化还原催化[5]的相关偶联反应策略 (Figure 1, right)。
这里,J. S. Bandar课题组报道一种全新的,通过Lewis碱性盐试剂促进的苄基三甲基硅烷与各类芳香亲电底物之间的直接偶联反应方法学,进而获得一系列相应的1,1-二芳基烷烃衍生物 (Figure 1, bottom)。值得注意的是,在这一全新的偶联策略中,苄位的芳基化能够与潜在的负离子副反应进行有效的竞争,进而使这一新型的偶联反应过程,能够与底物中存在的酸性与亲电官能团良好地进行兼容。并且,同样能够良好地应用于其它硅烷底物以及其它相关的反应序列,例如采用烯丙基硅烷参与的串联芳基化/异构化反应方法学,能够较好地完成各类芳基烯分子的构建。因此,采用Lewis碱促进的芳基化反应方法学,具有良好的合成实用性以及较为广泛的底物适用范围。
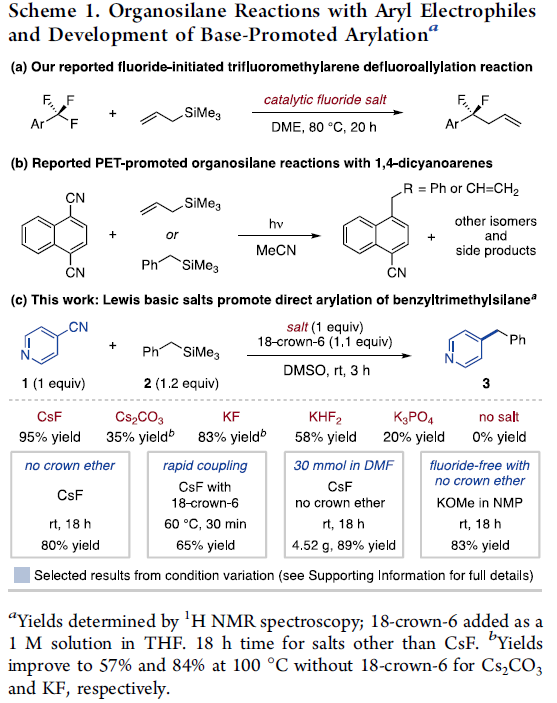
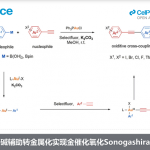
同时,在2019年,J. S. Bandar团队报道一种通过氟离子活化的烯丙基三甲基硅烷与三氟甲基芳烃之间的单选择性去氟烯丙基化反应方法学 (monoselective defluoroallylation)[6]。其中,反应过程涉及负离子烯丙基中间体的形成,并进一步与三氟甲基芳烃经历单电子转移过程,进而使C-F键断裂,并通过形成的二氟苄基自由基,进行后续的烯丙基化过程 (Scheme 1a)。这一策略类似于采用烯丙基三甲基硅烷进行的1,4-二氰基芳烃的光诱导电子转移 (PET)烯丙基化过程,即反应机理中,SET过程先于C-C键的形成过程 [7]。同时,在PET过程的研究中,该小组同样对苄基三甲基硅烷的应用进行研究。然而,上述的PET烯丙基化过程具有较低程度的区域选择性以及副产物形成的问题,同时,反应过程中需要进一步采用紫外光辐射 (Scheme 1b) [8]。基于上述的研究报道,作者假设,有机三甲基硅烷通过Lewis碱的活化,能够良好地促进其与其它芳香亲电底物之间的直接偶联过程。
为进一步验证这一假设,作者选择4-氰基吡啶 (1)与苄基三甲基硅烷 (2) 作为模型底物,对相应的Lewis碱进行筛选。最终,该小组确定出最佳的反应条件为:采用1 eq.的氟化铯为碱,同时加入1.1 eq.18-crown-6,在DMSO作为反应溶剂以及室温的反应条件下,反应时间为3 h,进而获得95%收率的偶联产物3 (Scheme 1c)。
在上述的最佳反应条件下,作者首先对上述偶联过程的底物应用范围进行考察 (Table 1)。研究表明,缺电子的氰基吡啶与氰基苯底物能够与一系列一级、二级以及三级苄基硅烷在上述的标准反应条件下,进行相应的偶联过程,并获得最终的目标产物4–24,收率为50-94%。同时,反应过程中表现出优良的官能团兼容性。之后,该小组观察到,具有α-杂原子的苄基硅烷底物 (25–27)以及药物分子paroxetine (28)与bepotastine (29),均能够与上述的标准反应条件良好地进行兼容。
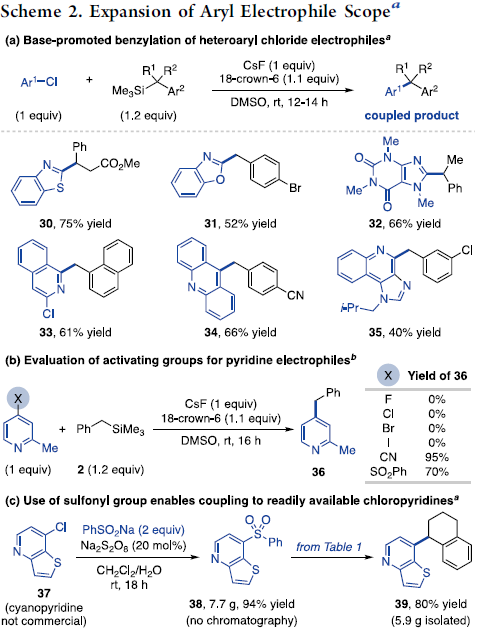
之后,作者对各类芳基亲电底物的应用范围进行考察 (Scheme 2)。研究表明,2-氯-1,3-唑类为上述偶联过程的有效底物 (30–32)。并且,具有扩张π-体系的氯代物,例如1,3-二氯异喹啉 (33)、9-氯吖啶(34)以及抗肿瘤药物分子imiquimod的氯喹啉衍生物 (35)同样能够与上述的最佳反应条件良好地兼容。同时,作者发现,尽管4-卤吡啶在上述的标准反应条件下,无法有效地进行相应的偶联过程,然而,上述的标准反应体系对于4-磺酰基吡啶 (36)底物,则能够获得具有良好收率的偶联产物 (Scheme 2b)。此外,作者观察到,将4-氯吡啶37转化为磺酰化产物38 (Scheme 2c)之后,再与苄基硅烷进行上述的偶联过程,最终能够顺利获得相应的二芳基烷烃产物39。
接下来,作者进一步对有机硅化合物40与各类芳基与杂芳基亲电底物之间的偶联过程进行进一步研究 (Figure 2)。该小组观察到,通过化合物40参与的偶联过程,最终能够获得一系列相应的chlorpheniramine类似物,例如41–48,收率为45-95%。
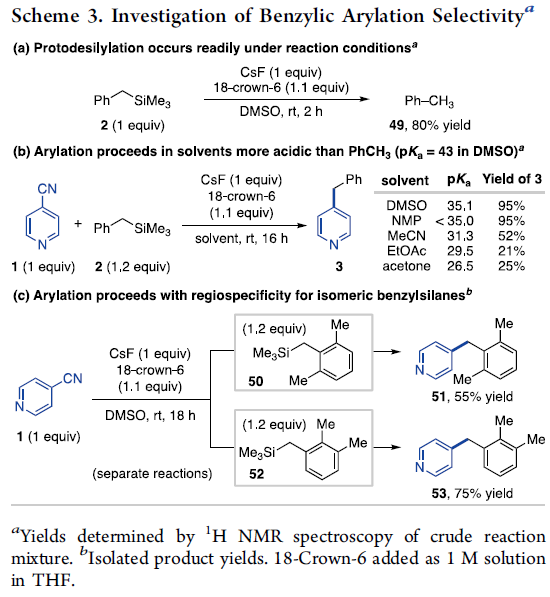
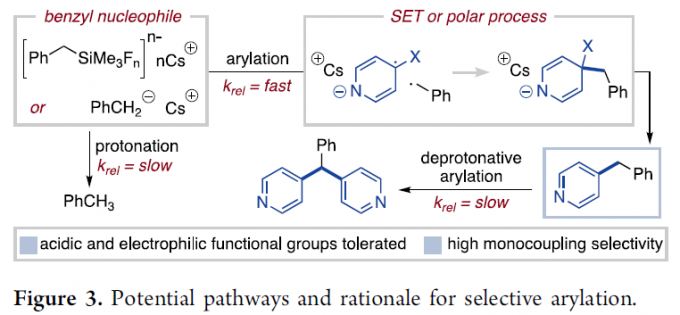
此外,作者还同样对上述偶联过程的选择性进行深入研究 (Scheme 3)。首先,作者发现,芳基亲电底物2在上述的标准反应条件下,能够获得80%收率的甲苯产物 (Scheme 3a)。进而表明苄基的质子化过程与芳基化过程之间存在竞争。然而,较为有趣的是,在酸性显著高于甲苯的反应溶剂中,4-氰基吡啶的苄基化过程同样能够较好地进行 (Scheme 3b)。此外,作者在选择苄基硅烷的两种区域异构体 (50与52) 参与的偶联过程中发现,上述苄基硅烷的芳基化过程能够区域专一性地在具有TMS基团的位置进行 (Scheme 3c)。进而表明,芳基化过程在质子转移之前进行。同时,研究发现,具有一定酸性的二芳基烷烃产物的去质子化过程受到极大程度的抑制,进而能够进一步抑制多芳基化副反应过程的进行。上述事实同样表明,Lewis碱促进的芳基化反应方法学具有显著的优势,而在Brønsted碱参与的芳基化过程中,则无法形成相应的苄基碳负离子。同时,可能出现多重芳基化的副反应。并且,在具有多重苄基位置取代的相关底物中,无法获得较为优良的选择性 (详见Supporting Information)。
为解释上述芳基化过程中的高度选择性,作者假设苄基负离子中间体通过极性或SET机理,进行快速的芳香取代过程 (Figure 3)。其中,SET机理过程通过碱性条件促进,并类似于有机硅烷与1,4-二氰基芳烃之间PET反应。并且,极性机理同样具有合理性,因为氰基芳烃与磺酰基芳烃分子能够参与通过典型的加成-消除过程进行的取代反应。而在负离子试剂对于类似亲电底物的加成过程中,准确区分上述两种不同的机理路径,则具有较大的挑战性。并且,上述的偶联反应过程中的相关实验结论,均能够通过极性与SET两种不同的机理路径进行合理的解释。同时,作者发现上述的偶联反应方式可能具有相关的底物依赖性,尽管相应的芳基化过程能够与其它通过潜在负离子中间体引发的副反应过程有效地进行竞争。
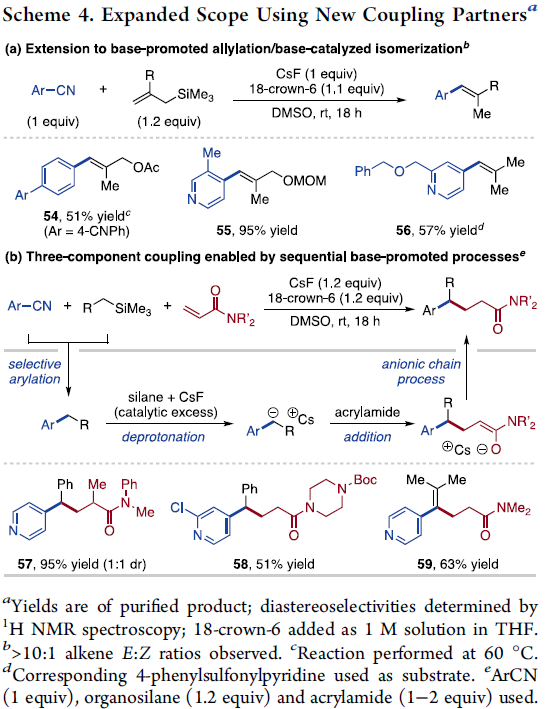
通过上述研究,作者设想,有机硅烷的芳基化过程同样能够与碱促进的其它合成转化过程进行有效地结合 (Scheme 4)。首先,作者发现,通过烯丙基三甲基硅烷形成的烯丙基芳烃中间体,能够进一步经历后续的立体选择性异构化过程,并获得相应的烯产物54、55与56 (Scheme 4a)。之后,该小组进一步设计出一种有机硅烷、芳基亲电底物与Michael受体之间的三组分偶联策略。作者假设反应过程中,首先进行有机硅烷与芳基亲电底物之间选择性的苄基芳基化步骤,之后,通过剩余有机硅烷与负离子的结合,进而引发后续的Michael加成反应 (Scheme 4b)。同时,作者发现,γ,γ-二芳基酰胺57与58同样能够通过上述的三组分反应策略进行有效的制备。之后,该小组观察到,采用甲基烯丙基三甲基硅烷底物时,能够通过碱促进的三步选择性的反应过程 (即芳基化、加成与烯基异构化),最终形成四取代烯基化合物59。
总结
美国Colorado州立大学的J. S. Bandar课题组报道一种通过Lewis碱性盐试剂促进的苄基以及烯丙基三甲基硅烷与(杂)芳基腈、砜以及氯代物之间的偶联反应方法学。并且,通过这一全新的偶联策略,能够以优良的区域选择性与单选择性 (monoselectivity),获得一系列1,1-二芳基烷烃以及芳基烯衍生物。同时,上述策略与现有的合成转化方法学形成有效的互补。此外,该小组通过上述偶联策略在药物类似物分子的合成以及在多组分反应中的应用,进一步阐明这一全新的偶联反应方法学具有良好的合成应用前景。
参考文献
[1] (a) M. Li, S. Berritt, L. Matuszewski, G. Deng, A. Pascual-Escudero, G. B. Panetti, M. Poznik, X. Yang, J. J. Chruma, P. J. Walsh, J. Am. Chem. Soc. 2017, 139, 16327. doi: 10.1021/jacs.7b09394.(b) X. Ji, T. Huang, W. Wu, F. Liang, S. Cao, Org. Lett. 2015, 17, 5096. doi: 10.1021/jacs.7b09394.
[2] M. Takeda, K. Nagao, H. Ohmiya, Angew. Chem. Int. Ed. 2020, 59, 22460. doi: 10.1002/anie.202010251. [3] (a) S. Utsumi, T. Katagiri, K. Uneyama, Tetrahedron 2012, 68, 1085. doi: 10.1016/j.tet.2011.11.082.(b) P. K. Kundu, S. K. Ghosh, Tetrahedron 2010, 66, 8562. doi: 10.1016/j.tet.2010.09.001.
[4] (a) Y. Wu, S. Bouvet, S. Izquierdo, A. Shafir, Angew. Chem. Int. Ed. 2019, 58, 2617. doi: 10.1002/anie.201809657.(b) J. Dong, X. Wang, Z. Wang, H. Song, Y. Liu, Q. Wang, Org. Chem. Front. 2019, 6, 2902. doi: 10.1039/C9QO00690G.
(c) M. Puthanveedu, V. Polychronidou, A. P. Antonchick, Org. Lett. 2019, 21, 3407. doi: 10.1021/acs.orglett.9b01141.
[5] (a) K. Itami, M. Mineno, T. Kamei, J. Yoshida, Org. Lett. 2002, 4, 3635. doi: 10.1021/ol026573t.(b) V. Corcé, L.-M. Chamoreau, E. Derat, J.- P. Goddard, C. Ollivier, L. Fensterbank, Angew. Chem. Int. Ed. 2015, 54, 11414. doi: 10.1002/anie.201504963.
[6] C. Luo, J. S. Bandar, J. Am. Chem. Soc. 2019, 141, 14120. doi: 10.1021/jacs.9b07766. [7] Y. Liu, H. Li, S. Chiba, Org. Lett. 2021, 23, 427. doi: 10.1021/acs.orglett.0c03935. [8] Y. Deng, Q. Liu, A. B. Smith, III. J. Am. Chem. Soc. 2017, 139, 9487. doi: 10.1021/jacs.7b05165.






















No comments yet.